Slit2/Robo4信号通路在神经元迁移中的活力与凋亡影响
2015-03-15刘忠志张正洪湖北医药学院附属东风医院神经内科湖北十堰442000
刘忠志,张正洪(湖北医药学院附属东风医院神经内科,湖北十堰 442000)
Slit2/Robo4信号通路在神经元迁移中的活力与凋亡影响
刘忠志,张正洪(湖北医药学院附属东风医院神经内科,湖北十堰 442000)
目的 探讨Slit2/Robo4信号通路在神经元迁移中的活力与凋亡影响,为阐明脑缺血后神经血管新生的机制提供理论和实验依据。方法 选择成年雄性远交群(SD)大鼠,建立缺血性脑卒中动物模型,采用Western blot方法测定梗死侧与非梗死侧Slit2和Robo4的表达。取原代培养10~14 d的神经元种六孔板,分为加药组H2O2(100 μmol/L)、对照组、H2O2(100 μmol/L)+Slit2 (3 μg/mL)组,行MTT方法检测细胞活力与双染流式细胞术检测细胞凋亡情况。结果 Western blot结果显示,梗死侧Slit2和Robo4表达均较非梗死侧明显升高,差异有统计学意义(P<0.05)。100 μmol/L H2O2处理原代培养神经元24 h会导致Slit2和Robo4表达升高(P<0.05)。MTT结果示,H2O2、H2O2+Slit2组细胞活力都有明显下降,其中,H2O2+Slit2组的细胞存活率明显高于单纯H2O2组(P<0.05)。流式细胞学显示,H2O2+Slit2组的细胞凋亡率明显低于H2O2组,差异有统计学意义(P<0.05)。结论 缺血性脑卒中有内源性Slit2/Robo4信号通路的激活,而外源性Slit2可以促进氧化应激时神经元的存活能力,抑制其凋亡作用,从而起到神经保护作用。
Slit2/Robo4信号通路; 缺血性脑卒中; 神经元迁移
当前我国的缺血性脑卒中的发病率逐渐增高,病死率在20%左右,严重影响患者的身心健康[1]。众所周知,当脑组织遭受到缺血、缺氧和外伤等有害刺激时,机体会启动自身的固有机制,可达到减轻神经细胞损伤的目的[2-3]。其中机体引起的氧化应激会损伤细胞脂质膜、蛋白及DNA,导致细胞损伤。而脑组织中富含脂肪组织,对氧化应激更敏感,因而,氧化应激在脑缺血时更易引起神经组织的损伤[4]。在治疗中,积极促进缺血性脑卒中神经元的存活能力,抑制神经元的凋亡,减少神经元损失,能有效改善预后[5-6]。近年来,随着医学分子生物学的发展,许多研究者正关注于研究抑制内源性缺血损伤反应和增强内源性神经保护作用的途径,从而促进脑组织修复和再生[7]。20世纪末,Slit/Robo信号通路已经被明确阐述为细胞膜外蛋白,具有排斥、引导神经元轴突方向,控制神经元迁移等作用[8]。其中Slit2在肿瘤细胞的代谢中起着重要的作用,Slit2对于神经元的出芽和血管的再生作用可能与神经再生有关,Robo4作为一种Slit的血管专门受体[9]。Slit2分别通过与Robo4结合后抑制血管的再生,同时,通过抑制水肿的形成和组织损伤在缺血发生后发挥保护作用[10]。另外有研究表明,缺血性脑卒中后有内源性血管新生,新生的血管可更好地促进神经功能的恢复。为此,相关研究者逐渐开始致力于脑血管生成机制的研究,寻找治疗缺血性脑卒中新的、更有效的治疗策略[11-12]。本文具体探讨了Slit2/Robo4信号通路在神经元迁移中的活力与凋亡影响,希望为阐明脑缺血后神经血管新生机制提供理论和实验依据。
1 材料与方法
1.1 研究材料 选择成年雄性远交群(SD)大鼠,为出生后1~3 d SD新生鼠(200~250 g),清洁级,由本院动物中心提供,符合动物伦理学和动物实验基本管理条例。
1.2 动物模型的建立 本文建立了缺血性脑卒中动物模型,其构建措施为:SD大鼠进行10%水合氯醛35 mL/kg麻醉、剪毛、消毒;选择颈部正中切口,分离浅筋膜,暴露颈前肌群,可见颈总动脉,分离动脉鞘和迷走神经。结扎颈总动脉近心端,蛙心夹夹闭颈外动脉,打结颈总动脉近分叉处;选择7号头皮针扎颈外动脉分叉处,闭合创口。2 h后进行神经功能缺损评分,选择评分结果为1~3分为成功模型进行实验。
1.3 分组 SD大鼠行线栓法大脑动脉阻断缺血模型3 d后杀死,取双侧大脑半球,以非梗死侧为对照组,选择Western blot方法检测Slit2/Robo4信号途径分子Slit2和Robo4变化。然后取原代培养10~14 d的神经元种六孔板,分为加药组H2O2(100 μmol/L)及对照组,也采用Western blot方法检测上述指标的变化。同时,取原代培养10~14 d的神经元种板,待24 h后细胞生长较为丰满为加药,分对照组、H2O2(100 μmol/L)组、H2O2(100 μmol/L)+Slit2(3 μg/mL)组,共3组,作用24 h后收集细胞行MTT方法检测细胞活力,双染流式细胞术检测细胞凋亡情况。

2 结 果
2.1 缺血性脑卒中的Slit2/Robo4信号通路变化对比 经过判定,动物模型都构建成功,同时,用抗神经元特异中间丝蛋白NESTIN抗体鉴定原代培养的神经元。结果显示,90%以上实验材料为NESTIN阳性细胞,即神经元含量占90%以上。笔者采用Western blot方法测定梗死侧与非梗死侧Slit2和Robo4的表达,结果显示梗死侧Slit2和Robo4表达均较非梗死侧明显升高,差异有统计学意义(P<0.05)。见图1。

图1 动物模型中Shh信号传导通路相关信号分子表达改变
2.2 神经元氧化应激Slit2/Robo4信号通路变化对比 笔者以100 μmol/L H2O2处理原代培养神经元24 h,Western blot方法观察Slit2/Robo4信号通路分子表达改变,结果均有Slit2和Robo4表达升高(P<0.05),表明神经元氧化应激损伤早期即有Slit2/Robo4信号通路的激活。见图2。
2.3 细胞活力及凋亡的影响 原代培养10~14 d的神经元种六孔板,待24 h后细胞生长较为丰满为加药,分为对照组、H2O2(100 μmol/L)组、H2O2+Slit2组,作用24 h后收集细胞,观察细胞凋亡及存活的改变。MTT结果示,H2O2、H2O2+Slit2组细胞活力都有明显下降,其中H2O2+Slit2组的细胞存活率明显高于单纯H2O2组(P<0.05),说明Slit2/Robo4信号通路可以促进氧化应激时神经元的存活。流式细胞学显示,H2O2+Slit2组的细胞凋亡率明显低于H2O2组,差异有统计学意义(P<0.05),提示Slit2/Robo4信号通路氧化应激时具有抗神经元凋亡作用。见图3、4。

图2 氧化应激Shh信号传导通路相关信号分子表达改变
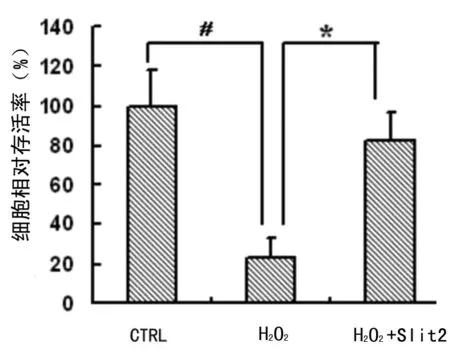
图3 Hochest染色Shh对神经元氧化应激时神经元凋亡的影响(定量)
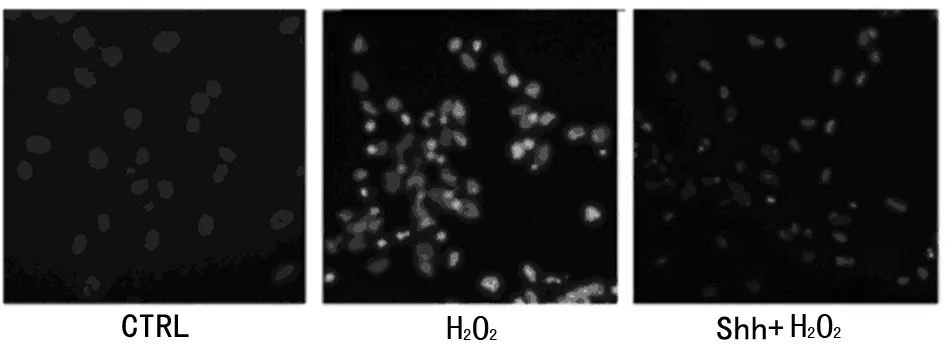
图4 Hochest染色对神经元氧化应激时神经元凋亡的影响(定性)
3 讨 论
当前,对于缺血性脑卒中的有效治疗手段仍非常有限,在脑缺血时,防御和应激反应可触发和启动一系列内源性神经保护,其作用机制涉及腺苷、神经营养因子等多个环节。虽然目前内源性神经保护作用的存在和增强可显著改善脑组织受损程度和预后已得到证实,但是具体机制还不明确[13]。
神经的连接构成了神经系统的发育基础,在神经系统的发育过程中,轴突的生长受生长锥生长方向的分子调节和控制。一些轴突生长导向因子通过调节轴突生长时的吸引排斥信号影响轴突生长,这种信号调控也有助于血管的再生[14]。神经生长导向分子与生长抑制分子都由轴突延伸的四周和靶组织细胞产生,其可以与相应的特定受体分子作用,引导轴突靶向延伸,一些经典的神经生长导向因子在脑缺血时对神经元和血管均可起到促进新生进而改善神经功能恢复的作用[15]。而Slit是发现的第一种对神经生长和神经元迁移都有导向作用的因子,促进轴突向正确的方向延伸,同时,对神经元的迁移也有导向作用[16]。Slit可与其跨膜受体Roundabout(Robo)蛋白家族相结合,受体Robo主要表达于神经系统,Slit/Robo不仅参与生理病理情况下的突触可塑性调节,而且还参与了各种肿瘤细胞的生长以及肿瘤血管生成的调节。研究已证明,在大鼠全脑缺血模型及神经元/神经胶质细胞模型中,Slit可以减少神经元和神经胶质细胞的死亡,并且Slit/Robo对神经元/神经胶质细胞具有直接的保护作用。
本文结果显示,梗死侧Slit2和Robo4表达均较非梗死侧明显升高,差异有统计学意义(P<0.05),提示在损伤早期即有Slit2和Robo4表达的明显上调,提示Slit2/Robo4信号传导通路可能为快速损伤反应因子,可能是一个对损伤反应的内源性保护机制。有研究也认为Slit2与Robo4相结合,能抑制血管内皮细胞的迁移,从而抑制血管的再生,表明Slit2激动Robo4后会抑制VEGF诱导内皮细胞的迁移、重组和构建[17]。
笔者以100 μmol/L H2O2处理原代培养神经元24 h,Western blot方法观察Slit2/Robo4信号通路分子表达改变,结果均有Slit2/Robo4表达升高(P<0.05),表明神经元氧化应激损伤早期即有Slit2/Robo4信号通路的激活,同时缺血及其他损伤可以促进神经再生[18]。
凋亡是一种细胞的程序性死亡,许多刺激因素可以通过激活凋亡传导途径及级联放大反应等引起细胞凋亡。本文流式细胞学显示,H2O2+Slit2组的细胞凋亡率明显高于H2O2组,差异有统计学意义(P<0.05),提示Slit2/Robo4信号通路氧化应激时具有抗神经元凋亡作用。在神经发育的早期阶段,Slit2/Robo4信号通路参与细胞凋亡的调节,对正常发育的维持起到重要作用[19]。而在缺血性脑卒中,细胞凋亡是缺血半暗带区缺血再灌注损伤时细胞死亡的主要形式之一,缺血可诱发Slit2的表达,提示Slit2/Robo4信号通路在脑卒中通过抗凋亡途径可能具有潜在的治疗作用。
总之,缺血性脑卒中有内源性Slit2/Robo4信号通路的激活,而外源性Slit2可以促进氧化应激时神经元的存活能力,抑制其凋亡作用,从而起到神经保护作用,也提示Slit2/Robo4可能是缺血性脑卒中的一个重要的新的治疗靶点。
[1]Navaratna D,Guo S,Aral K,et al.Mechanisms and targets for angiogenic therapy after stroke[J].Cell Adh Migr,2009,3(2):216-223.
[2]Gorbunova EE,Gavrilovskaya IN,Mackow ER.Slit2-Robo4 receptor responses inhibit ANDV directed permeability of human lung microvascular endothelial cells[J].Antiviral Res,2013,99(2):108-112.
[3]Zhang X,Yu J,Kuzontkoski PM,et al.Slit2/Robo4 signaling modulates HIV-1 gp120-induced lymphatic hyperpermeability[J].PLoS Pathog,2012,8(1):1002-1004.
[4]Auriel E,Bomstein NM.Neuro protection in acute ischemie stroke-current status[J].J Cell mol Med,2010,14(9):2200-2202.
[5]黄莉芸,周希瑗.腺病毒介导的slit2 shRNA对缺氧诱导的人视网膜色素上皮细胞中血管内皮生长因子表达的影响[J].中国生物制品学杂志,2014,27(3):361-365.
[6]Yu J,Zhang X,Kuzontkoski PM,et al.Slit2N and Robo4 regulate lymphangiogenesis through the VEGF-C/VEGFR-3 pathway[J].Cell Commun Signal,2014,12(1):25-26.
[7]Kidd PM.Integrated brain restoration after ischemic stroke-medical management,risk factors,nutrients,and other interventions for managing inflammation and enhancing brain plasticity[J].Altern Med Rev,2009,14(1):14-15.
[8]Hou ST,Jiang SX,Smith RA.Permissive and repulsive cues and signalling pathways of axonal outgrowth and regeneration[J].Int Rev Cell Mol Biol,2008,267(12):125-127.
[9]Wang L,Zhang ZG,Gregg SR,et al.The sonic hedgehog pathway mediates carbamylated EPO enhanced proliferation and differentiation of adult neural progenitor cells[J].J Biol Chem,2007,282(10):32462-32470.
[10]Chen ZY,Asavaritikrai P,Prchal JT,et al.Endogenous erythropoietin signaling is required for normal neural progenitor cell proliferation[J].J Biol Chem,2008,282(8):25875-25883.
[11]GÖhrig A,Detjen KM,Hilfenhaus G,et al.Axon guidance factor SLIT2 inhibits neural invasion and metastasis in pancreatic cancer[J].Cancer Res,2014,74(5):1529-1540.
[12]Lu ZH,Kaliberov S,Sohn RE,et al.Transcriptional targeting of primary and metastatic tumor neovasculature by an adenoviral type 5 roundabout4 vector in mice[J].PLoS One,2013,8(12):83933-83935.
[13]Smith-Berdan S,Schepers K,Ly A,et al.Dynamic expression of the Robo ligand Slit2 in bone marrow cell populations[J].Cell Cycle,2012,11(4):675-682.
[14]Paul JD,Coulombe KL,Toth PT,et al.SLIT3-ROBO4 activation promotes vascular network formation in human engineered tissue and angiogenesis in vivo[J].J Mol Cell Cardiol,2013,64(2):124-131.
[15]Jones CA.Robo4 stabilizes the vascular network by inhibiting pathologic angiogenesis and endothelial hyperpermeability[J].Nat Med,2008,14(4):448-453.
[16]Ma C,Lu XC,Luo Y,et al.Angiogenesis related gene expression profiles of EA.hy926 cells induced by irbesartan:a possible novel therapeutic approach[J].Chin Med J (Engl),2012,125(8):1369-1375.
[17]Goto-Koshino Y,Fukuchi Y,Shibata F,et al.Robo4 plays a role in bone marrow homing and mobilization,but is not essential in the long-term repopulating capacity of hematopoietic stem cells[J].PLoS One,2012,7(11):50849-50850.
[18]Morlot C.Structural insights into the Slit-Robo complex[J].Proc Natl Acad Sci USA,2007,104(38):14923-14928.
[19]Okada Y.Transcriptional regulation of the endothelial cell-specific receptor,Robo4[J].Yakugaku Zasshi,2012,132(9):1045-1049.
The viability and apoptosis effects of Slit2/Robo4 polarity signaling in neuronal migration
LIUZhong-zhi,ZHANGZheng-hong
(Departmentofinternalmedicine,AffiliatedDongfengHospitalofHubeiMedicalCollege,Shiyan,Hubei442000,China)
Objective To investigate the viability and apoptosis effects of Slit2/Robo4 polarity signaling in neuronal migration for providing theoretical and experimental mechanisms basis for elucidating cerebral ischemia angiogenesis.Methods Adult male SD rats were established animal models of ischemic stroke,the expression of non-infarct infarction side Slit2 and Robo4 were measured by the Western blot method.The neurons cell by 10-14 days primary cultured were selected and switched to six-well plat,there were divided dosing group H2O2(100 μmol/L),the control group and H2O2(100 μmol/L)+Slit2(3 μg/mL) group,the cell viability were detected by MTT and double staining apoptosis were detected by flow cytometry.Results Western blot showed infarction side Slit2 and Robo4 expression were significantly higher than that of non-infarcted side(P<0.05).When treated by the 100 μmol/L H2O2treatment of primary cultured neurons 24 hours will cause increased expression of Slit2 and Robo4(P<0.05).MTT results shown the H2O2,H2O2+Slit2 groups had significantly decreased in cell viability,which the cell survival rate of H2O2+Slit2 group were significantly higher than those of H202group(P<0.05).The apoptosis rate of H2O2+Slit2 group were significantly lower than those of Slit2 H2O2group(P<0.05).Conclusion Ischemic stroke had Slit2/Robo4 endogenous pathway activated,and the exogenous Slit2 can promote the viability of the neuronal oxidative stress and inhibit apoptosis,thereby it can protect the neuro.
Slit2/Robo4 signaling pathway; ischemic stroke; neuronal migration
刘忠志,男,主治医师,本科,主要从事神经内科临床工作。
10.3969/j.issn.1672-9455.2015.08.015
A
1672-9455(2015)08-1065-03
2014-11-10
2014-11-22)
