抗心律失常肽对抗柯萨奇B3病毒的体外研究*
2015-03-15洪李锋湖北省武汉市第五医院心血管内科武汉大学广慈医院心血管内科江汉大学心血管研究所430050
伍 琼,盛 蕾,洪李锋(湖北省武汉市第五医院心血管内科/武汉大学广慈医院心血管内科/江汉大学心血管研究所 430050)
抗心律失常肽对抗柯萨奇B3病毒的体外研究*
伍 琼,盛 蕾△,洪李锋(湖北省武汉市第五医院心血管内科/武汉大学广慈医院心血管内科/江汉大学心血管研究所 430050)
目的 观察抗心律失常肽(AAP10)对柯萨奇B3病毒(CVB3)感染的原代小鼠心肌细胞的保护作用。方法 将BALB/C小鼠原代心肌细胞分为7组,每组12孔,分别为细胞对照组,病毒对照组,药物干预组(A组、B组、C组、D组、E组)。用不同浓度的AAP10培养液干预100 TCID50 CVB3感染的心肌细胞,对比每组的细胞活性。结果 药物干预组细胞活性高于病毒对照组(F=7.489,P<0.05)。其细胞活性与药物浓度(r=0.942,P=0.005)及作用时间(r=0.993,P<0.05)均呈正相关。结论 AAP10具有明显的抗病毒活性,呈剂量时间相关性,对CVB3感染的心肌细胞有保护作用。
抗心律失常肽; 柯萨奇B3病毒; 原代心肌细胞
抗心律失常肽(AAP10)是人们最早从牛心房肌中分离提取的由6个氨基酸组成的物质,经人工合成为具有生物活性的小分子内分泌激素即AAP10,它可以通过调节细胞间的缝隙连接通道,介导第二信使物质,影响心肌组织的分化、心肌细胞的生长和凋亡,同时具有抗心律失常、抗栓,改善心肌缺血,预防心肌病及心力衰竭的作用[1]。临床上病毒性心肌炎是以柯萨奇病毒(A组和B组)、腺病毒、巨细胞病毒、脊髓灰质炎病毒和流感病毒较常见。临床观察到SARS冠状病毒和最近流行的甲型H1N1新型病毒也可致病毒性心肌炎,心肌炎呈现急性或慢性过程。轻可无症状,重至弥漫性心肌炎引起爆发性、致命性、充血性心力衰竭及严重的恶性心律失常[2]。本研究通过建立柯萨奇B3病毒(CVB3)感染所致的心肌细胞损伤体外模型,观察AAP10抗病毒活性,为临床治疗病毒性心肌炎提供理论基础。
1 材料与方法
1.1 仪器与试剂 二氧化碳细胞培养箱(MODEL2300 SHELAB,美国);倒置显微镜(NikonT300,日本);台式高速离心机(TGL-16C,上海安亭科学仪器厂);酶联免疫检测仪(北京元业伯乐科技发展有限公司);电热恒温水浴锅(北京市医疗设备厂);生物安全柜(Costar公司,美国);电子天平(上海精密科学仪器公司天平仪器厂)等。胰蛋白酶(HyClone公司);MEM营养液,含10%的胎牛血清、谷氨酰胺2 mmol/L、青霉素100 U/mL、链霉素100 μg/mL(HyClone公司);台盼蓝(Sigma公司);AAP10(产品号:809838,杭州中肽生化有限公司)。
1.2 实验病毒 CVB3(武汉大学病毒研究所)经人宫颈癌细胞(Hela细胞,CTCC提供)培养扩增后,用Read-Much公式计算TCID50为:10-3.8/0.1 mL,小量分装在-80 ℃低温冰箱保存备用。
1.3 实验细胞 原代小鼠心肌细胞(江阴齐氏生物科技有限公司)。
1.4 方法
1.4.1 AAP10对CVB3的抑制作用 单层培养好的原代小鼠心肌细胞分为3组,细胞对照组、病毒对照组、药物干预组,每组12孔。其中药物干预组根据浓度梯度分为:A组、B组、C组、D组、E组。96孔板中每孔加入5×104的小鼠原代心肌细胞,培养48 h,细胞长成单层后,除细胞对照组外,其余各组均给予0.1 mL/孔含100 TCID50的CVB3病毒维持液,干预组分别再给予0.1 mL/孔的含5、10、15、20、25 μg/mL浓度的AAP10维持液,置5%CO237 ℃培养箱继续培养。
1.4.2 心肌细胞搏动频率、存活率及病毒抑制率的测定 在倒置显微镜下观察细胞形态及生长状态。用四氮唑盐(MTT)法测各孔在570 nm波长下第6、12、18、24、30、36、42、48小时的吸光度,即A值,观察细胞活性与时间的相关性。按下述公式计算第24小时的细胞存活率及病毒抑制率,随机计数自发搏动频率。细胞存活率(%)=(药物组A值/对照组A值)×100%,病毒抑制率(%)=(药物处理组平均A值-病毒对照组平均A值)/(正常对照组平均A值-病毒对照组平均A值)×100%[3]。

2 结 果
2.1 AAP10干预后心肌细胞形态观察 干预后观察到第24小时,病毒对照组细胞损伤坏死明显,圆缩脱落,大部分漂浮在培养液中,药物干预组细胞可保持部分贴壁生长,药物浓度较高组,细胞形态相对完整,搏动相对有力,频率较快,随时间推移,到第36~48小时,细胞生长状态逐渐稳定,无进一步损伤坏死。
2.2 心肌细胞活性、搏动频率、存活率及病毒抑制率的测定 药物干预24 h后B、C、D、E组心肌细胞活性、搏动频率、D及E组心肌细胞存活率以及病毒抑制率均与病毒对照组比较,差异有统计学意义,见表1。

表1 干预后第24小时各组心肌细胞情况比较±s)
注:与病毒对照组相比,※★P<0.05。

表2 药物干预组心肌细胞活性与药物作用时间线性相关回归分析
注:-表示无数据。

图1 AAP10作用时间细胞活性曲线
2.3 心肌细胞活性时间曲线、药物浓度曲线及相关关系 A组细胞活性与时间无相关性(r=0.513,P=0.193),当AAP10干预浓度较高(B、C、D、E组)时,心肌细胞活性与药物作用时间呈线性正相关,见表2、图1;选取干预24 h观察心肌细胞活性与药物浓度的关系,发现两者呈正相关(r=0.942,P=0.005,r2=0.888),见图2。
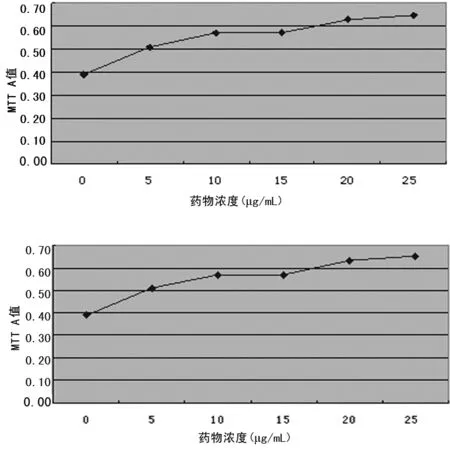
图2 AAP10作用24 h药物浓度细胞活性曲线
3 讨 论
CVB3是临床上最常见的引起病毒性心肌炎的微生物,病毒感染心肌细胞后,在心肌组织内复制引起的损伤以及同时介导自身免疫反应引起的免疫损伤是其主要发病机制[3-4]。国外基础研究发现,40岁以下有接近20%的患者死于CVB3感染所致的病毒性心肌炎。在这个过程中,TLR3-IFNβ介导的免疫反应是主要的发病机制之一,蛋白酶激活受体则可通过增加及抑制效应来调节该受体的表达。临床上对该病较难确诊,心肌活检是目前惟一有效的方法,大多数患者难以接受,Omura等[5]通过生物信息研究分析病毒性心肌炎小鼠模型可能的检测指标来为临床提供信息。Schumm等[6]则首次将1例通过心肌活检确诊的急性病毒性心肌炎患者绘制T1图像,作为一种新的检测手段指导临床应用。在治疗方面,国外有研究通过开发诱导多功能干细胞移植术来治疗传染性的病毒性心肌炎,也有通过激活基质金属蛋白酶的表达来治疗该病[7-8]。国内最新研究报道,通过注射特定的DNA疫苗来增强靶细胞免疫系统以及对抗病毒的保护能力进行治疗[9]。
AAP10作为一种人工合成的多肽,具有调节心肌细胞代谢,减轻坏死程度及延缓凋亡的作用,对于急性缺氧的乳鼠心肌细胞的体外研究中具有显著的心肌细胞保护作用。2009年,有学者发现AAP10具有增强细胞间传导,抑制细胞间的解耦联,其作用部位是心肌细胞间浆膜下的缝隙连接蛋白Cx43、Cx45,而非Cx40。另有研究发现,AAP10可通过增加缝隙链接蛋白的耦联作用来抵抗并预防抗心律失常药物引发的尖端流转型室速的发生[10]。同时,Johnstone等[11]报道,AAP10能用于治疗心律失常的机制主要是通过促使缝隙连接蛋白Cx43的表达来延长细胞有丝分裂及细胞周期,而并非是调节心肌细胞间润盘的连接通道功能来完成这一过程。还有研究报道,在缺血再灌注的小鼠模型中AAP10缺血后处理可大大减少细胞间解耦联以及抑制室性心律失常的发生。而2008年发表在我国临床心血管病杂志上的1篇报道是基于兔肥厚型心肌病模型的建立上,发现AAP10可通过显著改善缝隙连接蛋白的分布来达到改善心肌细胞的重构,防止Cx43排列紊乱,从而降低心律失常的发生率。因此,大多数研究认为AAP10作为一种新型的抗心律失常药物可逐渐替代目前市场上已有的抗心律失常药物,避免其严重不良反应的发生,而且对于缺血性心肌病、慢性房颤所致的独特性的心肌损害有较为肯定的保护作用[12]。少数研究也发现,Cx43表达水平是冠状动脉闭塞后心肌梗死面积大小的一个关键因素,通过增强细胞间传导来降低心律失常发生的药物(如AAP10)可能会增大心肌梗死的面积;而有报道,缝隙连接阻滞剂可以减少心肌梗死面积和心肌局部缺血性室性心律失常的发生,故在AAP10的研究及使用上值得进一步探讨。
病毒性心肌炎患者由于病毒感染或病毒感染后免疫反应引起的弥漫性或灶性心肌间质的炎性细胞浸润和邻近的心肌纤维坏死或退行性变,导致不同程度的心功能障碍[13]。整个过程很有可能直接影响心肌细胞间的缝隙连接通道,并影响缝隙连接蛋白的正常表达及分布。从而推测AAP10作为一种心肌保护剂及缝隙连接蛋白激动剂,给予一定的干预后可明显保护心肌,减少损伤,促使细胞膜上缝隙连接蛋白的正常表达及分布,从而对抗病毒感染所致的心肌损害。本文通过建立CVB3感染小鼠原代心肌细胞的模型,来观察给予AAP10药物之后心肌细胞的改变,发现AAP10药物干预组的心肌细胞受CVB3的损害明显减少,其减轻程度与药物浓度及作用时间呈正相关。体外研究中达到10 μg/mL以上的AAP10作用24 h后开始体现出抗病毒活性,而20 μg/mL的AAP10作用24 h后就可明显增加细胞存活率及病毒抑制率。因此,AAP10有明确的抵抗CVB3对心肌细胞造成的损害过程,这对于AAP10的药理学及毒理学的研究具有参考价值,并对将来应用于临床上病毒性心肌炎的治疗提供理论基础。
[1]陈孝丽.病毒性心肌炎诊治新进展[J].中外健康文摘,2013,10(28):7-9.
[2]许茸茸,李应东,刘凯,等.当归红芪超滤膜提取物对阿霉素致心肌细胞凋亡的影响[J].中国实验方剂学杂志,2013,19(15):232-236.
[3]Zhang YY,Li JN,Xia HH,et al.Protective effects of losartan in mice with chronic viral myocarditis induced by coxsackievirus B3[J].Life Sci,2013,92(24/26):1186-1194.
[4]Kong Q,Wu W,Yang F,et al.Increased expressions of IL-22 and Th22 cells in the coxsackievirus B3-Induced mice acute viral myocarditis[J].Virol J,2012,9(10):232-235.
[5]Omura S,Kawai E,Sato F,et al.Bioinformatics multivariate analysis determined a set of phase-specific biomarker candidates in a novel mouse model for viral myocarditis[J].Circ Cardiovasc Genet,2014,7(4):444-454.
[6]Schumm J,Greulich S,Sechtem U,et al.T1 mapping as new diagnostic technique in a case of acute onset of biopsy-proven viral myocarditis[J].Clin Res Cardiol,2014,103(5):405-408.
[7]Sinnecker D,Laugwitz KL,Moretti A.Extending human induced pluripotent stem cell technology to infectious diseases:new model for viral myocarditis[J].Circ Res,2014,115(6):537-539.
[8]Hendry RG,Bilawchuk LM,Marchant DJ.Targeting matrix metalloproteinase activity and expression for the treatment of viral myocarditis[J].J Cardiovasc Transl Res,2014,7(2):212-215.
[9]Ye T,Yue Y,Fan X,et al.M cell-targeting strategy facilitates mucosal immune response and enhances protection against CVB3-induced viral myocarditis elicited by chitosan-DNA vaccine[J].Vaccine,2014,32(35):4457-4465.
[10]Ruan L,Quan X,Li L,et al.Increasing gap junction coupling suppresses ibutilide-induced torsades de pointes[J].Exp Ther Med,2014,7(5):1279-1284.
[11]Johnstone SR,Best AK,Wright CS,et al.Enhanced connexin 43 expression delays intra-mitotic duration and cell cycle traverse independently of gap junction channel function[J].J Cell Biochem,2010,110(3):772-782.
[12]Dhein S,Hagen A,Jozwiak J,et al.Improving cardiac gap junction communication as a new antiarrhythmic mechanism:the action of antiarrhythmic peptides[J].Naunyn Schmiedebergs Arch Pharmacol,2010,381(3):221-234.
[13]陈元元,范晓晨.自身免疫机制在病毒性心肌炎中的作用[J].安徽医学,2014,35(5):704-706.
The vitro study of anti-arrhythmic peptide against coxsackie B3 virus*
WUQiong,SHENGLei△,HONGLi-feng
(DepartmentofCardiology,theFifthHospitalofWuhanCity/DepartmentofCardiology,MercyHospitalofWuhanUniversity/InstituteofCardiovascularSciencesofJianghanUniversity,Wuhan430050,China)
Objective To observe the anti-arrhythmic peptide 10(AAP10) against coxsackie virus B3 (CVB3) damage to the generation of myocardial cells in mice.Methods BALB/C mice primary myocardial cells can be divided into 7 groups,each group of 12 holes:the cell control group,the virus control group,and drug intervention group(five different concentrations).Myocardial cells of 100 TCID50 CVB3 were interventied with different concentrations of AAP10.Cell damage degree among each group were contrasted.Results Myocardial activity has a positive correlation with the drug concentration (r=0.942,P=0.005,r2=0.888) and action time(r=0.993,P<0.05).Myocardial activity in intervention group is significantly higher than virus control group(F=7.489,P<0.05).Conclusion AAP10 has obvious antiviral activity in vitro,which has a correlation with drug and action time.AAP10 can protect myocardial cell infected by CVB3 in vitro.
anti-arrhythmic peptide; coxsackie virus B3; primary cardiac myocyte
湖北省武汉市汉阳区科学技术局计划项目[阳科(2011)11号]。
伍琼,女,主治医师,硕士,主要从事心脏病毒学及分子生物学方面的研究。△
,E-mail:309325285@qq.com。
10.3969/j.issn.1672-9455.2015.08.012
A
1672-9455(2015)08-1056-03
2014-11-15
2014-12-01)
