支原体培养基质控菌株菌种代次与生长曲线研究
2015-03-13朱真万建青杨挺英康凯
朱真,万建青,杨挺英,康凯
(中国兽医药品监察所,北京 100081)
支原体培养基质控菌株菌种代次与生长曲线研究
朱真,万建青*,杨挺英,康凯
(中国兽医药品监察所,北京 100081)
为探究支原体液体培养基和固体培养基质控菌猪鼻支原体生长规律,以活菌浓度,菌液pH值为指标,比较了不同代次与不同传代方式猪鼻支原体生长情况。结果显示:3%与10%浓度传代,0~48 h内,活菌浓度持续上升,菌液pH值持续下降,3%浓度传代的支原体生长较均匀,更利于菌种生长;1~5代支原体活菌浓度无显著差异;通过0.3 mL菌液加9.7 mL培养基传代,20组菌液平均浓度为(24.4±5.7)×108CFU/mL,通过0.9 mL菌液加29.1 mL培养基传代,菌液平均浓度为(7.2±2.1)×108CFU/mL,两种浓度差异极显著,前种传代方式更有利于支原体生长。本次试验为支原体液体和固体培养基的质控工作标准化提供参考。
猪鼻支原体;培养基质控;菌种代次;生长曲线
支原体污染是细胞培养过程中常见和棘手的污染源,培养法是支原体检验的常用方法[1-3]。国内已有通过生长滴度测定法,获得牛支原体OF2株、山羊支原体山羊肺炎亚种分离株M1601在不同培养基中生长曲线的报道[4-5],也有人通过活菌计数测定法获得人型支原体(Mh)生长曲线[6]。测定不同时刻牛支原体的OD值和pH,亦可绘制该株牛支原体的生长曲线,但只能是在一定程度上反映生长趋势,而无法进行计量描述,有一定局限性[7]。
猪鼻支原体(CVCC361)作为支原体液体培养基和支原体固体培养基的质控菌株[8],其生长曲线于2012年被国内学者绘制完成,但就培养基质控菌株的标准化工作而言,其传代次数、菌液接种适宜比例、生长滴度变化等还需进一步考证[9]。为弥补这一研究空缺,本试验就猪鼻支原体菌液活菌浓度与pH值变化关系以及适宜传代代次等进行了研究,旨在为支原体液体培养基和支原体固体培养基的质控工作的标准化提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 猪鼻支原体(CVCC361),由中国兽医药品监察所提供。
1.1.2 培养基 支原体液体培养基、支原体固体培养基,均由北京中海生物科技有限公司提供。
1.1.3 仪器 生物安全柜,NUAIR公司;CO2培养箱和37 ℃培养箱,SANYO公司;pH计,METTLER TOLEDO公司;涡旋震荡器,北京金紫光科技发展有限公司;冰箱,海尔公司。
1.2 方法
1.2.1 不同接种浓度和收获时间差异比较
1.2.1.1 菌液制备 将猪鼻支原体冻干菌株启开,用支原体液体培养基恢复原体积,再以10%比例接种至支原体液体培养基中,37 ℃培养24 h后,分别按3%(将0.9 mL菌液加至29.1 mL支原体液体培养基中)和10%(将3 mL菌液加至27 mL支原体液体培养基中)两种比例进行连续传代,选择3代菌作为工作菌液。
1.2.1.2 活菌计数及pH值测定 以传代后放入培养箱培养的时刻作为该代次菌株生命的零点,分别选择3%浓度接种菌液的0、16、24、40、48 h以及10%浓度接种菌液的0、6、24、30、48 h这几个时间点,吸取菌液0.2 mL至1.8 mL支原体液体培养基中,以这种方式,10倍系列稀释至10-6,选择该稀释度菌液,吸取0.1 mL滴至支原体固体培养基平皿表面,进行活菌计数,同时对相应时间点的菌液进行pH值测定,每种比例分别选取3个样本。
1.2.1.3 生长曲线的绘制 取各时间点的活菌计数结果的平均值,以时间为横轴,分别以活菌浓度和pH值变化值为纵轴,绘制3%和10%传代比例下的猪鼻支原体生长曲线和pH值变化曲线。
1.2.2 不同菌种代次差异比较
1.2.2.1 菌液制备 将猪鼻支原体冻干菌株启开,用支原体液体培养基恢复原体积,10%比例接种至支原体液体培养基中,37 ℃培养24 h后,再按3%比例,将0.3 mL菌液加至9.7 mL支原体液体培养基中,以这种方式,连续传至5代,分别选择1~5代菌作为工作菌液。
1.2.2.2 活菌计数分别选择1~5代菌菌液,各代次选取4个样本,用“1.2.1.2”中所提及的方法,进行活菌计数,并根据各处理重复数相等的方差分析方法[10],对各代次间活菌浓度进行差异分析。
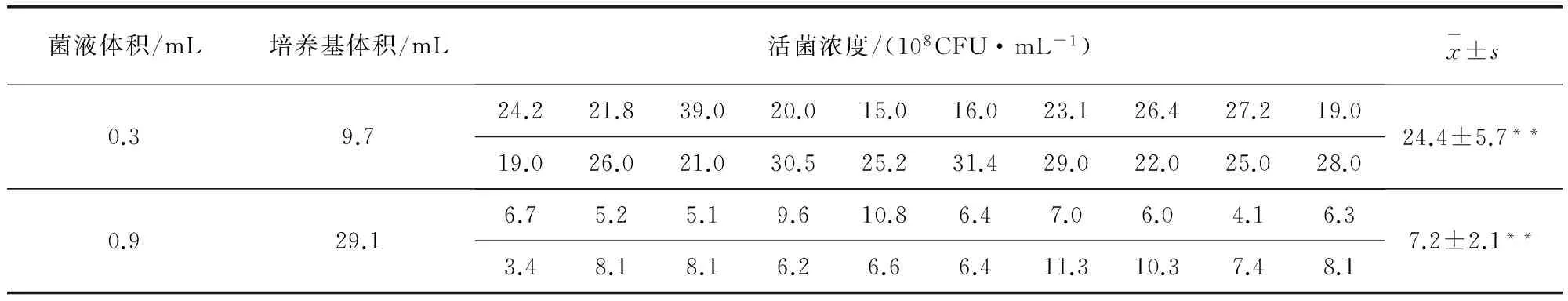
1.2.3 不同传代体积差异比较 将猪鼻支原体冻干菌株启开,用1 mL支原体液体培养基恢复原体积,10%比例接种至支原体液体培养基中,37 ℃培养24 h后,再按3%比例,分别选择两种不同培养体积传代,一种方式是将0.3 mL菌液加至9.7 mL支原体液体培养基中,另一种则是0.9 mL菌液加至29.1 mL培养基,37 ℃培养24 h后,再以各自的方式传至下一代,直至5代,随机选择两种方式传代的2~5代菌各20个样本,用“1.2.1.2”中所提及的方法进行活菌计数,并用t检验(双样本异方差检验)进行比较。
2 结果
2.1 不同接种浓度和收获时间差异比较
2.1.1 不同接种浓度 活菌浓度和pH值的比较两种浓度接种的猪鼻支原体各时间点的活菌浓度和pH值如表1和表2所示。从表1可以看出,3%浓度接种的猪鼻支原体0~48 h活菌浓度持续上升,到48 h达到峰值13.1×108CFU/mL,菌液pH值则持续下降,在40~48 h之间某时刻降至7.0以下。从表2可以看出,10%浓度接种的猪鼻支原体0~48 h活菌浓度持续上升,到48 h达到峰值14.0×108CFU/mL,菌液pH值则持续下降,在30~48 h之间某时刻降至7.0以下。

表1 3%浓度接种猪鼻支原体各时刻生长情况

表2 10%浓度接种猪鼻支原体各时刻生长情况
2.1.2 生长曲线 两种接种浓度猪鼻支原体生长曲线见图1和图2。从图1可以看出,以3%浓度接种,猪鼻支原体在0~48 h活菌浓度平稳上升,生长速率逐渐升高。以10%浓度接种,猪鼻支原体在0~48 h活菌浓度持续上升,0~6 h为迟缓期,6~48 h为对数期,其中24~30 h生长速率最快。从图2可以看出,0~48 h内,两种浓度接种菌液pH值变化范围和趋势大致相同,变化范围为6.63~7.55。3%浓度接种,0~16 h内,pH值下降平缓,16~48 h pH值下降速度较快。10%浓度接种,0~6 h内,pH值下降平缓,6~48 h pH值下降速度较快,且10%比3% pH值下降更快。
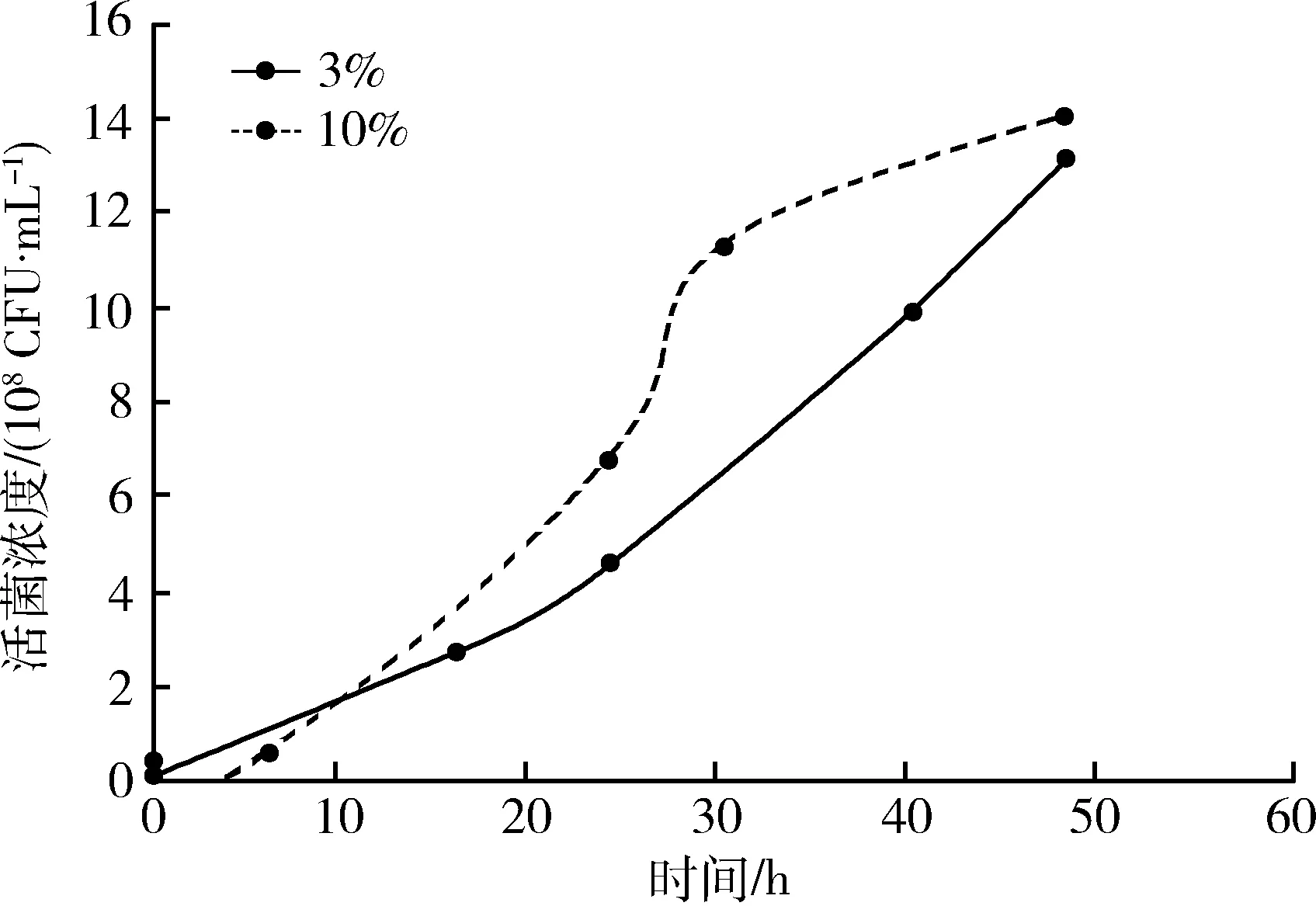
图1 不同接种比例猪鼻支原体生长曲线
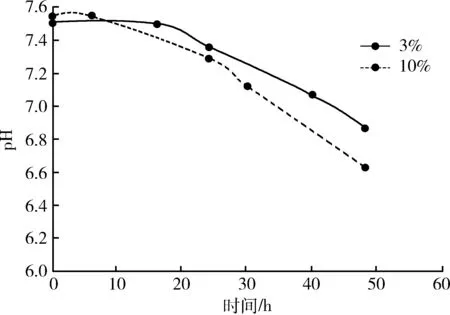
图2 不同接种比例猪鼻支原体pH值变化
2.2 1~5代菌活菌计数结果 活菌计数结果见表3。各代次间活菌浓度进行差异分析结果见表4,F=1.67 表3 1~5代菌活菌计数结果 表4 1~5代菌活菌计数方差分析表 2.3 不同传代体积差异比较 从表5可以看出两种传代体积猪鼻支原体不同生长情况,“0.3 mL菌液加入9.7 mL培养基”这种体积构成的传代方式下,20组菌液浓度平均值为24.4×108CFU/mL,标准差5.7;“0.9 mL菌液加入29.1 mL培养基”这种体积构成的传代方式下,20组菌液浓度平均值为7.2×108CFU/mL,标准差2.1;用双样本异方差假设下t检验对这两组实验数据进行分析,两种传代方式下活菌浓度之间差异极显著。 表5 不同传代体积猪鼻支原体活菌浓度 **表示差异极显著 本试验通过活菌计数和pH值测定,首次确定了猪鼻支原体适宜传代比例、收获时间、菌种代次以及传代体积。 3.1 传代比例 传代比例是微生物传代过程中一项重要的技术参数,刘轶秋等曾将3%作为支原体液体培养基质控菌猪鼻支原体的传代比例[9],而在日常检验中,常用的比例是10%,通过比较,10%接种传代的菌,前期生长较快,而3%接种传代的菌后期生长较快,两种浓度传代的菌浓度最后趋于统一。以3%比例传代,猪鼻支原体初始数量相对较少,培养基体积相对较多,单位数量猪鼻支原体获得的营养也更加丰富,更利于生长。另外,猪鼻支原体在培养基中代谢产生的酸性物质使pH值下降,而支原体这类微生物对生长环境的酸碱度有严格要求,pH值低于7的环境则会造成其生长抑制或死亡[2],有报道发现,在液体培养基中,pH改变和肺炎支原体生长有密切关联,pH接近6时达到最大菌浓度,pH降至5.2时肺炎支原体迅速死亡[11]。在3%比例传代下,菌液pH值下降相对较慢,以这种比例传代,对猪鼻支原体的生长亦是一种保护,通过上述分析,较之10%,3%更适于作为培养基日常检验中的传代比例。 3.2 菌种最佳收获时间 结合猪鼻支原体的生长曲线和pH值变化来看,猪鼻支原体传代后16~48 h内活菌浓度达(4.6~13.1)×108CFU/mL,在这个时间段内收获菌液均可,但考虑到猪鼻支原体对低pH值的敏感性,故应根据每次传代接种情况的不同,在保证菌种充分生长的前提下,在菌液明显变黄(pH<7)前收获。 3.3 菌种代次 按照《中国兽药典》二〇一〇年版规定支原体液体培养基质控菌猪鼻支原体传代不可超过5代[8],故本次实验只对照1~5代菌。通过比较各代次菌在相同温度下,培养相同时间后的活菌浓度,判断出各代次菌之间生长差异。通过统计学方法分析,1~5代菌活菌浓度之间无显著差异,在培养基检验工作中,为使培养基质控菌均一、稳定、活性强,可将1~5代菌作为质控菌工作菌液。 3.4 传代体积 猪鼻支原体兼性厌氧,且一般需要5%~10%CO2生长环境[2],在封闭的细胞培养瓶中,培养基和菌液混合体体积较小,氧气二氧化碳等气体体积相对较大,小体积培养相对于大体积培养,优势在于气体更多。从本次试验结果来看,同为3%传代比例下,“0.3 mL菌液+9.7 mL培养基”这种小体积的传代方式比“0.9 mL菌液+29.1 mL培养基”这种大体积的传代方式更利于猪鼻支原体生长,前者收获时菌液浓度约为后者菌液浓度3倍,差异极显著,说明在相对封闭的空间中,小体积培养模式更利于猪鼻支原体生长。通过上述分析可知,较之于“0.9 mL 菌液+29.1 mL 培养基”,将0.3 mL菌液加入9.7 mL培养基这种传代方式更利于猪鼻支原体生长。 [1] 陆承平.兽医微生物学[M].北京: 中国农业出版社, 2007. [2] 吴移谋, 叶元康.支原体学[M].北京: 人民卫生出版社, 2008. [3] The United States Phamacopeial Convention,Inc.USP36NF31,General Chapter 63,Mycoplasma Tests[S].Rockville,MD,Volume 1,2013:67-71. [4] 邵倩, 储岳峰, 何生虎, 等.牛支原体生长曲线的测定和培养基筛选[J].湖北农业科学,2012,51(3):549-551. [5] 高珊, 逯忠新, 许立华.山羊支原体肺炎亚种培养基的筛选及生长曲线测定[J].动物医学进展,2012,33(2): 17-20. [6] 贾亚利, 潘展砚, 叶元康, 等.人型支原体的分离培养和生长特性的研究[J].检验医学,2007,22(2):142-145. [7] 范媛. 牛支原体生长特性及其致病性研究[D]. 重庆: 西南大学, 2011. [8] 中国兽药典委员会.中国人民共和国兽药典二〇一〇年版三部[S]. [9] 刘轶秋, 丁家波, 李蓓蓓, 等. 支原体检验用培养基质控菌株的生长曲线与世代时间测定[J]. 中国兽药杂志, 2012, 46(12):13-15,18. [10]谢庄, 贾青.兽医统计学[M].北京: 高等教育出版社, 2005. [11]赵飞, 李晶, 陶晓霞, 等. 肺炎支原体液体培养中pH与活菌浓度的关系研究[J]. 中国病院生物学杂志, 2010, 5(11): 848-849. (编 辑:李文平) Study on the Generation and Growth Curve ofMycoplasmaCulture Medium Quality Control Strains ZHU Zhen,WAN Jian-qing*,YANG Ting-ying,KANG Kai (ChinaInstituteofVeterinaryDrugControl,Beijing100081,China) To research the growth characteristic ofMycoplasmahyorhinis,theMycoplasmaliquid and solid medium quality control strain, its growth conditions were compared under different generations and inoculation proportion with the index of pH and living cell concentration in the study. The results are followed: comparing passage concentration 3% and 10%,Mycoplasmastrains grew increasing and pH value continued to decline under two different concentration,but passage concentration 3% was more conducive toMycoplasmahyorhinisgrowth steady. There was no significant difference in the living strains concentration between 1~5 generations ofMycoplasma. By mixing 0.3 mL bacteria suspension and 9.7 mL medium, average bacteria concentration of 20 groups was (24.4±5.7)×108CFU/mL, by mixing 0.9 mL bacteria suspension and 29.1 mL medium, while the average value was (7.2±2.1)×108CFU/mL, two kinds of concentrations had a very significant difference and the former was more conductive to theMycoplasmagrowth. The text provided theory basis for the medium standardization work. Mycoplasmahyorhinis;medium quality control;strains generation;growth curve 朱真,从事原材料质控的检测工作。 万建青。 E-mail: wanjianqing@ivdc.org.cn 2015-03-29 A 1002-1280 (2015) 08-0010-05 R375

3 讨论与小结
