衔接蛋白AP-2在不同发育时期小鼠耳蜗毛细胞中的表达*
2015-03-12顾翔陈知己蔡婷宋锐周小清袁伟
顾翔陈知己蔡婷宋锐周小清袁伟
1第三军医大学西南医院耳鼻咽喉头颈外科(重庆 400038)
衔接蛋白AP-2在不同发育时期小鼠耳蜗毛细胞中的表达*
顾翔1陈知己1蔡婷1宋锐1周小清1袁伟1
1第三军医大学西南医院耳鼻咽喉头颈外科(重庆400038)
【摘要】目的通过检测不同发育阶段小鼠耳蜗毛细胞衔接蛋白AP-2蛋白的表达,初步探讨其在听觉发生、形成中的作用。方法选用出生后7日(P7)、15日(P15)、35日(P35)及16月龄小鼠各20只,分别代表新生小鼠、听觉发育阶段小鼠、听觉发育成熟小鼠及老年小鼠,对其进行ABR检测,用免疫荧光标记技术结合激光共聚焦显微镜观察各发育阶段小鼠耳蜗AP-2蛋白的定位与表达,用qRT-PCR技术检测小鼠耳蜗AP-2基因mRNA的表达。结果P15、P35及16月龄小鼠ABR反应阈分别为18.67±1.21、13.83±1.47、37.83±7.68 dB nHL,P7组小鼠未引出反应波形。在小鼠内耳发育不同阶段均有不同程度的AP-2蛋白表达,主要定位于耳蜗内毛细胞胞浆,集中表达于内毛细胞基底部与带状突触靠近传入神经元区域,P7、P15、P35及16月龄组小鼠耳蜗AP-2蛋白荧光染色密度值分别为190.91±17.27、494.06±27.63、838.41±38.23和682.65±72.22; AP-2 mRNA相对表达量分别为0.53±0.09、1.03±0.02、1.00±0.09和1.03±0.06;与新生小鼠相比较,随小鼠听觉的产生和形成,耳蜗AP-2蛋白表达水平逐渐升高(P<0.01 ),免疫荧光染色提示老年性聋小鼠AP-2蛋白在内毛细胞的表达量较P35小鼠减少(P<0.05),但qRT-PCR分析AP-2基因mRNA的表达水平与成熟小鼠(P15)差异无统计学意义(P>0.05)。结论在小鼠听觉发育成熟阶段,随小鼠日龄增加耳蜗AP-2蛋白表达逐渐增强,提示AP-2蛋白的表达水平可能与听觉的发生、形成和维持密切相关。
【关键词】衔接蛋白;内毛细胞;年龄相关性听力损失;小鼠
*国家自然科学基金(81470694,30973301,81271080)、重庆市自然基金(CSTC2009BB5170)联合资助
耳蜗内毛细胞带状突触是进行声音编码的解剖和功能的基本结构,听觉的产生与维持依赖于此内毛细胞突触活性区域(active zones,AZs)释放神经递质,由此完成机械-电换能作用[1]。突触囊泡与突触前膜融合释放神经递质进行听信号的传递,但是如果没有有效的胞吞作用,细胞膜就会因为囊泡的胞吐而不断扩大,从而影响正常的突触循环。因此,突触囊泡膜的回收利用对囊泡池的补充和神经递质的释放具有重要意义[2,3]。目前研究认为,网格蛋白介导的内吞(clathrin mediated endocytosis,CME)是耳蜗内毛细胞突触活性区域递质释放后囊泡回收的重要途径[4,5],而衔接蛋白AP-2(adaptin-2,AP -2)通过绑定不同蛋白分子从结构和动力的层面参与了此囊泡回收过程[6,7],AP-2对网格蛋白介导的突触囊泡胞吞过程具有重要意义。
出生后第10~14天是小鼠听觉开始出现的时期[8,9],听觉的产生与耳蜗内毛细胞神经递质的释放和突触囊泡的有效循环密切相关,听觉形成前后是否伴随着内毛细胞突触囊泡内吞功能的变化,小鼠听觉的发生和形成与调控内吞的关键分子AP-2蛋白之间是否存在关联尚不清楚,研究AP-2蛋白在不同发育阶段耳蜗毛细胞的动态变化对于研究内毛细胞内吞的相关功能具有重要意义。前期研究显示AP-2蛋白与内毛细胞突触结构密切相关,AP-2蛋白主要定位于耳蜗内毛细胞胞浆,集中表达于内毛细胞基底部与带状突触靠近传入神经元区域[10]。本研究拟通过观察出生后不同发育阶段(postnataldevelopment) (P7、P15、P35)以及老年小鼠(16月龄)听功能及衔接蛋白AP-2的定位与表达特点,探讨AP-2蛋白与听觉发生发育和老年性听力减退的相关性。
1 材料与方法
1.1实验动物及分组随机选取7日龄(P7)、15日龄(P15)、35日龄(P35)及16月龄昆明小鼠各20 只(40耳),为排除雌激素对听力的影响,均选用雄性小鼠;耳廓反射灵敏,无噪声暴露及用药史。各组10只动物用于免疫荧光染色,10只用于qRTPCR。
1.2实验方法
1.2.1 ABR检测所有测试均在第三军医大学西南医院听力检测隔声屏蔽室内进行。采用Nicolet compass测试系统,5%水合氯醛(0.7 ml/100 g)腹腔注射麻醉后,将小鼠固定于ABR测试盒内,将针形记录电极置于颅顶,参考电极置于双侧耳廓,地极置于鼻尖,电极阻抗及极间电阻均小于≤5 kΩ。双耳交替给声。刺激声为短声(click),刺激速率为23.1次/秒,带通滤波100~3 000 Hz,分析时间10 ms,叠加1 024次。刺激声强度从90 dB nHL开始,先以10 dB递减,然后以5 dB递减,以能分辨出波Ⅱ的最低刺激强度为阈值,并重复2次。
1.2.2小鼠耳蜗固定分离检测ABR阈值后断颈处死小鼠,取出颞骨,去除脑组织,将两侧听泡置于盛有4%多聚甲醛的玻璃皿中;迅速分离耳蜗,以显微镊刺破卵圆窗,开放圆窗,于蜗顶处钻一小孔,以1 ml注射器于蜗顶小孔缓慢注入4%多聚甲醛,反复3次,将灌流固定好的耳蜗置于盛有4%多聚甲醛中4℃过夜。取出固定后的耳蜗置于盛有PBS缓冲液的玻璃皿中,逐步去除蜗壳,撕去前庭膜、盖膜及血管纹,充分游离基底膜,选取耳蜗基底膜中回进行免疫荧光染色。
1.2.3免疫荧光染色方法将耳蜗基底膜置于0.5% Triton X-100中打孔20分钟,PBS溶液漂洗(3次,每次5分钟),在1: 200驴血清室温下封闭2小时,然后加入一抗anti-Adaptin α(1: 50,PBS溶液稀释)置于4℃冰箱过夜。第二天取出标本,PBS溶液漂洗(3次,每次5分钟),加入二抗驴抗鼠IgG (1: 500,PBS溶液稀释),室温下(25℃)避光染色45分钟,再以PBS溶液漂洗(3次,每次5分钟),加Dapi反应10分钟后PBS溶液漂洗(3次,每次5分钟)。采用铺片方式,将耳蜗中回基底膜平铺于载玻片上,滴加两滴抗荧光淬灭封片剂,盖上盖玻片,将玻片置于激光共聚焦显微镜下观察。
1.2.4激光共聚焦显微镜观察激光共聚焦显微镜下观察及拍照,激发光波长FITC 488 nm,Alex 594 nm,检测器红光增益均为655,对所观察区域的内毛细胞从上而下进行扫描,分别对标本的各层图像进行连续观察。扫描层设定为1 μm,观察各阶段小鼠AP-2蛋白的表达。
1.2.5 AP-2蛋白免疫荧光强度软件分析采用ZEN lite 2012软件(ZEISS)检测AP-2蛋白免疫荧光Intensity Mean Value(IMV)。软件随机截取并检测所选细胞荧光区域等面积IMV,得到四组共40个数据进行统计分析(t检验)。
1.2.6实时荧光定量PCR(qRT-PCR)分离小鼠耳蜗去除血液及多余骨质置于液氮中冷却,并于RNAiso Plus液中迅速研磨粉碎,Trizol法提取各组总RNA,分光光度仪检测标本RNA浓度及纯度。采用前述逆转录试剂盒说明书将总RNA逆转录为cDNA置于-20℃保存。逆转录引物由上海生工软件设计并制作。上下游引物分别为AP2a2: CAATCCACAGCAAGAAGTGC (前),AP2a2: GCAACAAGCAGCCAATCTG(后),应用SYBR Premix Ex TaqⅡ(TliRNase H Plus)于荧光定量PCR仪行qRTPCR,以β-actin为内参基因,95℃预变性10 min,开始循环: 95℃15 s,60℃30 s,72℃50 s,72℃5 s扩增40个循环后,分析重复实验数据,分别得出mRNA的CT值。分析相关参数后,表达水平的比较参考Livak方法[11]计算相对表达量(relative quantity,RQ)值,RQ=2^-ΔΔCt,以P35 mRNA表达水平作为对照组,比较不同组标本与对照组RQ值差异。
1.3统计学方法采用SPSS18.0软件对数据进行t检验和单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1不同发育时期小鼠ABR检测结果P15、P35、16月龄小鼠ABR反应阈分别为18.67±1.21、13.83±1.47和37.83±7.68 dB nHL,P7组小鼠未引出反应波形。16月龄组ABR反应阈明显高于P15组和P35组小鼠(P<0.05) (表1)。
2.2不同发育阶段小鼠耳蜗内毛细胞AP-2蛋白的表达与蛋白免疫荧光强度分析结果免疫荧光染色激光共聚焦发现,AP-2蛋白在小鼠内耳不同发育阶段均有不同程度的表达,主要定位于耳蜗内毛细胞胞浆,集中表达于内毛细胞突触活化区域(图1),其中P7组AP-2蛋白荧光强度较弱,但内毛细胞胞质中亦可见均一分布的红色荧光染色(图1a) ; P7、P15、P35及16月龄组小鼠内毛细胞荧光染色光密度值分别为190.91±17.27、494.06±27.63、838.41±38.23和682.65±72.22,可见,随小鼠听觉的产生和逐渐形成,P7、P15和P35组耳蜗内毛细胞AP-2蛋白表达水平逐渐升高,差异有统计学意义(P<0.01),16月龄组AP-2蛋白表达量较P35组减弱,差异有统计学意义(P<0.01) (表1)。
2.3各组小鼠AP-2蛋白表达量比较变化P7、P15、P35及16月龄组mRNA相对表达量分别为0.53±0.09、1.03±0.02、1.00±0.09和1.03±0.06。各组相对于P35组AP-2蛋白mRNA的相对表达量RQ值的变化见表1,可见,P7组AP-2蛋白mRNA相对表达量RQ值低于P15组,差异有统计学意义(P<0.05),而P15组、16月龄组AP-2蛋白mRNA相对表达量RQ值与对照组比较,差异无统计学意义(P>0.05) (表1)。
表1 各组小鼠ABR反应阈、AP-2蛋白免疫荧光光密度值及AP-2mRNA相对表达量(珋±s)

表1 各组小鼠ABR反应阈、AP-2蛋白免疫荧光光密度值及AP-2mRNA相对表达量(珋±s)
注: IMV选取的单个测量面积为9 μm2; RQ值=2^-ΔΔCt,*与对照组比较,P<0.05
组别 ABR反应阈(dB nHL)免疫荧光光密度值IMV AP-2mRNA相对表达量RQ值P7组- 190.91±17.27 0.53±0.09*P15组 18.67±1.21 494.06±27.63 1.03±0.02 P35组 13.83±1.47 838.41±38.23 1.00±0.09 16月龄组37.83±7.68 682.65±72.22 1.03±0.06
3 讨论
参与和调控CME过程的AP-2蛋白是一个异源四聚体,由α、β2、μ2和σ2亚基组成,AP-2蛋白是内吞所形成的网格蛋白包被小泡的结构核心,在受体介导的内吞和突触囊泡的回收利用中发挥着重要作用[6,7,12]。因为AP-2的α亚基是蛋白的重要组成部分,α亚基附件区域通过DPF/W信号与多种调控蛋白和辅助蛋白(如Amphiphysins、Espsin、Eps15、Auxilin、AP180等)结合,共同参与网格蛋白包被小泡的形成;当α亚基附件区域表达异常时,能阻止辅助蛋白的绑定,从而影响内吞过程。故本研究用AP-2蛋白2亚基mRNA进行AP-2表达的PCR研究。
研究发现正常生理刺激条件下网格蛋白介导的内吞(CME)途径是小鼠内毛细胞突触囊泡回收的主要方式[5]。目前关于参与调控CME途径的AP-2蛋白在内耳的knockdown或knockout模型尚未见报道,本课题组前期通过免疫荧光激光共聚焦显微镜定位AP-2蛋白的形态学表达,发现听功能正常成年小鼠AP-2蛋白定位于耳蜗内毛细胞胞浆内,主要表达于内毛细胞基底部与带状突触靠近传入神经元区域[10],而此区域正是听觉神经通路第一级突触,快速、不间断地释放囊泡为该突触区别于其他突触的显著特征。本研究发现,AP-2蛋白持续表达于新生至老年各阶段小鼠内毛细胞,证明AP-2蛋白在听觉的发育和维持方面起着重要作用。
从文中结果可见,新生小鼠(P7)、发育阶段小鼠(P15)和听觉成熟小鼠(P35)的耳蜗形态结构与内外毛细胞均排列整齐,无明显缺失,但听功能却存在差异,P7组小鼠未引出ABR波形,P15组小鼠ABR反应阈为18.67±1.21 dB nHL,P35为13.83 ±1.47 dB nHL。这可能与传递神经递质的第一级神经元即耳蜗内毛细胞突触仍在继续发育并进行精确的连接有关。听觉形成的前、后两个阶段,即P7组与P15组比较,随小鼠听觉的产生和形成,后者的AP-2蛋白免疫荧光染色IMV值和AP-2mRNA相对表达量RQ值均明显升高(P<0.05),而P7小鼠的ABR反应阈尚不能引出,可能是因为发育不成熟的耳蜗内毛细胞突触释放的谷氨酸神经递质不能有效的被突触前膜内吞回收,从而影响了突触囊泡循环,神经递质不能持续传递。随着小鼠内耳的发育,内毛细胞突触部位囊泡的内吞回收功能逐渐完善,网格蛋白介导的谷氨酸受体内吞途径保证了囊泡从突触前膜回收至胞内,参与新一轮囊泡的形成和再生,从而建立完整的突触囊泡循环,使得谷氨酸神经递质在听觉传导通路能正常传递,故P15小鼠听觉已渐趋成熟。
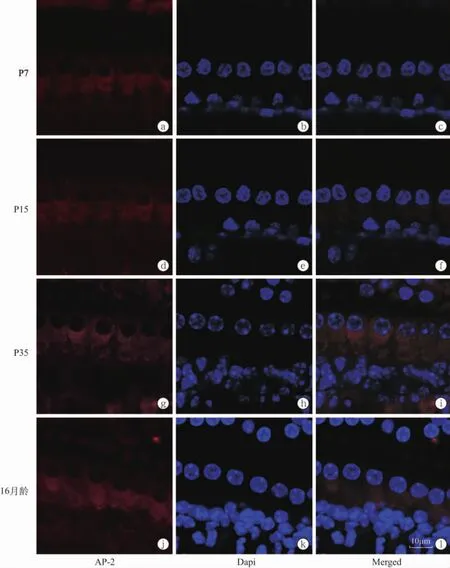
图1 各组小鼠耳蜗内毛细胞AP-2蛋白的表达
老年性聋是指随着年龄增加逐渐出现的听力下降,是多机制多途径共同作用所致,与脂质过氧化损伤、听觉中枢退化等有关[13]。本研究结果显示,16月龄小鼠ABR反应阈明显高于P35组小鼠,16月龄组小鼠AP-2蛋白表达量较P35组小鼠减少(P<0.05),然而,两组间AP-2 mRNA的表达水平没有明显差异(P>0.05),说明在老年性聋小鼠耳蜗毛细胞内具有调控网格蛋白介导突触囊泡胞吞作用的功能性AP-2蛋白不足,从而影响了囊泡的内吞回收,造成了谷氨酸在内毛细胞传入神经突触部位聚集,产生神经兴奋性毒性,最终造成听觉损伤。推测虽然老年性聋小鼠AP-2蛋白的数量减少可能不明显,但是失去了部分功能,相关机制有待通过膜片钳电生理手段进行更全面的揭示。AP-2蛋白在年龄相关性听力损失中可能起着更多作用,需要进一步的研究。
目前对于AP-2蛋白在内毛细胞突触区域调控网格蛋白介导突触囊泡内吞功能方面的机制尚不清楚,后续研究可以运用膜片钳技术,检测蛋白抑制剂作用后毛细胞膜电容的改变及其与听功能改变的相关性,也可以运用RNA干扰技术使耳蜗内AP-2 mRNA发生降解而导致基因表达沉默,再检测听功能有无改变。本实验通过对不同生长发育阶段小鼠耳蜗内毛细胞AP-2蛋白表达的研究,初步发现AP-2蛋白的表达水平可能与听觉的发生、形成和维持密切相关。随着对AP-2蛋白的研究深入,将更有助于深入了解听觉信号传导通路,从而更深入探讨感音神经性聋的发病机制。
4参考文献
1 Pangršiĉ T,Reisinger E,Moser T.Otoferlin: a multi-C2 domain protein essential for hearing[J].Trends Neurosci,2012,35: 671.
2 Scita G,Di Fiore PP.The endocytic matrix[J].Nature,2010,463: 464.
3 Royle SJ,Lagnado L.Endocytosis at the synaptic terminal[J].J Physiol,2003,553: 345.
4 Neef J,Jung S,Wong AB,et al.Modes and regulation of endocytic membrane retrieval in mouse auditory hair cells[J].J Neurosci,2014,34,705.
5 Duncker SV,FranzC,Kuhn S,et al.Otoferlin couples to clathrinmediated endocytosis in mature cochlear inner hair cells[J].J Neurosci,2013,33: 9508.
6 McMahon HT,Boucrot E.Molecular mechanism and physiological functions of clathrin-mediated endocytosis[J].Nat Rev Mol Cell Biol,2011,12: 517.
7Jung N,Haucke V.Clathrin-mediated endocytosis at synapses [J].Traffic,2007,8: 1129.
8赵玉林,董明敏,董民声.小鼠听力发育学的研究[J].听力学及言语疾病杂志,1998,6,143.
9 Roux I,Safieddine S,Nouvian R.Otoferlin,defective in a human deafness form,is essential for exocytosis at the auditory ribbon synapse[J].Cell,2006,127: 277.
10顾翔,袁伟.衔接蛋白AP-2在小鼠耳蜗中的表达及意义[J].临床耳鼻咽喉头颈外科杂志,2015,29: 83.
11Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta DeltaC (T) ) method[J].Methods,2001,25: 402.
12Traub LM.Tickets to ride: selecting cargo for clathrin-regulated internalization[J].J Cell Sci,2009,102: 543.
13 Gates GA,Mills JH.Presbycusis[J].Lancet,2005,366: 1111.
(2015-02-25收稿)
(本文编辑雷培香)
·实验研究·
Expression of Adaptin-2 in Different Stages of Mouse Cochlea
Gu Xiang,Chen Zhiji,Cai Ting,Song Rui,Zhou Xiaoqing,Yuan Wei
(Department of Otolaryngology Head and Neck Surgery,Southwest Hospital,the Third Military Medical University,Chongqing,400038,China)
【Abstract】ObjectiveTo investigate the expression of adaptin-2(AP-2) in different stages of mouse cochlea and its probable role in the auditory generation and formation.Methods Mice were divided into 4 experimental groups by age (7 days old,15 days old,35 days old,16 months old),which respectively represented the newborn mice,developmental mice,mature mice and old mice.Auditory brainstem response (ABR),laser scanning confocal microscopy (LSCM),immune-fluroscence histochemistry and qRT-PCR were used in this study.Results For the 15 days old,35 days old,16 months old groups,ABR average threshold was 18.67±1.21 dB nHL,13.83±1.47 dB nHL,37.83±7.68 dB nHL,respectively,for the 7 days old groups no responses were observed.The AP-2 immunoreactivity was found in all the stages of mice cochlea inner hair cell (IHC) cytoplasm,especially in IHC basal part,nearby the ribbon synapse.For the 7 days old,15 days old,35 days old,16 months old groups,immune-fluroscence histochemistry IMV(intensity mean value) were 190.91±17.27,494.06±27.63,838.41±38.23,682.65±72.22,respectively.For the 7 days old,15 days old,35 days old,16 months old groups,mRNA RQ(relative quantity)book=608,ebook=45were 0.53±0.09,1.03±0.02,1.00±0.09,1.03±0.06,respectively.Developmental mice expressed significantly higher than those of the newborn in the AP-2 protein expression level which was measured by immuno-fluorescence histochemistry and qRT PCR(P<0.01).There was no significant difference between old and mature mice in the AP-2 protein expression level measured by qRT PCR (P>0.05),but mature mice had significant advantages by immuno-fluorescence histochemistry.Conclusion AP-2 protein expression level may closely related to the auditory formation and maintenance because its expression gradually increases with age in mice.
【Key words】Adaptin; Inner hair cell; Age-related hearing loss; Mice
通讯作者:袁伟(Email: weiyuan175@ sina.com)
作者简介:顾翔,男,湖北人,硕士研究生,主要研究方向为耳科学。
【中图分类号】R764.45+6
【文献标识码】A
【文章编号】1006-7299(2015) 06-0607-05
DOI:10.3969/j.issn.1006-7299.2015.06.010
网络出版时间:2015-9-10 16: 47
网络出版地址: http://www.cnki.net/kcms/detail/42.1391.R.20150910.1647.034.html
