腺病毒介导的白细胞介素-10治疗自身免疫性内耳病的实验研究△
2015-03-12蔡文君谭长强
蔡文君谭长强
1东南大学附属中大医院耳鼻咽喉头颈外科(南京 210000) ; 2南京市鼓楼医院耳鼻咽喉头颈外科
腺病毒介导的白细胞介素-10治疗自身免疫性内耳病的实验研究△
蔡文君1谭长强2
1东南大学附属中大医院耳鼻咽喉头颈外科(南京210000) ; 2南京市鼓楼医院耳鼻咽喉头颈外科
【摘要】目的研究以重组复制缺陷型腺病毒为载体的白细胞介素-10(IL-10)对豚鼠自身免疫性内耳病的治疗作用。方法采用同种内耳组织抗原加弗氏佐剂免疫豚鼠,制作自身免疫性内耳病动物模型20只,随机分为3组,采用圆窗膜微量注射的方式,A组(10只)注入携带IL-10因子的重组腺病毒(Ad-IL-10),B组(5只)注入等量的携带黄色荧光蛋白标记的腺病毒(Ad-EYFP),C组(5只)注入等量人工外淋巴液(对照组),7天后行ABR测试,然后取豚鼠耳蜗制做石蜡切片,行HE染色和光镜观察,并行免疫荧光和酶免疫组织化学试验,检测豚鼠内耳基因产物IL-10表达。结果免疫组化显示携带IL-10的腺病毒可以转染耳蜗血管纹、螺旋韧带、Corti器、螺旋神经节、蜗轴小血管周围及其耳蜗的骨壁等部位的细胞,并产生相应的蛋白产物(IL-10)。造模后各组豚鼠ABR反应阈较造模前升高,差异有统计学意义(P<0.05),内耳注射后A组ABR反应阈明显低于B组和C组。光镜检查示A组内耳组织的免疫炎性反应亦明显较B组和C组轻。结论腺病毒可以携带IL-10因子转导入豚鼠内耳,并在内耳表达基因产物,可在一定程度上减轻内耳组织免疫炎性损伤和听损伤。
【关键词】白细胞介素-10;自身免疫性内耳病;腺病毒
△国家自然科学基金项目(30471876)资助
自身免疫性内耳病(autoimmune inner ear disease,AIED)是一独立的疾病,临床表现为快速进行性双侧感音神经性听力损失,对糖皮质激素治疗有效[1],其发病机制仍不清楚,临床缺乏特异敏感的诊断方法。然而,应用激素治疗该病亦存在一些问题,如:药物副作用多,部分患者不能耐受,停药后复发率较高等。基因治疗为解决这一难题带来了希望,且内耳独特的解剖结构也非常适合基因治疗。1996年Raphael已成功应用复制缺陷型腺病毒将目的基因转染入豚鼠的内耳细胞[2]。此后国内外学者在载体构建、治疗因子选择、给药途径等方面做了大量研究,结果显示腺病毒可作为载体携带治疗因子导入动物耳内,在动物内耳获得高效表达,产生具有生物活性的基因产物[3~5]。
白细胞介素-10(IL-10)是一种具有多向调节功能的细胞因子,在对自身反应性T细胞的稳恒调节中起着重要作用,与多种免疫疾病的发生有关。实验表明IL-10等免疫调节分子在自身免疫性疾病的预防和类风湿性关节炎、多发性硬化、自身免疫性甲状腺炎及自身免疫性眼葡萄膜炎等动物模型的基因治疗中取得了良好的效果[6,7]。Zhou等[8]研究发现补充外源性IL-10可以提高实验性自身免疫性耳聋动物的听力水平,从而表明IL-10可通过抑制Th1型细胞的促炎症反应调节自身免疫反应的严重程度。本实验在既往的研究基础上,通过圆窗膜注射途径对豚鼠自身免疫性内耳病动物模型应用腺病毒介导的IL-10进行调节基因的试验性治疗,以探索其治疗效果,报告如下。
1 材料与方法
1.1实验动物健康成熟白色红目豚鼠55只,雌性,体重300克左右,耳廓反应正常,耳镜检查排除中耳疾病。
1.2内耳组织粗制抗原制备(crude inner ear antigens,CIEAgs)选取30只豚鼠制备CIEAgs,制备方法的主要步骤[9]:将豚鼠清醒断头,取出颞骨,快速打开听泡,在解剖显微镜下分离膜迷路,包括基底膜、螺旋韧带、膜半规管、椭圆囊和球囊(祛除耳石器),放入0.01 mol/L(pH 7.4)的PBS中,经研磨、冻溶、超声粉碎、匀浆、离心(1 000 r/min,5 min)后取上清液,采用紫外分光光度计测定蛋白含量,分装后低温干燥制成CIEAgs干粉,保存于-80℃冰箱备用。
1.3豚鼠自身免疫性内耳病动物模型制备选取25只豚鼠造模,首次免疫每只动物采用CIEAgs 400 mg/0.4 ml,加等量完全弗氏佐剂,注射于右后足垫; 2周后以CIEAgs 200 mg/0.4 ml加等量不完全弗氏佐剂,注射于背部多点皮下;间隔2周后,再同样强化免疫一次。依据听性脑干反应(ABR)波Ⅲ的阈值升高(超过免疫前全部动物均值加2倍标准差)和出现针对CIEAgs特异性抗体(ELISA法,波长490 nm A值超过免疫前全部动物均值加2倍标准差),判断为自身免疫性内耳病(autoimmune inner ear disease,AIED)模型动物[10]。剔除动物因免疫反应死亡等因素后,最终成功构建AIED模型豚鼠20只。
1.4重组腺病毒构建重组复制缺陷型腺病毒(Ad5型)购自上海医元公司,病毒滴度Ad-IL-10(病毒滴度为1.0×10E9pfu/ml),携带黄色荧光蛋白的腺病毒(Ad-EYFP) (病毒滴度为1.0×10E9 pfu/ml),无菌条件下分装后保存于-80℃。
1.5AIED豚鼠模型分组及各组内耳注射方法20 只AIED模型豚鼠随机分成三组,采用圆窗膜注射方法,A组(10只)注入携带IL-10因子的重组腺病毒(Ad-IL-10),B组(5只)注入携带黄色荧光蛋白标记的腺病毒(Ad-EYFP),C组(对照组,5 只)注入等量人工外淋巴液。
圆窗膜注射方法:于末次免疫后2周进行。豚鼠用1%的戊巴比妥钠腹腔注射麻醉(30 mg/kg)后,在耳廓后方作一长约3~4 cm弧形切口,显露听泡,用微型电钻打开听泡,暴露耳蜗底回,用微推进器将小儿头皮针的针尖(针尖斜面已打磨变小)刺入圆窗膜进入鼓阶,用微量注射机缓慢(1 μl/min)注入,A组给予Ad-IL-10(病毒滴度为1.0×10E9 pfu/ml) 20 μl,B组给予Ad-EYFP(病毒滴度为1.0 ×10E9 pfu/ml ) 20 μl,C组给予等量的人工外淋巴液,明胶海绵封闭圆窗膜,骨腊封闭听泡孔,逐层缝合伤口。所有操作严格遵守无菌原则。
1.6观察指标
1.6.1特异性免疫反应测试分别于免疫前和末次免疫后2周采用酶联免疫吸附试验(ELISA)测定CIEAgs特异性抗体,采集并分离动物血清,用100 μg/ml的CIEAgs溶液包被ELISA板,于4℃过夜并封闭,加入1: 10稀释的豚鼠血清37℃孵育2 h,洗板4次,加入1: 2 000稀释的SPA-HRP(辣根过氧化物酶标记的葡萄球菌蛋白A Staphylococcal protein A-HRP,SPA-HRP) 37℃孵育1 h,洗板4次,以邻苯二胺-过氧化氢溶液为底物显色10分钟后用H2SO4终止显色,在酶标仪下测定波长为490 nm的吸光度A值。
1.6.2 ABR测试各组分别于免疫前、末次免疫后2周和圆窗膜注射1周后进行ABR测试。采用听觉诱发电位测试系统(美国TDT公司制造),豚鼠头顶冠状缝与矢状缝交界处插入针形电极作为测试电极,参考电极置于耳廓后方靠近乳突尖,接地电极置于对测乳突,刺激声信号采用click声,重复频率为11次/分,叠加2 048次,记录时程10 ms,记录波Ⅲ的阈值、潜伏期和波幅。治疗后ABR反应阈降低2倍标准差作为判断治疗后听觉功能改善标准。
1.6.3内耳光镜观察于圆窗膜注射1周ABR测试后进行。每组各取2只豚鼠,麻醉后断头,立即取出颞骨,打开听泡,放置4%多聚甲醛固定液中,12小时后换EDTA脱钙7~10天,修剪后流水冲洗1~2小时,常规脱水、透明、浸蜡、定向包埋。耳蜗中轴切片,片厚5 μm,漂片、捞片、粘片,常规HE染色,封片,光镜观察。
1.6.4免疫组织化学试验
1.6.4.1免疫荧光化学试验B组豚鼠于圆窗膜注射1周ABR测试后处死,方法同上,取2只动物的颞骨蜡块行耳蜗中轴切片,片厚5 μm,漂片、捞片、粘片后常规脱蜡至水,在倒置荧光显微镜下观察和摄片,观察Ad-EYFP在内耳的表达情况,黄色荧光为阳性表达。
1.6.4.2酶免疫组织化学试验三组豚鼠于圆窗膜注射1周ABR测试后处死(其中A组8只,B组1只,C组3只),按上述方法获得耳蜗切片,用胰酶(0.2%)修复抗原,其余具体步骤:正常山羊血清封闭10 min,加PBS稀释的第一抗体(各组均加入兔抗鼠IL-10) 4℃过夜,PBS洗5 min,3次,加入HRP标记的SPA(葡萄球菌A蛋白)作为二抗,37℃孵育30 min,PBS洗5 min,3次,DAB染色,封片剂封片,光学显微镜观察摄片,深棕色颗粒提示阳性表达。观察各组目的基因表达情况,试剂购自武汉博士德生物工程有限公司。
1.7统计学方法采用t检验对各组结果进行比较。
2 结果
2.1免疫前后各组动物血清CIEAgs特异性抗体水平比较由表1可见,与免疫前相比,三组动物免疫后CIEAg特异性抗体水平均较免疫前明显升高,差异有统计学意义(P<0.05)。免疫前和免疫后各组间比较,差异无统计学意义(P>0.05)。

表1 各组免疫前后血清CIEAgs特异性抗体水平(A值,珋x±s)
2.2各组造模前后及内耳注射后ABR检测结果由表2可见,与免疫前相比,免疫后各组ABR反应阈均升高,差异均有统计学意义(P<0.05)。A组内耳注射后ABR反应阈较内耳抗原免疫后降低,差异有统计学意义(共18耳,2耳感染不计) (P<0.05) ; B组(共9耳,1耳感染不计)和C组(共9耳,1耳感染不计)内耳注射后ABR反应阈较内耳抗原免疫后比较无明显变化,差异无统计学意义(P>0.05)。
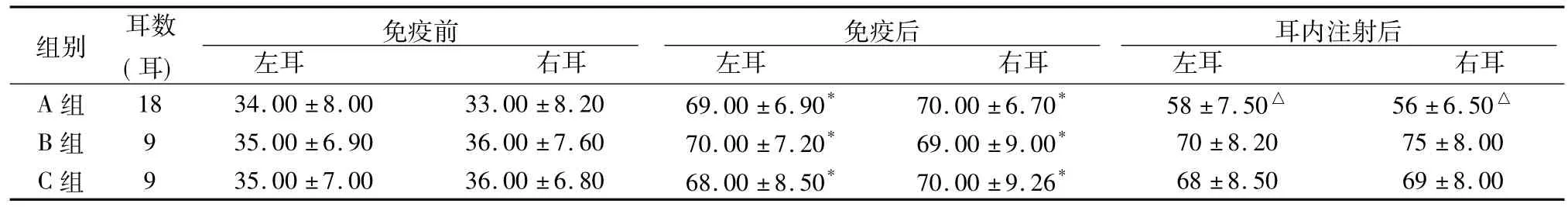
表2 各组免疫前后及内耳注射后ABR反应阈(dB SPL,珋x±s)
2.3内耳光镜观察结果光镜下可见各组内耳均出现免疫炎症反应,包括: Rosenthal’s管中炎性细胞(以单个细胞为主)浸润,螺旋神经节细胞变少,耳蜗顶回骨壁内及血管纹有散在的黄色含铁血黄素颗粒,部分动物蜗管或鼓阶内可见絮状物沉积,蜗管内出现“漂浮细胞”; Corti器和血管纹未见明显异常。A组有2只动物炎症反应明显较B组和C组轻,尤其是听觉功能改善耳,仅在蜗轴血管周围有部分单个核细胞浸润,但螺旋神经节细胞数大致正常,Corti器和血管纹未见明显异常;鼓阶内见部分絮状物,但未见“漂浮细胞”(图1)。
2.4免疫组织化学试验结果
2.4.1免疫荧光试验B组见明显荧光显示的部位主要分布于耳蜗骨壁、骨螺旋板的蜗管内唇部、螺旋韧带和血管纹等部位(图2)。
2.4.2免疫组织化学A组主要显色反应部位包括螺旋韧带、Corti器、血管纹、螺旋神经节以及耳蜗的骨壁。B组和C组仅在螺旋神经节和耳蜗骨壁有较弱的显色(图3)。

图1 各组的耳蜗纵轴切片光镜观察结果

图2 B组螺旋神经节纵轴切片免疫荧光染色结果

图3 各组耳蜗纵轴切片免疫组织化学染色结果
3 讨论
AIED的发病机制不明,但对许多自身免疫性疾病的发生和病理变化研究中发现,部分细胞因子起着重要作用,而自身免疫性的调节则由表达抗炎细胞因子的IL-4和IL-10所介导。
基于既往研究基础,本研究采用豚鼠同种内耳抗原免疫后,依据ABR波Ⅲ反应阈值升高(超过免疫前全部动物均值加2倍标准差)和出现针对CIEAgs特异性抗体,成功地制成了豚鼠自身免疫性内耳病模型[11],通过圆窗膜途径将重组腺病毒携带免疫调节因子(即Ad-IL-10)导入模型豚鼠内耳,结果显示经内耳局部注射Ad-IL-10后,部分实验动物的ABR波Ⅲ阈值降低,较对照组有显著性差异,说明其听功能有所恢复。而单纯注射腺病毒组与对照组比较听功能未出现进一步损伤,说明腺病毒作为载体在动物内耳研究中是安全可行的;但病毒载体存在的缺点如免疫原性、致瘤性及细胞毒性限制了其临床应用研究,因此寻找更有意义的载体也是目前研究的方向。本研究中A组动物的内耳免疫炎性反应较B组和C组动物轻,仅见部分实验动物出现蜗管内絮状物,未出现螺旋神经节细胞数量变化,Corti器和血管纹形态基本正常,提示导入内耳局部的免疫调节因子IL-10调节并抑制了由于自身免疫所造成的内耳炎性反应和损伤,这可能是A组动物听力提高的原因所在。
本研究结果显示,重组腺病毒可以成功转染豚鼠内耳,其主要分布于耳蜗骨壁、骨螺旋板的蜗管内唇部、螺旋韧带和血管纹等部位。IL-10基因产物主要分布于血管纹、螺旋韧带、Corti器、螺旋神经节以及耳蜗的骨壁,说明通过圆窗膜的单一点注射可以将治疗因子转导入并较为广泛地分布于内耳各部位组织中。本研究中仅极少数豚鼠出现了中耳感染,与鼓阶注射法[12]相比较,避免了耳蜗底回破坏造成的听损伤,该操作方法简单易行,安全可靠。值得一提的是本研究发现耳蜗的骨壁均有显著的病毒转染和免疫调节基因产物的表达,但其具体机制尚不清楚。依据以往实验研究中的发现[13],即同种内耳组织抗原免疫豚鼠后,部分实验动物的耳蜗骨壁内出现明显的炎性病灶(与耳硬化症的病变极为相似,从而支持该病的自身免疫性病因学假说),此次转入调节因子的治疗方法是否对于自身免疫性耳硬化症发挥一定的治疗效果,有待进一步研究证实。
总之,本研究表明外源性IL-10对实验性自身免疫性内耳病有一定治疗作用,然而细胞因子是个复杂的网络,IL-10在AIED中具体调节机制还有待进一步阐明。本研究只是对该领域的初步探讨,给药剂量、药物调控、远期疗效及安全性等方面等还有待进一步深入研究。相信随着分子生物学的发展,内耳的基因调节治疗必将成为一种非常有前景的治疗方法。
4参考文献
1黄选兆,汪吉宝,孔维佳.实用耳鼻咽喉头颈外科学[M].北京:人民卫生出版社,2008.998~1001.
2Raphael Y,Frisancho JC,Roessler BJ.Adenoviral-mediated gene transfer into guinea pig cochlear cells in vivo[J].Neurosci Lett,1996,207: 137.
3 Ishimoto S,Kawamoto K,Kanzaki S,et al.Gene transfer into supporting cells of the organ of Corti[J].Hear Res,2002,173: 187.
4 Sun H,Huang A,Cao S.Current status and prospects of gene therapy for the inner ear[J].Hum Gene Ther,2011,22: 1311.
5郭维,胡吟燕,翟所强,等.腺病毒携带的LacZ基因在豚鼠耳蜗中的表达[J].听力学及言语疾病杂志,2001,9: 36.
6 De Kozak Y,Thillaye-Goldenberg B,Naud MC,et al.Inhibition of experimental autoimmune uveoretinitis by systemic and subconjunctival adenovirus-mediated transfer of the viral IL-10 gene [J].Clin Exp Immunol,2002,130: 212.
7 Liang W,Zaruhi K,Xu QH,et al.B-cell delivered gene transfer of human S-Ag-Ig fusion protein protects from experimental autoimmune uveitis[J].Clin Immunol,2006,118: 35.
8Zhou B,Kermany MH,Cai Q,et al.Experimental autoimmune hearing loss is exacerbated in IL-10-deficient mice and reversed by IL-10 gene transfer[J].Gene Therapy,2012,19: 228.
9谭长强,董伟达,陆玲.同种内耳抗原免疫孕豚鼠所产子鼠听觉损伤程度与母鼠特异性免疫反应水平相关性研究[J].东南大学学报(医学版),2007,26: 397.
10杨湘宁,钟启明.同种内耳抗原免疫致豚鼠感音神经性聋的实验研究[J].中华耳鼻咽喉科杂志,1992,27: 325.
11谭长强,钟启明,曹银成,等.在自身免疫性感音神经性聋发病机理中内淋巴囊作用的实验研究[J].耳鼻喉学报,1993,7: 153.
12 Iizuka T,Kanzaki S,Mochizuki H,et al.Noninvasive in vivo delivery of transgene via adeno-associated virus into supporting cells of the neonatal mouse cochlea[J].Human Gene Therapy,2008,19: 384.
13谭长强.特异性体液转移免疫致豚鼠先天性感音神经性聋实验研究[J].东南大学学报(医学版),2007,26: 327.
(2014-12-09收稿)
(本文编辑雷培香)
·实验研究·
Adenovirus-Mediated IL-10 Gene for the Treatment of Autoimmune Inner Ear Disease-an Experimental Study
Cai Wenjun*,Tan Changqiang
(*Department of Otorhinolaryngology Head and Neck Surgery,Zhongda Hospital,Southeast University,Nanjing,210000,China)
【Abstract】Objective To evaluate therapeutic effects of transferring recombinant replication-defective adenovirus vector of interleukin 10(IL-10) gene into inner ear of guinea pig for the treatment of autoimmune inner ear disease.Methods The conspecific crude inner ear antigens (CIEAgs) were prepared and used to immunize guinea pigs with Freund's adjuvant that resulted autoimmune inner ear diseases (AIED) in 20 animals.Then they were randomly divided into three groups.Through the way of round window membrane micro-injection,adenovirus vector containing IL-10(Ad-IL-10) gene were implanted in group A(ten animals),recombinant adenovirus with yellow fluorescent protein(Ad-EYFP) marked was implanted in group B(five animals),and artificial perilymph were implanted in group C(five animals).Seven days later,auditory brain-stem response (ABR) thresholds were determined,the guinea pig inner ears were obtained,and the immunohistochemistry staining were perform for detecting adenovirus vector transfection with immunofluorescence and the gene product interleukin 10 expressions with enzyme immunohistochemistry.Results Immunohistochemistry staining showed that the adenovirus carrying IL-10 gene could transfer the psalterial cord,spiral ligament,Corti organ,spiral ganglion,cochlear axis vessels and cochlear bone paries.It could generate gene product (IL-10 ) in same sites.The mean ABR thresholds were increasedbook=603,ebook=40in each group after modeling.The differences were statistically significant.After injection of the inner ear,the mean ABR thresholds of group A were lower than those of group B and group C.The light microscopic revealed the immunological inflammatory response were lighter than in group B and group C.Conclusion The adenovirus could transfer IL-10 gene into inner ear of guinea pig and express its products in many parts of inner ear.The immunity regulating gene can reduce the immunity damage and hearing functional impairment.
【Key words】Interleukin 10(IL-10) ; Autoimmune inner ear disease(AIED) ; Adenovirus
通讯作者:谭长强(Email: wenjun.cai@163.com)
作者简介:蔡文君,女,河北人,硕士,主要研究方向为耳科学与听力学。
【中图分类号】R764.3
【文献标识码】A
【文章编号】1006-7299(2015) 06-0602-05
DOI:10.3969/j.issn.1006-7299.2015.06.009
网络出版时间:2015-9-10 16: 47
网络出版地址: http://www.cnki.net/kcms/detail/42.1391.R.20150910.1647.028.html
