基于分光光度法测定血液中非那西丁与扑热息痛含量的肝脏储备功能评估
2015-03-11逯素梅任瑞孙涛马永梅马万山山东省千佛山医院济南250014
逯素梅,任瑞,孙涛,马永梅,马万山(山东省千佛山医院,济南 250014)
基于分光光度法测定血液中非那西丁与扑热息痛含量的肝脏储备功能评估
逯素梅,任瑞,孙涛,马永梅,马万山(山东省千佛山医院,济南 250014)
摘要:目的建立基于分光光度法测定非那西丁与扑热息痛含量的肝脏储备功能评估方法。方法筛选分光光度测定的显色体系,确定最大吸收波长,分析不同因素对显色体系的影响,优化非那西丁与扑热息痛水解的最佳条件,最后对技术体系进行应用性验证。结果建立了利用分光光度测定样品中非那西丁和扑热息痛含量的技术体系,即样品加入3 mol/L盐酸水解30 min,加入0.02% 1,2-萘醌-4-磺酸钠、1%十六烷基三甲基溴化铵及2% NaOH(或3% Na2CO3)(比例为1∶6∶1∶2或3),分别于500 nm和570 nm下测定吸光值,计算各自浓度。该技术测定血浆样品中非那西丁与扑热息痛时的分辨率和重复性与高效液相色谱法相当。结论利用分光光度技术测定血液中非那西丁与扑热息痛含量,二者比值具有评估肝脏储备功能价值。
关键词:肝脏储备功能;分光光度技术;非那西丁;扑热息痛
肝脏储备功能是肝脏所有储备肝细胞功能的总和,其在决定是否进行肝切除术及方案选择上起着不可替代的地位[1],但目前临床使用的肝脏储备功能评价技术和指标存在诸多不足。如常用的肝功能生化指标ALT、AST、GGT和LDH,只是表征肝细胞受损,并非肝脏储备功能的指标[2,3];凝血酶原时间、血浆白蛋白和血浆胆红素含量能够反映肝脏的功能,但却受肾脏排泄功能、胃肠道的消化吸收功能和血红蛋白的分解代谢等因素影响,造成检测灵敏度低,特异性差,难以满足临床的需要。因此,建立灵敏度高、特异性强的肝脏储备功能评价体系是当前临床迫切需要解决的重要课题。其中,利用探针药物测定肝脏药物代谢酶细胞色素P450的活性评价肝脏储备功能备受重视[4]。
细胞色素P450-1A2 (CYP1A2)是CYP酶系的重要家族之一,占整个细胞色素酶P450的15%[5],在人的肝脏呈组成型表达,参与内源性(胆汁酸、胆固醇等)及外源性物质(药物、毒物)的生物转化[6,7],是临床评价肝脏储备功能的理想靶点。CYP1A2的外源性底物包括咖啡因、非那西丁、茶碱等[8]。研究表明,非那西丁是CYP1A2酶活性的特异性底物[9~11],在肝脏代谢的第一步包括O-脱乙基、N-脱乙酰基和2-羟化反应等过程,其中O-脱乙基化生成扑热息痛是非那西丁生物转化的主要步骤。Cui等[12]研究表明,非那西丁O-脱乙基酶在肝脏外组织中的活性极低,非那西丁O-脱乙基反应只有不到5%是在肝脏外进行的,因此非那西丁O-脱乙基作用可作为评价肝脏CYP1A2活性的专属性和指示性反应。服用探针药物非那西丁后,测定一定时间内血液中非那西丁与扑热息痛的比值,用以反映CYP1A2活性及药物之间的相互作用[13,14],即能准确反映肝脏的生物转化功能。
1材料与方法
1.1材料人外周血标本采自2012年1月~2014年1月健康成年人新鲜的外周血。试剂包括非那西丁(Sigma公司),扑热息痛(Sigma公司),对氨基苯酚(阿法埃莎公司),对氨基苯乙醚(阿法埃莎公司),1,2-萘醌-4-磺酸钠(NQS,日本化成工业株式会社),十六烷基三甲基溴化铵(CTA,国药集团化学试剂公司),茶碱(国药集团化学试剂公司),硫化钠(国药集团化学试剂公司),高锰酸钾(国药集团化学试剂公司),重铬酸钾(国药集团化学试剂公司),甲醇(Merk公司),盐酸(国产),Na2CO3(国产),NaOH(国药集团化学试剂公司)。仪器包括Cary100型紫外-可见分光光度计(美国Varian公司),Alliance 2695型高效液相色谱仪(2998UV检测器)(美国Waters公司),Pico型微量台式离心机(美国Thermo Fisher Scientific公司),Stratos高速离心机(美国Thermo Fisher Scientific公司),TW12型恒温水浴槽(德国JULABO公司),XBRIDGE C18色谱柱(美国Waters公司)。
1.2方法
1.2.1显色体系的选择
1.2.1.1显色剂的筛选经查阅文献和实验研究表明,非那西丁和扑热息痛不易与其他化合物反应生成有色产物,而二者的水解脱乙酰基产物对氨基苯乙醚和对氨基苯酚可与多种物质生成有色产物,从而为分光光度法测定非那西丁和扑热息痛奠定了基础。在人体内,非那西丁和代谢产物扑热息痛是混合在一起的,且含量较低。因此,显色体系应满足以下条件:①显色剂在常温下应稳定,常温下能迅速与非那西丁和扑热息痛反应,有色产物稳定。②显色剂若为一组,则与非那西丁和扑热息痛反应可产生颜色不同的产物,且二者最大吸收波长差值应尽量大,该种情况下选择双波长分光光度技术测定非那西丁和扑热息痛的含量;显色剂可为两组,即测定非那西丁和扑热息痛的显色剂不同,这种情况下要求显色剂应具有专属性即测定非那西丁(或扑热息痛)的显色剂与扑热息痛(或非那西丁)不反应或不生成能造成干扰的有色产物。③显色剂不易受其他常规药物或血清的干扰。④非那西丁和扑热息痛水解后与显色剂直接反应或二次处理简单。
1.2.1.2最大吸收波长配制一定浓度的对氨基苯乙醚和对氨基苯酚的标准溶液,加入显色剂,待反应稳定后用紫外分光光度计在800~200 nm的范围内进行扫描,记录扫描结果,以确定最大吸收波长。
1.2.1.3干扰因素分析配制一定浓度的对氨基苯乙醚和对氨基苯酚的标准溶液,加入干扰因子(如测定对氨基苯乙醚加入对氨基苯酚、血清等),加入显色剂,待反应稳定后用紫外分光光度计在800~200 nm的范围内进行扫描,记录扫描结果,分析各干扰因素的影响。
1.2.2显色体系的优化根据目标显色体系,分别从以下几方面对显色体系进行优化:①显色剂各组分添加次序的选择;②显色剂用量的优化;③pH值优化;④显色时间优化;⑤显色温度优化。
1.2.3非那西丁与扑热息痛水解条件的建立使非那西丁与扑热息痛水解脱乙酰基完全可采取两种策略即碱水解和酸水解,由于NaOH水解两种药物时条件不易控制且不安全,因此本研究采取酸(盐酸)水解,并对酸的浓度、水解时间进行了探索和优化。
2结果
2.1显色体系的选择根据文献和反复实验研究表明,能单独与非那西丁和扑热息痛的脱乙酰产物对氨基苯乙醚和对氨基苯酚反应生成有色产物的显色剂很多,但经过预实验初步确定两组显色体系可用于测定同时存在于血液样品中的两种物质。其中一种显色体系为氨基苯乙醚和对氨基苯酚与NQS反应生成黄红色或紫红色产物,二者颜色有差别但差别不大,如果加入CTA,则起到增色作用。对氨基苯酚和对氨基苯乙醚与NQS反应产物的最大吸收波长分别为530 nm和465 nm,加入CTA后,最大吸收波长向长波向方向移动,分别变为570 nm和500 nm。因此选择NQS+CTA作为对氨基苯酚和对氨基苯乙醚的显色体系。
2.2显色体系的优化
2.2.1显色剂浓度和添加次序的优化1 mL待测溶液(含25~500 μg样品),加入0.02% NQS 4~8 mL,1% CTA 0.5 mL均能得到理想的颜色反应结果,因此选择6 mL NQS和1 mL CTA,二者加入次序对测定结果无影响。
2.2.2酸碱度及温度对显色的影响反应体系的酸碱对测定影响很大[15,16],测定对氨基苯酚(扑热息痛)时,加入1~4 mL 2% NaOH紫红色产物稳定,能得到理想结果;测定对氨基苯乙醚(非那西丁)时,有色产物NaOH中不稳定,加入1~6 mL 2% Na2CO3产物稳定,若低于3 mL则不稳定。因此,选择2 mL 2% NaOH和3 mL 2% Na2CO3用于扑热息痛和非那西丁的测定。有色产物在5~80 ℃温度范围内均较稳定,超过80 ℃,吸光值迅速下降。
2.2.3标准曲线的建立配制系列不同浓度的对氨基苯乙醚和对氨基苯酚,分别依次加入6 mL NQS、1 mL CTA、2 mL 2% NaOH(对氨基苯酚)或3 mL 2% Na2CO3(对氨基苯乙醚),定容至25 mL,于分光光度测定。绘A-C标准曲线。见图1。回归方程分别为:A570=0.071 6×(PRL浓度)+0.003 1,A500=0.025 1×(PHN浓度)+0.010 5。

图1 非那西丁与扑热息痛A-C标准曲线
2.3非那西丁与扑热息痛最佳水解条件建立上述方面建立的分光光度法所测定的实际是非那西丁与扑热息痛的水解脱乙酰基的产物,因此确保样品中的非那西丁与扑热息痛完全水解是极关键的一步。本项目采取盐酸水解。首先确定最佳盐酸浓度,其中水解率=1-测试含量/初始含量,含量均利用建立的HPLC技术测定。非那西丁与扑热息痛盐酸水解的最佳浓度均为2~6 mol/L。配浓度均为3 mmol/L的非那西丁和扑热息痛混合溶液,采用3 mol/L的盐酸水解,以确定最佳水解时间,其中水解率=1-测试含量/初始含量,含量均利用前面建立的HPLC技术测定。得出非那西丁与扑热息痛最佳水解时间均为30 min。
2.4应用验证取健康人血浆,配制不同浓度的非那西丁和扑热息痛混合溶液,每种浓度溶液分为两份,一份利用HPLC技术测定含量,另一份利用建立的水解条件水解、加入显色剂、测定吸光值并利用标准曲线计算含量。在浓度为1~20 μg/mL的浓度范围内,利用所建立的分光光度技术进行测定,RSD均<10%,当浓度超过5 μg/mL时,RSD<5%,测定更加准确,重复性好。见表1。
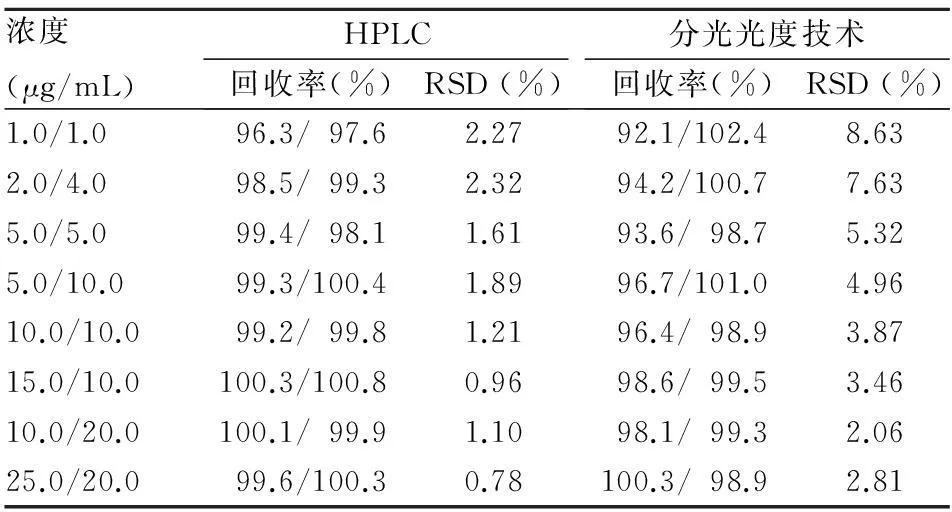
表1 HPLC与分光光度技术测定比较(n=4)
3讨论
在评价肝脏储备功能方面,有许多不同的方法。总的来说,传统生化指标较易测定,临床上广泛应用;定量肝功能试验及影像学手段,操作较复杂,试剂设备要求较高;临床肝功能分级综合几个生化指标,准确性较高,但有一定局限,尤其是在反映肝脏在承受外来额外负荷时。因此,正确评价肝脏储备功能,是目前临床迫切需要解决的重要课题。
探针药物试验是通过测定代谢产物含量的变化,评价肝脏的功能状态,但代谢产物的形成过程,不仅与肝脏本身功能相关,还受生物利用度、蛋白结合率、肾功能等的影响。CYP1A2在肝内特异表达,约占肝脏CYP酶总量的13%[17],是各种因素导致肝脏疾病的共同易损靶点[18],约55%文献选用非那西丁O-脱乙基化反应研究体外CYP1A2活性[19],其特异底物非那西丁在肝脏经O-脱乙基化生成扑热息痛,通过测定血液中非那西丁及扑热息痛含量评估肝脏储备功能,具有很大优势,主要包括找到了共同的易损靶点;肝外代谢极少;检测终产物体现了生物转化的连续性;受胃肠吸收、肾脏排泄功能的影响小。此外,非那西丁具有对人体影响小,简便测定等优点[20],且价格低廉,因此,其是临床实验的一个理想探针药物。
血液中的非那西丁和扑热息痛含量均为微克级,需借助HPLC、液相色谱—串联质谱法(LC-MS)等现代仪器分析技术才能准确测定,这些经典技术技术具有分辨率高、测定结果准确可靠等优点,但分析仪器价格昂贵、测定成本高、步骤繁锁,显然无法满足临床肝脏功能大规模检测的要求。考虑到临床检验的仪器如全自动生化分析仪、酶标仪、分光光度计均基于分光光度技术,建立基于分光光度技术的非那西丁与扑热息痛的高分辨测定技术,从而为研究开发实用性强的新型肝脏储备功能检测试剂盒奠定坚实的基础。
本研究建立了利用分光光度技术测定血液样品中微量非那西丁和扑热息痛的技术体系,即样品加入3 mol/L盐酸水解30 min,加入0.02% NQS、1% CTA及2% NaOH(或3% Na2CO3)(比例为1∶6∶1∶2或3),分别于500 nm和570 nm下测定吸光值,计算各自浓度。本研究所建立的技术为开发基于血液中非那西丁和扑热息痛比值的肝脏储备功能检测试剂盒奠定了基础。通过应用性验证,本研究所建立的分光光度技术具有分辨率高、测定结果准确可靠等优点,而且克服了分析仪器价格昂贵、测定成本高、步骤繁锁的不足,可以满足临床肝脏储备功能大规模检测的要求。
参考文献:
[1] Manizate F, Hiotis SP, Labow D, et al. Liver functional reserve estimation: state of the art and relevance to local treatments[J]. Oncology, 2010,78(1):131-134.
[2] 梁明龙,张久权,王健.术前肝脏储备功能评估方法的研究进展[J].中华消化外科杂志,2014,13(4):317-320.
[3] Ge PL, Du SD, Mao YL. Advances in preoperative assessment of liver function[J]. Hepatobiliary Pancreat Dis Int, 2014,13(4):361-370.
[4] 李国昌,陈卫军,蒲宇红.细胞色素P450酶系与药物代谢[J].农垦医学,2004,26(1):26-29.
[5] 刘哲,王祥瑞.细胞色素酶P4501A2表型分析及其应用价值[J].实用医学杂志, 2008,24(5):871-872.
[6] 王潇,刘华,白洁.细胞色素P450调节肝脏药物代谢的途径[J].生物技术通报, 2009,(7):39-41.
[7] Rifkind AB. CYP1A in TCDD toxicity and in physiology-with particular reference to CYP dependent arachidonic acid metabolism and other endogenous substrates[J]. Drug Metab Rev, 2006,38(1):291-335.
[8] Qu ZQ, Li XD, Liu HL, et al. Impaired clearance of phenacetin in hepatic cirrhosis and fibrosis[J]. Int J Clin Pharmacol Ther, 2007,45(1):55-62.
[9] 张瑞媚,李允武,金芝贵,等.HPLC法测定非那西丁和对乙酰氨基酚的血浓度[J].北方药学,2012,9(1):47.
[10]胡云珍,姚彤炜.细胞色素P4501A的研究进展[J].中国药学杂志,2003,38(4):246-250.
[11] Faber MS, Jetter A, Fuhr U. Assessment of CYP1A2 activity in clinical practice: why, how and when[J]. Basic Clin Pharmacol Toxicol, 2005,97(3):125-134.
[12] Cui ZF, He P, Luo M, et al. Phenacetin O-deethylation in extrahepatic tissues of rats[J]. Eur J Drug Metab Pharmacokinet, 2002,27(2):107-111.
[13] Tanaka E, Kurata N, Yasuhara H. How useful is the "cocktail approach"for evaluating human hepatic drug metabolizing capacity using cytochrome P450 phenotyping probes in vivo[J]. J Clin Pharm Ther, 2003,28(3):157-165.
[14] Dahl ML. Cytochrome P450 phenotyping/genotyping in patients receiving antipsychotics: useful aid to prescribing[J]. Clin Pharmacokinet, 2002,41(7):453-470.
[15] Filik H, Hayvali M, Kilic E. Sequential spectrophotometric determination of paracetamol and p-aminophenol with 2,2′-(1,4-phenylenedivinylene) bis-8-hydroxyquinoline as a novel coupling reagent after microwave assisted hydrolysis[J]. Analytica Chimica Acta, 2004,535(1-2):177-182.
[16] Bandelin FJ, Pankratz RE. Colorimetric Determination of p-Acetophenetidide[J]. Analytical Chemistry, 2002,28(2):218-221.
[17] Urlacher VB, Eiben S. Cytochrome P450 monooxygenases: perspectives for synthetic application[J]. Trends Biotechnol, 2006,24(7):324-330.
[18] 顾而立,贺平,王虹,等.非那西丁代谢试验与13C-美沙西丁呼气试验在正常志愿者中的重复性和相关性[J].肝脏,2012,17(12):849-853.
[19] Yuan R, Madani S, Wei XX, et al. Evaluation of cytochrome P450 probesubstrates commonly used by the pharmaceutical industry to study in vitro drug interactions[J]. Drug Metab Dispos, 2002,30(12):1311-1319.
[20] Huang W, Qu ZQ, Li XD, et al. The effect of transcatheter arterial chemoembolization on CYP1A2 activity in patients with hepatocellular carcinoma[J]. J Clin Pharm Ther, 2008,33(5):489-493.
Assessment of liver reserve function based on determination of phenacetin
and paracetamol by spectrophotometry
LUSu-mei,RENRui,SUNTao,MAYong-mei,MAWan-shan
(ShandongProvincialQianfoshanHospital,Jinan250014,China)
Abstract:ObjectiveTo establish a liver reserve function assessment method based on detection of phenacetin and paracetamol by spectrophotometry. MethodsTo screen the spectrophotometric color system, determine the maximum absorption wavelength, analyze the influence of color system in different factors, optimize optimal conditions that phenacetin and paracetamol hydrolyze, and then verify the application of this technology about the established system. ResultsThe technology system detected phenacetin and paracetamol of blood samples using spectrophotometry was established, in which 3 mol/L hydrochloric acid was added to samples to hydrolyze for 30 min, then added 0.02% 1,2-naphthoquinone-4-sulfonate, 1% sixteen alkyl bromide and 2% sodium hydroxide (or 3% sodium carbonate) (ratio of 1∶6∶1∶2 or 3), and then the absorbance was measured under 500 nm and 570 nm to calculate each concentration. Resolution and repeatability of technology used for determining phenacetin and paracetamol of plasma samples were comparable with HPLC. ConclusionRatio of phenacetin and paracetamol under established spectrophotometric system could assess liver reserve function.
Key words:liver reserve function; spectrophotometry; phenacetin; paracetamol
(收稿日期:2014-11-04)
中图分类号:R333.4
文献标志码:A
文章编号:1002-266X(2015)04-0014-04
doi:10.3969/j.issn.1002-266X.2015.04.005
通信作者简介:马万山(1967-),男,硕士,主任技师,研究方向为临床医学检验。E-mail: mwsqianyi@163.com
作者简介:第一逯素梅(1982-),女,博士,主管技师,研究方向为临床医学检验。E-mail: lsmqianyi@126.com
基金项目:山东省科技攻关项目(2009GG10002005);山东省医药卫生科研项目(2007HW116)。
