利用PCR扩增及基因合成构建Adnectin半随机核糖体展示文库
2015-03-11郭永红问娇王俊红西安交通大学第二附属医院西安710004
郭永红,问娇,王俊红(西安交通大学第二附属医院,西安 710004)
利用PCR扩增及基因合成构建Adnectin半随机核糖体展示文库
郭永红,问娇,王俊红(西安交通大学第二附属医院,西安 710004)
摘要:目的构建Adnectin半随机的核糖体(mRNA)展示文库。方法分析Adnectin核糖体展示文库结构序列的编码氨基酸序列,利用无意突变建立酶切位点,使用PCR扩增和基因合成两种方法相结合,构建Adnectin半随机核糖体展示文库,通过限制性内切酶及DNA测序证实序列正确性,对文库转化菌的滴定和插入失活蓝白菌斑筛查和计数测定计算文库的库容。结果经测序证实文库结构的正确性,文库的库容为1.54×1013/mL。结论成功构建Adnectin半随机的核糖体展示文库,方法简单,库容量大,该文库的建成为亲和各种相关蛋白的Adnectin结合序列奠定基础。
关键词:Adnectin;PCR扩增;基因合成;核糖体展示文库
Adnectins是基于Ⅲ型纤维连接蛋白第10结构域(10Fn3)所设计衍生的半人工蛋白分子,可以模拟抗体结合靶蛋白分子,具有高亲和力、高特异性、反复使用不产生抗体等优点[1],被认为是有极好应用前景的蛋白药物[2]。核糖体展示技术是利用PCR技术扩增目的基因文库,同时引入启动子、核糖体结合位、间隔序列、5′端和3′端茎环结构,然后在体外无细胞系中进行转录和翻译[3],利用体外表达体系以mRNA—核糖体—抗体三元复合物的形式将基因型和表型联系起来用于抗体开发的技术。采用体外构建、筛选的方法改造抗体,避免了噬菌体展示技术转化步骤的限制,更易构建出高容量、高质量的文库筛选出特异性蛋白,为制备小分子蛋白质或多肽开辟了一条新途径[4]。2012年6月~2013年3月,本研究利用基因合成和PCR扩增两者相结合方法,成功地构建了Adnectin半随机的核糖体(mRNA)展示文库,该文库的建成为亲和各种相关蛋白的Adnectin结合序列奠定了基础。
1材料与方法
1.1材料pGEM-Teasy载体及菌种Ecoli DH5α和TOP10菌种均由本实验室保存,质粒pES+G18602由华广生物有限公司提供。限制性内切酶、DNA Marker、DNA连接试剂盒均购自TaKaRa宝生物工程(大连)有限公司。PCR产物纯化试剂盒和凝胶回收试剂盒为Qiagen quick Gel Extraction Kit(Cat28704);质粒小量抽提试剂盒及基因合成为上海生物工程技术服务有限公司提供,其余试剂均为分析纯。
1.2方法
1.2.1基因合成结合PCR扩增构建文库设计方法Adnectin核糖体(mRNA)展示文库结构和序列:T7 promoter-5′-stem loop-ribosome binding site-Adnectin library-spacer-3′-stem loop,使用基因合成方法合成文库的两侧翼序列:T7 promoter-5′-stem loop-ribosome binding site-SpeI-spacer-Hind Ⅲ-3′-stem loop序列,使用PCR方法合成半随机文库-SpeI-spacer-Hind Ⅲ序列,使用限制性内切酶Spe Ⅰ和Hind Ⅲ双酶切后将半随机文库插入到合成两翼序列载体中,使半随机文库5′端加载核糖体展示需要的T7启动子、茎环结构、核糖体结合位点和起始密码子,3′端加载茎环结构和间隔序列,建立插入Adnectin核糖体(mRNA)展示文库的质粒载体。半随机文库的酶切点Spe Ⅰ的选择是依据对Adnectin核糖体(mRNA)展示文库结构序列的编码氨基酸序列分析后,使用无意突变后确定,第152及155位核苷酸为突变处,原序列ACCAGC突变后ACTAGT,编码相同的氨基酸-TS-,ACTAGT序列成为了可以使用的Spe Ⅰ酶识别点。把需要构建的如下序列分成了两个区,使用PCR方法扩增半随机文库-Spe Ⅰ-spacer-Hind Ⅲ序列,由GATCAG开始到AAGCTTG,余序列由基因合成后连接入pES+G18602质粒。需要构建的全序:ATACGAAATTAATACGACTCACTATAGG-GAGACCACAACGGTTTCCCTCTAGAAATAATTTTG-TTTAACTTTAAGAAGGAGATATATCCATGGACTAC-AAAGACGTTTCTGATGTTCCGAGGGACCTGGAAGT-TGTTGCTGCGACCCCCACTAGTCTACTGATCAGCT-GGNNBNNBNNBNNBNNBNNBNNBTATTACAGGAT-CACTTACGGAGAAACAGGAGGAAATAGCCCTGTC-CAGGAGTTCACTGTGCCTNNBNNBNNBNNBNNBG-CTACCATCAGCGGCCTTAAACCTGGAGTTGATTAT-ACCATCACTGTGTATGCTGTCACTNNBNNBNNBNN-BNNBNNBNNBNNBNNBNNBCCAATTTCCATTAATT-ACCGAACAGAAATTGACAAACCATCCCAGGGCTTT-AATGAAAAGCTTGATCCATTCGTTTGTGAATATCA-AGGCCAATCGTCTGACCTGCCTCAACCTCCTGTCA-ATGCTGGCGGCGGCTCTGGTGGTGGTTCTGGTGGC-GGCTCTGAGGGTGGTGGCTCTGAGGGTGGCGGTTC-TGAGGGTGGCGGCTCTGAGGGAGGCGGTTCCGGTG-GTGGCTCTGGTTCCGGTGATTTTGATTATGAAAAG-ATGGCAAACGCTAATAAGGGGGCTATGACCGAAA-ATGCCGATGAAAACGCGCTACAGACCGCACACCT-TACTGGTGTGCGG。其中N表示A、C、G、T 4种碱基随机;B表示C、G两种随机碱基;TAATA为T7促进子;ATGGAC开始为文库序列;GATCCA开始为间隔序列;ACCGC开始为茎环结构。
1.2.2PCR扩增半随机文库方法首先,使用含有第三helix bundle的F1引物和R1引物做PCR扩增,获得产物作为二次PCR的模板;再使用F2和R2引物进行PCR扩增,产物作为反应模板,使用含有第二helix bundle的F3引物和R3引物扩增后产物用于下一次PCR反应模板,在以后的PCR反应中F向引物依次增加,R向引物一直使用R3引物,直至F6和R3引物扩增后得到产物。半随机文库PCR引物:F1:GTGTAT GCTGTCACTN NBNNBNNBNN BNNBNNBNNB NNBNNBNNBC CAATTTCCAT T;R1:GTTTGTCA ATTTCTGTTC GGTAATTAAT GGAAATTGG;F2:T CAG CGGCCTTAAA CCTGGAGTTG ATTATACCAT CACTGTGTAT GCTGTCAC-T;R2:GCTTTTCATT AAAGCCCTGG GATGGTTTGT CAATTTCTG;F3:CCTGTCCAGG AGTTCACTGT GCCTNNBNNB NNBNNBNNBG CTACCATCAG CGGCC;R3:CAA GCTTTTCATT AAAGCCC;F4:TATTACAGG ATCACTTACG GAGAAACAGG AGGAAATAGC CCTGTCCAGG AGTTC;F5:GTCTACT GATCAGCTGG NNBNNBNNBN NBNNBNNBNN BTATTACAGG ATCACTTAC;F6:CA CTAGTCTACT GATCAGCTGG。其中N表示A、C、G、T 4种碱基随机,B表示C、G两种随机碱基。
1.2.3半随机文库的构建方法PCR反应条件:95 ℃ 5 min;95 ℃ 40 s;56 ℃ 1 min;72 ℃ 1 min;18个循环;最后72 ℃延伸10 min,以25 μL PCR反应体系进行。PCR产物进行2%琼脂糖凝胶电泳鉴定,扩增成功的PCR产物以胶回收试剂盒进行纯化回收,为增加文库容量,每次PCR使用5 μL产物做模板,在5个平行管内扩增,产物混合后作为模板使用。将PCR纯化产物与pGEM-Teasy质粒载体16 ℃连接过夜,最后的PCR产物全部插入到pGEM-Teasy质粒载体转导Top10受体菌,取感受态菌100 μL加重组体10 μL,常规方法操作,共转导100管受体菌,50管菌体做LB(Luria-Bertani)—氨基苄青霉素(Amp)固体培养基培养,挑取单菌落进行Spe Ⅰ及Hind Ⅲ双酶切鉴定,切胶回收酶切产物。
1.2.4重组pES+G18602载体的构建方法DNA连接试剂盒连接,16 ℃过夜。将连接产物转化感受态DH5α,37 ℃培养16~18 h,将PCR产物连接入含有合成基因的pES+G18602载体,挑取单菌落进行酶切鉴定,筛选正确的菌落20个克隆送上海生工生物工程技术服务有限公司测序,采用Pubmed Blast进行序列检索比对。
1.2.5文库容量计算方法50管菌体经倍比稀释转化大肠杆菌Top10,取转化菌10 μL涂布于表面涂有X-gal(Galactoside)和IPTG(Isopropyl β-D-1-thiogalactopyranoside)的含Amp琼脂糖平板上,37 ℃过夜培养。蓝白班筛选计数细菌转化克隆和计算文库容量。
2结果
2.1PCR产物电泳结果见图1。
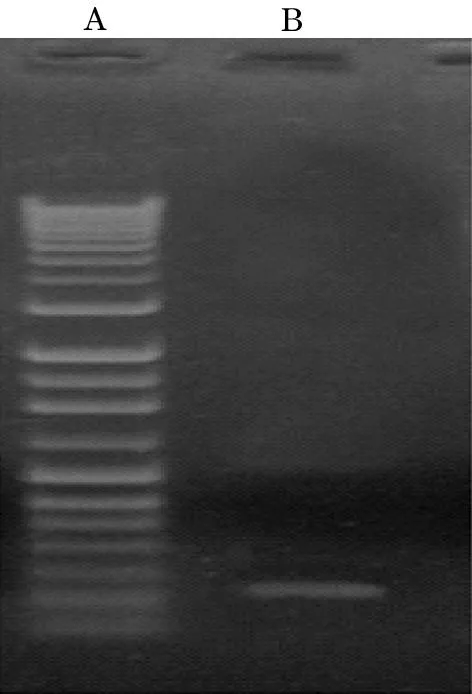
注:A为DNA Marker,分子量从下到上分别是100、200、300、400、500、600、750、1 000、1 314、1 614、2 011、3 000、4 000、5 000、6 000和12 000 bp;B为PCR扩增产物,分子量为263 bp。
图1PCR产物的琼脂糖凝胶电泳鉴定图
2.2重组pGEM-Teasy-Adnectin质粒酶切电泳鉴定结果见图2。

注:A为DNA Marker,分子量从下到上分别为100、200、300、400、500、600、750、1 000、1 314、1 614、2 011、3 000、4 000、5 000、6 000和12 000 bp;B为限制性内切酶SpⅠ及HindⅢ酶切产物,分子量为263 bp。
图2重组pGEM-Teasy-Adnectin质粒酶切电泳图
2.3文库转化菌克隆的测序结果20个送检测序的克隆,仅有13个克隆测序显示具有完整的three-helix bundle结构,经Blast比对序列完全符合,见插页Ⅰ图1。其余7个克隆仅有two-helix bundle结构,产生的原因可能和该插入序列多发夹结构使测序信号中断有关,可能也同PCR扩增产生错误有关。
2.4文库容量计算结果对文库转化菌的滴定和插入失活蓝白菌斑筛查和计数,最终获得纯化的PCR产物15.4 μg,文库的库容为1.54×1013/mL。
3讨论
10Fn3独特的结构和良好的生物物理特性决定其最适合作为蛋白支架。10Fn3是最早被研究、也是最具临床应用前景的支架蛋白[5~7],其结构与抗体可变区相似,适合装配多功能分子;10Fn3不包含二硫键或自由巯基,这种结构特点保证了其在高温和还原环境下的稳定性,并且能在细菌内高效表达活性产物[8];10Fn3作为蛋白支架,其本身无毒性和免疫原性;10Fn3的另一个优势是它可以天然适合多聚化产生多功能连接分子。10Fn3中的3个环状结构(BC、DE和FG)在结构上与抗体分子的互补决定区(CDR)中的H1、H2及H3同源,改变该处的氨基酸序列则可以使其理论上能与任何配体分子特异结合[9]。
Adnectins是基于10Fn3所设计的一类半人工蛋白分子,对于目标靶分子高亲和力和高特异性的特性使得Adnectins被认为是未来最具应用前景的蛋白药物[10~12]。
目前,报道筛选出的Adnectins有20个左右,靶分子包括泛素、TNF-α、溶菌酶、SARS病毒N蛋白、EGFR、VEGF-R2等[13~16],筛选方法包括噬菌体展示系统、酵母展示技术、酵母双杂交技术及核糖体mRNA展示技术等,筛选出的Adnectin与靶分子的亲和力不乏与抗原抗体之间亲和力相媲美者。其中,针对VEGF-R2的Adnectin和CT-322已经批准进入二期临床试验,用于多形胶质母细胞瘤、非小细胞肺癌及转移性结肠癌的治疗[17~19]。
核糖体展示技术是针对大容量基因库高效筛选功能基因的有效方法之一,其相比于目前的体内展示技术(噬菌体展示技术、酵母表面展示技术)有两个关键的特性:首先,筛选不受转化效率的限制,可针对大容量基因库进行富集筛选;其次,在PCR过程中可引入点突变改变功能蛋白的专一性和亲和性,同时通过核糖体—蛋白质—mRNA三联体的配体结合反应选择功能蛋白。通过核糖体展示文库筛选Adnectins,可以构建更大库容的库。经过参阅相关文献,设计选择合成长片段和PCR的方法构建用于转录和筛选的DNA链。半随机文库的酶切点Spe Ⅰ的选择是依据对原Adnectin核糖体(mRNA)展示文库结构序列的编码氨基酸序列分析后,使用无意突变后确定,第152及155位核苷酸为突变处,原序列ACCAGC突变后ACTAGT,编码相同的氨基酸-TS-,ACTAGT序列成为了可以使用的Spe Ⅰ酶识别点。使用PCR方法扩增半随机文库-Spe Ⅰ-spacer-Hind Ⅲ序列,使用基因合成方法合成文库的两侧翼序列,即T7 promoter-5′-stem loop-ribosome binding site—Spe Ⅰ-spacer -Hind Ⅲ-3′-stem loop序列。这样可以使用内切酶Spe Ⅰ和Hind Ⅲ双酶切后将半随机文库文库插入到合成两翼序列载体中,使半随机文库文库5′端加载核糖体展示需要的T7启动子、茎环结构、核糖体结合位点和起始密码子,3′端加载茎环结构和间隔序列,建立插入Adnectin核糖体(mRNA)展示文库的质粒载体,且整个核糖体展示模板不存在终止密码子,保证mRNA-核糖体—蛋白质以复合物的形式存在。目前,DNA合成技术已非常成熟,能保证合成的长DNA链的准确性;PCR过程中以多投入引物、减少循环次数的方法减少偏倚;每次反应后进行长度检测,将终产物克隆入质粒载体,进行多个克隆的序列分析,推算文库的多样性;通过这些措施,保证文库的质量,而引物的设计是决定文库多样性的关键。经限制性内切酶及DNA测序证实了文库结构的正确性和文库序列的多样性,对文库转化菌的滴定和插入失活蓝白菌斑筛查和计数测定计算,文库的库容为1.54×1013/mL。
综上所述,使用基因合成和PCR扩增两者相结合的方法,成功的构建了Adnectin半随机的核糖体(mRNA)展示文库。该文库构建方法较之前传统方法简单,成本低,库容量大,为构建亲和各种相关蛋白的Adnectin结合序列奠定了基础。
参考文献:
[1] Lipovsek D. Adnectins: engineered target-binding protein therapeutics[J]. Protein Eng Des Sel, 2011,24(1-2):3-9.
[2] Ackermann M, Carvajal IM, Morse BA, et al. Adnectin CT-322 inhibits tumor growth and affects microvascular architecture and function in Colo205 tumor xenografts[J]. Int J Oncol, 2011,38(1):71-80.
[3] Mattheakis LC, Bhatt RR, Dower WJ, et al. An in vitro ploysome display system for identifying ligands from very large peptide libraries[J]. Proc Natl Acad Sci USA, 1994,91(19):9022-9026.
[4] Yan X, Xu Z. Ribosome-display technology: applications for directed evolution of functional proteins[J]. Drug Discovery Today, 2006,11(19-20):911-916.
[5] Gebauer M, Skerra A. Engineered protein scaffolds as next-generation antibody therapeutics[J]. Curr Opin Chem Biol, 2009,13(3):245-255.
[6] Beck A, Wurch T, Bailly C, et al. Strategies and challenges for the next generation of therapeutic antibodies[J]. Nat Rev Immunol, 2010,10(5):345-352.
[7] Koide A, Bailey CW, Huang X, et al. The fibronectin type Ⅲ domain as a scaffold for novel binding proteins[J]. J Mol Biol, 1998,284(4):1141-1151.
[8] Batori V, Koide A, Koide S. Exploring the potential of the monobody scaffold: effects of loop elongation on the stability of a fibronectin type Ⅲ domain[J]. Protein Eng, 2002,15(12):1015-1020.
[9] Bloom L and Calabro V. FN3: a new protein scaffold reaches the clinic[J]. Drug Discov Today, 2009,14(19-20):949-955.
[10]Lipovsek D. Adnectins: engineered target-binding protein therapeutics[J]. Protein Eng Des Sel, 2011,24(1-2):3-9.
[11] Xu L, Aha P, Gu K, et al. Directed evolution of high-affinity antibody mimics using mRNA display[J]. Chem Biol, 2002,9(8):933-942.
[12] Hackel BJ, Wittrup KD. The full amino acid repertoire is superior to serine/tyrosine for selection of high affinity immunoglobulin G binders from the fibronectin scaffold[J]. Protein Eng Des Sel, 2010,23(4):211-219.
[13] Lipovsek D, Lippow SM, Hackel BJ, et al. Evolution of an interloop disulfide bond in high-affinity antibody mimics based on fibronectin type Ⅲ domain and selected by yeast surface display: molecular convergence with single-domain camelid and shark antibodies[J]. J Mol Biol, 2007,368(4):1024-1041.
[14] Liao HI, Olson CA, Hwang S, et al. mRNA display design of fibronectin-based intrabodies that detect and inhibit severe acute respiratory syndrome coronavirus nucleocapsid protein[J]. J Biol Chem, 2009,284(26):17512-17520.
[15] Hackel BJ, Ackerman ME, Howland SW, et al. Stability and CDR composition biases enrich binder functionality landscapes[J]. J Mol Biol, 2010,401(1):84-96.
[16] Getmanova EV, Chen Y, Bloom L, et al. Antagonists to human and mouse vascular endothelial growth factor receptor 2 generated by directed protein evolution in vitro[J]. Chem Biol, 2006,13(5):549-556.
[17] Dineen SP, Sullivan LA, Beck AW, et al. The Adnectin CT-322 is a novel VEGF receptor 2 inhibitor that decreases tumor burden in an orthotopic mouse model of pancreatic cancer[J]. BMC Cancer, 2008,8:352.
[18] Molckovsky A, Siu LL. First-in-class, first-in-human phase I results of targeted agents: highlights of the 2008 American society of clinical oncology meeting[J]. J Hematol Oncol, 2008,1:20.
[19] Ackermann M, Carvajal IM, Morse BA, et al. Adnectin CT-322 inhibits tumor growth and affects microvascular architecture and function in Colo205 tumor xenografts[J]. Int J Oncol, 2011,38(1):71-80.
Construction semi-random Adnectin ribosome display library by PCR amplification
and gene synthesis
GUOYong-hong,WENJiao,WANGJun-hong
(TheSecondAffiliatedHospitalofXi′anJiaotongUniversity,Xi′an710004,China)
Abstract:ObjectiveTo construct semi-random Adnectin ribosome display library. MethodsAdnectin ribosome display library was constructed by PCR amplification combining with gene synthesis method. PCR products contained the restrictive sites of SpeⅠbased on nonsense mutation. The recombinant plasmids were identified by restriction endonuclease enzyme analysis and DNA sequence. The positive recombinant clones were screened and library capacity was measured by blue-white test. ResultThe library was confirmed by sequencing and library capacity was 1.54×1013/mL. ConclusionsTo corstruct successful Adnectin semi-random ribosomes display library (mRNA) used simple and easy method. The built library laid the foundation for Adnectin affinity with various related protein.
Key words:Adnectin; PCR amplification; gene synthesis; ribosomes display library
(收稿日期:2014-09-24)
中图分类号:Q784
文献标志码:A
文章编号:1002-266X(2015)04-0004-04
doi:10.3969/j.issn.1002-266X.2015.04.002
通信作者简介:王俊红(1970-),男,硕士,副主任医师,研究方向为基因治疗机制。E-mail: jhwangdoctor@sohu.com
作者简介:第一郭永红(1971-),女,博士,副主任医师,研究方向为肝硬化及肝癌的分子机制。E-mail: xiaoqing9759@sina.com
基金项目:国家自然科学基金青年科学基金项目(81100300)。
