冰片-葛根素脂质体的制备及其脑靶向性研究Δ
2015-03-09刘薇芝胡汉昆武汉大学中南医院药学部武汉430071
刘薇芝,胡汉昆,刘 萍,刘 巍,郑 艳(武汉大学中南医院药学部,武汉 430071)
血脑屏障的特殊结构,使大多数治疗脑部疾病的药物难以进入脑组织。冰片为芳香开窍药,研究表明,其能使血脑屏障生理性开放,增加血脑屏障通透性,促进药物透过血脑屏障进入脑组织[1-3]。葛根素是从中药葛根中提取的一种黄酮类化合物,葛根素注射液临床应用广泛,常用于治疗脑血管疾病[4]。然而吴燕红等[5]通过对葛根素注射液的药动学和组织分布研究发现,葛根素注射液给药后,主要分布在肝、肾、脾、肌肉、肺和生殖器官中,而在脑部分布较少。这使得药物的治疗作用不能充分发挥,增加了葛根素不良反应的发生几率,限制了药物的临床应用。本研究拟制备冰片-葛根素脂质体,考察其能否促进药物透过血脑屏障,增加脑部药物浓度,从而为构建有效的脑部药物递送系统提供参考。
1 材料
1.1 仪器
1100型高效液相色谱仪(美国Agilent公司);TEM 100CXⅡ型透射电子显微镜(日本Jeol 公司);Zetasizer3000HS 型激光粒度分析仪(英国Malvern 公司);GS-15R 型高速冷冻离心机(美国Beckman公司)。
1.2 药品与试剂
葛根素注射液(山东益健药业有限公司,批号:20130806,规格:2 ml∶100 mg);葛根素原料药(康恩贝制药股份公司,批号:20100608,纯度:>98%);葛根素对照品(中国食品药品检定研究院,批号:110752-201109,供含量测定用);冰片(上海邦成化工有限公司,批号:20121105,纯度:93%);大豆卵磷脂、胆固醇(国药集团化学试剂有限公司);Sephadex-G50 葡聚糖(美国Pharmacia 公司);甲醇为色谱纯,其余试剂均为分析纯。
1.3 动物
昆明种小白鼠,SPF级,♂,体质量(20±2)g,购自武汉大学实验动物中心,许可证号:SCXK(鄂)2008-0004。本实验经武汉大学中南医院医学伦理委员会批准。
2 方法与结果
2.1 脂质体的制备
采用薄膜分散超声法,称取处方量的卵磷脂500 mg、胆固醇100 mg、葛根素50 mg、冰片5 mg、维生素E 适量,加入无水乙醇溶解,在40 ℃恒温水浴下减压蒸发成薄膜,加入20 ml的pH 7.0的磷酸盐缓冲液(PBS)将薄膜洗脱分散,通氮气条件下温和水化2 h,于探头超声冰水浴下300 W 分散10 min,0.45 μm 微孔滤膜过滤,整粒3 次制得冰片-葛根素脂质体,得混悬液。同法不加冰片制得葛根素脂质体。
2.2 脂质体表征考察
取“2.1”项下脂质体混悬液适量,将稀释后的脂质体溶液点样于铜网上,用2%的磷钨酸负染,滤纸吸干染液后,用透射电子显微镜观察并拍照,用激光粒度仪测定稀释后脂质体的粒径和Zeta 电位。结果显示,所制备的冰片-葛根素脂质体轮廓清晰,呈圆形或类圆形,粒径为226 nm,多分散指数(PDI)为0.263,Zeta 电位为-21.3 mV。冰片-葛根素脂质体的透射电镜图见图1;粒径分布图见图2。

图1 冰片-葛根素脂质体的透射电镜图(×29 000)Fig 1 TEM of borneol-puerarin liposomes(×29 000)

图2 冰片-葛根素脂质体的粒径分布图Fig 2 Particle size distribution of borneol-puerarin liposomes
2.3 包封率测定
2.3.1 色谱条件[6]色谱柱:Zorbax SB-C18(250 mm×4.6 mm,5μm);流动相:甲醇-0.5%磷酸水溶液(30∶70,V/V),流速:1 ml/min;检测波长:250 nm;柱温:30 ℃;进样量:10 μl。
2.3.2 葡聚糖凝胶过滤法测定包封率 精密移取冰片-葛根素脂质体0.5 ml,上预先处理好的Sephadex-G50 凝胶柱,用pH 7.0 的PBS 以1 ml/min 的流速在室温下洗脱,合并所有镜检含脂质体的流分,以甲醇破膜并定容于25 ml,混匀,取10 μl进样测定药物浓度c1。另取0.5 ml 冰片-葛根素脂质体不过Sephadex-G50凝胶柱,以甲醇破膜并定容于25 ml,混匀,取10 μl进样测定药物浓度c2。按公式(包封率=c1/c2×100%)计算所制备的3批脂质体的包封率,结果平均包封率为(65.32±2.13)%。
2.4 冰片-葛根素脂质体的脑组织分布研究
2.4.1 分组、给药与取样 取小鼠63只,禁食12 h,自由饮水,随机分为3组,每组21只,分别按葛根素30 mg/kg(按人临床常用剂量换算)单剂量尾iv 葛根素注射液、葛根素脂质体混悬液、冰片-葛根素脂质体混悬液。于给药后5、10、15、30、60、90、120 min时脱臼处死小鼠,取脑组织,用生理盐水洗净,滤纸吸干,称质量后在-20 ℃冷冻,待匀浆用。
2.4.2 样品预处理 将脑组织用电动匀浆器制成1∶3(g/ml)的生理盐水匀浆液,取1 ml 匀浆液于离心半径5 cm(下同)、10 000 r/min 离心10 min。精密吸取上清液0.2 ml 置于1.5 ml离心管中,加入0.2 ml 6%的高氯酸水溶液沉淀蛋白质,涡旋混合2 min,10 000 r/min离心5 min,取上清液,用0.45µm微孔滤膜过滤,取滤液20 μl进样测定。
2.4.3 色谱条件 色谱柱:Zorbax SB-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水溶液(30∶70,V/V),流速:1 ml/min;检测波长:250 nm;柱温:30 ℃;进样量:20 μl。
2.4.4 方法专属性 取葛根素对照品溶液、空白脑组织和给予冰片-葛根素脂质体混悬液后5 min的脑组织样品,脑组织按“2.4.2”项下方法进行预处理,然后进样测定,记录色谱。结果表明,空白脑组织中内源性杂质对葛根素的测定无干扰,样品中葛根素的保留时间约为11.53 min,可实现有效分离。色谱图见图3。

图3 高效液相色谱图A.葛根素对照品;B.空白脑组织样品;C.脑组织样品;1.葛根素Fig 3 HPLC chromatogramsA.puerarin control;B.blank brain tissue sample;C.brain tissue sample;1.puerarin
2.4.5 线性范围考察 精密吸取小鼠脑组织匀浆液各200µl,加入葛根素对照品溶液,制备成质量浓度分别为0.045、0.225、0.45、0.90、1.80 µg/ml 的匀浆样品,按“2.4.2”项下方法预处理后进样测定。以葛根素的质量浓度(x)对峰面积(y)进行回归分析,得回归方程为y=667.32x+50.12(r=0.996 3)。结果,葛根素检测质量浓度的线性范围为0.045~1.80µg/ml,检测限为0.032µg/ml(信噪比为3)。
2.4.6 回收率与精密度试验 按“2.4.5”项下方法制备葛根素质量浓度为0.045、0.90、1.80µg/ml的脑组织匀浆样品,每个浓度3个样本,按“2.4.2”项下方法预处理后进样测定;同时取相应质量浓度未经处理的葛根素对照品溶液分别进样测定。以脑组织匀浆样品和葛根素对照品溶液测得的峰面积之比计算提取回收率。脑组织匀浆样品同日内测定6次,考察日内精密度;连续测定6 d,考察日间精密度。结果,低、中、高浓度脑组织匀浆样品的提取回收率分别为(88.23±5.43)%、(91.25±3.76)%、(92.45±3.12)%,RSD 分别为6.15%、4.12%、2.88%(n=3);日内RSD 分别为5.75%、3.23%、1.81%(n=6),日间RSD分别为6.65%、4.12%、2.31%(n=6)。
2.4.7 稳定性试验 取葛根素质量浓度为0.045、0.90、1.80µg/ml的脑组织匀浆样品,分别考察室温24 h、冻融3 次以及保存1个月的稳定性。结果,室温24 h、冻融3 次以及保存1个月后测得样品含量的RSD分别为2.74%、5.84%、3.88%(n=3),表明上述条件下样品稳定。
2.5 脑内分布考察
2.5.1 药动学研究 根据各组小鼠脑组织匀浆中葛根素的含量,采用3p97药动学软件统计矩法处理实验数据,计算药动学参数。各组小鼠脑组织中葛根素含量的测定结果见图4,药动学参数见表1。
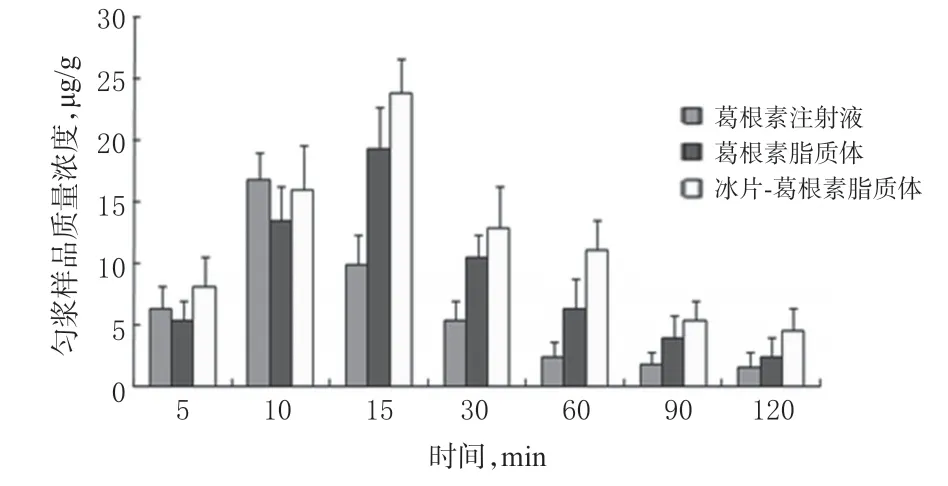
图4 各组小鼠脑组织中葛根素质量浓度的测定结果(n=3)Fig 4 Content determination results of puerarin in brain tissue of mice in each group(n=3)
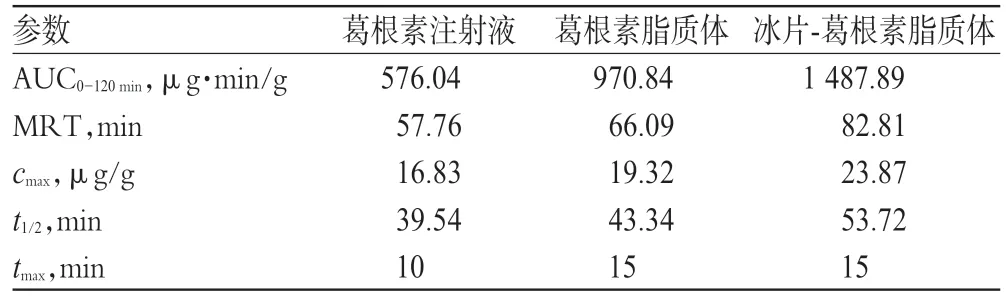
表1 3种样品在小鼠脑组织中的药动学参数(n=3)Tab 1 The pharmacokinetic parameters of 3 kinds of samples in brain tissue of mice(n=3)
从图4 可知,给药10 min 后葛根素注射液组脑中药物达到最大质量浓度16.83µg/g,葛根素脂质体组和冰片-葛根素脂质体组给药15 min 后达到最大质量浓度19.32 µg/g 和23.87µg/g。3种样品中,冰片-葛根素脂质体组的cmax最高,与葛根素注射液组、葛根素脂质体组比较差异有统计学意义(P<0.01或P<0.05)。从表1可知,冰片-葛根素脂质体组的AUC0-120min为1 487.89µg·min/g,是葛根素脂质体组的1.53 倍,是葛根素注射液组的2.58 倍。冰片-葛根素脂质体组的tmax均大于其他组,表明冰片-葛根素脂质体组中药物透过血脑屏障进入脑组织的浓度最高、摄取量最大。
平均滞留时间(MRT)反映了药物在体内的作用时间。本研究显示,冰片-葛根素脂质体组MRT(82.81 min)>葛根素脂质体组(66.09 min)>葛根素注射液组(57.76 min),表明冰片-葛根素脂质体组中药物在脑内的滞留时间最长,可更有效地延长药物在体内的作用时间。从t1/2也可看出,冰片-葛根素脂质体组的代谢时间延长。综上所述,与其他两组比较,冰片-葛根素脂质体中葛根素在脑内的摄取量更大且作用时间更长。
2.5.2 脑靶向性初步研究 采用相对摄取率(Re)和峰浓度比(ce)对冰片-葛根素脂质体的脑靶向性进行初步研究。
Re=(AUCi)C/(AUCi)S[2,7],式中,AUCi是由浓度-时间曲线算得的第i个器官或组织的药时曲线下面积,脚标C 和S 分别表示受试组和参比组。Re>1表示与参比组比较,受试组药物在该器官或组织有相应靶向性,Re愈大靶向效果愈好;Re<1表示无靶向性。
ce=(cp)C/(cp)S[2,8],式中,cp为组织中药物峰值,脚标C 和S分别表示受试组和参比组。ce值愈大,表明改变药物分布的效果愈明显。
根据表1 中药动学参数,计算Re和ce值。结果,以葛根素注射液组为参比组,葛根素脂质体组和冰片-葛根素脂质体组的Re分别为1.68、2.58,ce分别为1.15、1.42,表明相比注射液,脂质体作为载体,具有一定的脑趋向性。与葛根素脂质体组比较,冰片-葛根素脂质体组的Re更大,这可能与冰片修饰脂质体后,冰片发挥了“芳香开窍、引药上行”的功效,提高了血脑屏障通透性,从而进一步增加药物的摄取量有关。这与吴红兵等[3]研究结果类似。从ce结果可以看出,经过冰片修饰的脂质体在改善药物的组织分布方面也更有优势。
3 讨论
本研究曾采用乙醇注入法、逆向蒸发法、薄膜分散法等多种方法制备脂质体,以脂质体的粒径、包封率、载药量等指标进行考察发现,采用乙醇注入法制备的脂质体粒径偏大,而逆向蒸发法制备的脂质体包封率偏低。经过反复试验,最终采用薄膜分散超声法制备脂质体。
本研究表明,采用脂质体包裹葛根素,可提高药物在脑组织中的cmax,提高药物摄取率。而采用冰片修饰的脂质体,与普通脂质体比较,药物摄取量增加,MRT 更长,可更有效地改善药物的脑组织分布,更有利于药效的发挥。脂质体中合用冰片后,影响药物在脑部分布的作用机制是什么?与血脑屏障的生理性开放是否相关?本研究下一步将采用小鼠脑毛细血管内皮细胞为模型,进一步考察冰片脂质体对血脑屏障的促渗作用及开放机制。
[1]吴雪,欧阳丽娜,向大位,等.冰片及石菖蒲促进羟基红花黄色素A 透过血脑屏障的实验研究[J].中草药,2011,42(4):734.
[2]吴寿荣,程刚,贺云霞,等.冰片对利福平在小鼠体内分布的影响[J].中国药学杂志,2004,39(4):289.
[3]吴红兵,王绍宁,石莉,等.冰片对齐多夫定棕榈酸酯脂质体在小鼠体内分布的影响[J].中国药学杂志,2009,44(8):590.
[4]杨杰忠.葛根素的临床应用进展[J].中国医药指南,2012,10(21):465.
[5]吴燕红,苏子仁,陈建南,等.从小鼠体内血药浓度时间曲线与组织分布特征评价葛根素的给药途径[J].中药新药与临床药理,2005,16(2):112.
[6]刘薇芝,胡汉昆,刘萍,等.HPLC 法测定冰片-葛根素脂质体中葛根素的含量和包封率[J].中国药师,2014,17(1):16.
[7]吴红兵,邓意辉,王绍宁,等.齐多夫定棕榈酸酯半乳糖化脂质体在小鼠体内的分布[J].药学学报,2007,42(5):538.
[8]顾晓华,秋泽文,徐红,等.齐墩果酸/PLGA-TPGS纳米粒在小鼠体内的分布及肝靶向性研究[J].中国药房,2012,23(33):3 086.
