miR-20b对大肠癌细胞增殖和凋亡的影响及其机制的研究
2015-03-02吴巍芸
吴巍芸 周 宇
作者单位:524001 广东医学院附属医院消化内科
miR-20b对大肠癌细胞增殖和凋亡的影响及其机制的研究
吴巍芸周宇
作者单位:524001 广东医学院附属医院消化内科
【摘要】目的探讨miR-20b对大肠癌(CRC)细胞增殖凋亡的影响及机制。方法将miR-20b模拟物转染CRC细胞株HCT-116,qRT-PCR检测转染后miR-20b的表达,分别应用CCK-8实验及流式细胞仪检测转染后细胞增殖和凋亡情况。qRT-PCR和western blot检测转染后Bcl-w mRNA和蛋白的表达情况。结果转染miR-20b 模拟物后,HCT-116细胞中miR-20b表达水平明显上调,HCT-116细胞增殖减弱(P<0.05),凋亡增强(P<0.05)。miR-20b可作用于Bcl-w mRNA 的3′-UTR,使海肾荧光素酶活性显著降低。转染后Bcl-w mRNA及蛋白表达水平明显下调,差异均有统计学意义(P<0.05)。结论上调HCT-116细胞中miR-20b表达水平,可抑制其靶基因Bcl-w的表达,发挥抑制细胞增殖、增加凋亡的作用。
【关键词】微小RNA;大肠癌;Bcl-w;增殖;凋亡
(ThePracticalJournalofCancer,2015,30:0020~0024)
大肠癌(colorectal cancer,CRC)的发生、发展是多因素参与的过程。原癌基因和抑癌基因的异常表达及其编码蛋白功能的改变可影响肿瘤发生的多个方面,包括细胞的增殖、侵袭、转移、血管生成、耐药以及维持遗传基因稳定等[1]。微小RNA (microRNA,miRNA,miR)是一类非编码单链小分子RNA,其与靶基因mRNA的3'非编码末端(3'-UTR)完全和部分互补性结合,从而引起靶mRNA的降解或者阻遏其转录后翻译,与肿瘤[2]、心血管疾病[3]、炎症[4]等病理生理过程相关。多个研究发现,与正常大肠组织相比,CRC存在多种miRNA表达异常[5-7]。其中基因芯片检测显示miR-20b在CRC组织中表达明显下调[5],本实验通过分析miR-20b对CRC细胞的增殖、凋亡的影响及对其潜在靶基因Bcl-w的调控,探讨miR-20b在CRC发生发展中的作用。
1材料与方法
1.1主要材料及试剂
人大肠癌细胞株HCT-116购自中国科学院典型培养物保藏委员会细胞库。转染试剂lipofectamineTM2000(lipo2000)购自美国Invitrogen公司,Opti-MEM I培养基、RPMI1640培养基、胎牛血清购自美国Gibco公司。人miR-20b 模拟物(mimics)、miRNA-20b mimics阴性对照(miR-20b mimics-NC)购自广州锐博生物科技有限公司。CCK-8试剂盒购自上海Dojindo公司。Annexin V-FITC细胞凋亡检测试剂盒、小鼠抗人β-actin抗体、辣根过氧化物酶(HRP)标记的羊抗兔或羊抗小鼠IgG、超敏ECL化学发光试剂盒购自碧云天生物技术有限公司。兔抗人Bcl-w抗体购自美国Santa Cruz公司。 RNAiso Plus、One Step PrimeScript(R)miRNA cDNA Synthesis Kit、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBR(R)Premix Ex TaqTMⅡ (Tli RNaseH Plus)均购自大连Takara公司。TIANGEN高纯度质粒小提中量试剂盒购自天根生化科技有限公司。双荧光素酶报告系统检测试剂盒购自Promega公司。miR-20b、U6、Bcl-w、β-actin引物由上海生工生物工程公司合成。
1.2细胞培养和转染
HCT-116细胞用含10%胎牛血清,100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液,置于37 ℃、含5% CO2的培养箱中常规培养。将HCT-116细胞接种至6孔板,继续培养24 h待细胞长至60%左右融合时转染。实验分为2组:①miR-20b mimics转染组:使用lipo2000将miR-20b mimics(终浓度100 nmol/L)转染入细胞;②NC组:使用lipo2000将miR-20b mimics-NC(终浓度100 nmol/L)转染入细胞。
1.3实时荧光定量RT-PCR(qRT-PCR)检测转染后miR-20b的表达
各组细胞转染48 h后,用RNAiso Plus提取总RNA。PrimeScript(R)miRNA cDNA Synthesis Kit试剂盒进行miRNA逆转录。所得cDNA再使用试剂盒进行PCR反应。miR-20b以U6作为内参。反应条件为:95℃预变性30 s,95℃变性5 s,60℃退火延伸20 s,扩增40个循环。qRT-PCR引物序列如下:miR-20b 上游引物,5′-CAAAGTGCTCATAGTGCAGGTAG-3′;U6上游引物,5′-CTCGCTTCGGCAGCACA-3′;miRNA下游引物Uni-miR、qPCR、Primer包含在逆转录试剂盒中。每个反应设3个复孔,miR-20b的相对表达量用2-△Ct法计算。
1.4CCK-8法检测miR-20b mimics转染后细胞增殖情况
将HCT-116细胞接种于96孔细胞培养板,按上述分组转染,分别培养24 h、48 h、72 h、96 h后,每孔更换新鲜培养基200 μl,再加20 μL CCK-8溶液。培养板在培养箱内孵育2 h。用酶标仪测定在450 nm处的吸光度。记录结果,以时间为横坐标,吸光度为纵坐标绘制细胞生长曲线。
1.5流式细胞仪检测miR-20b mimics转染后细胞凋亡情况
HCT-116细胞接种于12孔细胞培养板,按上述分组转染,继续培养72 h,胰酶消化、收集细胞,PBS洗涤1次,离心后加入Annexin V-FITC室温避光孵育10 min。离心后弃上清,加入碘化丙啶(PI)染色液,冰浴避光放置30 min。进行流式细胞仪检测。
1.6双荧光素酶报告基因检测
通过TargetScan Human 6.2(http://www.targetscan.org/)、microRNA.org(http://www.microrna.org)等常用的生物信息学网站,预测miR-20b的潜在靶基因及其结合位点。PCR扩增包含miR-20b结合位点在内的Bcl-w 3′-UTR序列。将目的序列与双荧光素酶报告基因载体连接后的质粒转化入DH5α感受态细胞中,扩增,应用TIANGEN高纯度质粒小提中量试剂盒提取质粒。将含预测结合位点的Bcl-w 3′-UTR序列的质粒命名为pmiR-Bcl-w-wt,含Bcl-w 3′-UTR突变序列的质粒命名为pmiR-Bcl-w-mut。将pmiR-Bcl-w-wt或pmiR-Bcl-w-mut分别与miR-20b mimics或miR-20b mimics-NC共转染HCT-116细胞。培养48 h后,检测各组海肾及萤火虫荧光素酶活性,两者比值进行统计学分析。
1.7qRT-PCR检测miR-20b mimics转染后Bcl-w mRNA的表达
各组细胞转染48 h后,用RNAiso Plus提取总RNA。使用PrimeScript(R)RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒进行mRNA逆转录。反应所得的cDNA再使用SYBR(R)Premix Ex TaqTMⅡ (Tli RNaseH Plus)试剂盒进行PCR反应。以β-actin作为内参。反应条件为:95℃预变性30 s,95℃变性5 s,60℃退火延伸20 s,扩增40个循环。引物序列如下:Bcl-w上游引物,5′-TTCACCCTACCCTCTACCA-3′;Bcl-w下游引物,5'-AGCCCTTTACCCTTTCAG-3';β-actin上游引物,5′-GGCGGCA-ACACCATGTACCCT-3′;β-actin下游引物,5′-AGGGGCCGGACTCGTCATACT-3′。
1.8Western blot检测miR-20b mimics转染后Bcl-w蛋白的表达
用细胞裂解液裂解细胞并提取细胞总蛋白,BCA法进行蛋白定量后,SDS-PAGE电泳分离总蛋白,电转移到PVDF膜上,5%脱脂牛奶封闭1 h后,抗Bcl-w抗体(1∶800)及抗β-actin抗体(1∶1000)4℃孵育过夜。TBST洗膜后,加入HRP标记的羊抗兔或羊抗小鼠二抗(1∶1000)室温孵育1 h,用ECL发光液显影,X光压片曝光。应用Quantity One软件对条带进行分析。
1.9统计学处理
应用SPSS 19.0统计软件进行统计学处理。数据以均值±标准差表示,三组间比较采用单因素方差分析,两组间比较采用两个独立样本t检验。
2结果
2.1miR-20b mimics转染后细胞miR-20b表达上调
qRT-PCR结果显示,与miR-20b mimics-NC转染组比较,miR-20b mimics转染组miR-20b表达水平明显上调,差异具有统计学意义(P<0.05)(图1)。
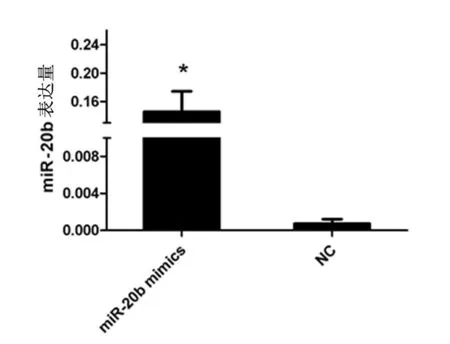
图1 CRC细胞转染后各组miR-20b的表达情况
2.2过表达miR-20b抑制HCT-116细胞增殖
转染miR-20b mimics至HCT-116细胞,分别培养24 h、48 h、72 h、96 h后,CCK-8检测细胞增殖情况。由图2可见,培养48 h、72 h、96 h时,miR-20b mimics转染组在450 nm处的吸光度较相应的NC组明显下降,差异有统计学意义(P<0.05)。
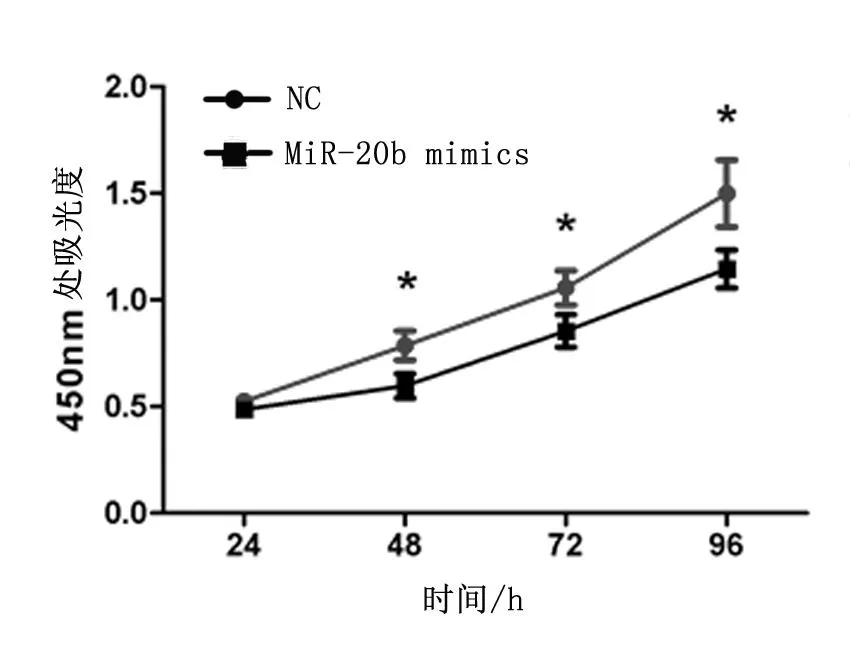
图2 CCK-8法检测两组细胞增殖情况
2.3过表达miR-20b促进HCT-116细胞凋亡
转染miR-20b mimics至HCT-116细胞,培养72 h后应用流式细胞仪检测。miR-20b mimics转染组Annexin V-FITC单阳性细胞较NC组明显增加,差异有统计学意义(P<0.05)(图3)。
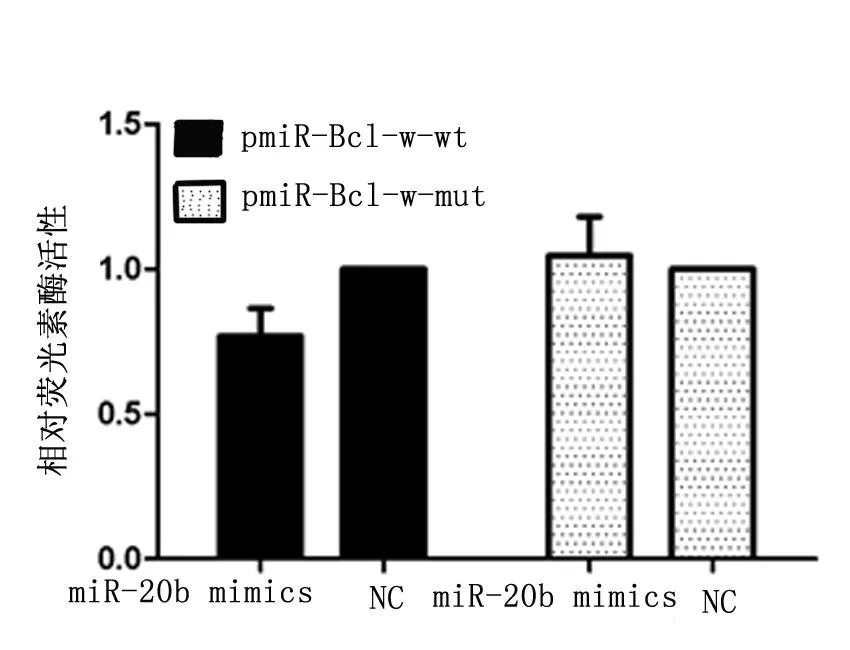
2.4双荧光素酶报告基因检测
在转染pmiR-Bcl-w-wt质粒的实验中,miR-20b mimics组与NC组相比较,海肾/萤火虫荧光素酶活性下降,两组比较差异有统计学意义(P<0.05)。在转染pmiR-Bcl-w-mut质粒的实验中,miR-20b mimics组与NC组相比较,海肾/萤火虫荧光素酶活性无明显变化(P>0.05)(图4)。
2.5miR-20b mimics转染后HCT-116细胞中Bcl-w表达水平下调
qRT-PCR检测结果显示,与转染miR-20b mimics-NC组比较,miR-20b mimics转染组细胞Bcl-w mRNA的表达水平明显下调,差异有统计学意义(P<0.05)(图5A)。Western blot检测结果显示,与转染miR-20b mimics-NC组比较,miR-20b mimics转染组细胞Bcl-w蛋白的表达水平明显下调,差异有统计学意义(P<0.05)(图5B和5C)。
3讨论
miRNA是近年来发现的一类具有重要调控作用的非编码小分子RNA。研究发现,多种人类肿瘤,包括CRC,都伴有miRNA的表达异常。miRNA通过靶基因的调控,对肿瘤细胞生物学行为产生影响,在肿瘤的发生、发展过程起作用。Yu等[8]发现,miR-208在人CRC组织中较正常组织表达下降,并与TNM分期、淋巴结转移、肿瘤分化程度相关,表达低的患者比表达高的患者生存时间更短,说明在大肠癌中miRNA的异常表达与肿瘤的特性和患者的预后相关。miR-154在CRC组织和细胞系中表达降低,过表达miR-154通过作用于其靶基因toll样受体2(TLR2),抑制CRC细胞增殖、克隆形成、侵袭、转移等,发挥抑癌作用[9]。miR-20b与肿瘤的关系也有少量研究。有研究发现,miR-20b在缺氧的微环境下可以降低乳腺癌细胞的血管内皮生长因子表达[10]。基因芯片结果也显示,miR-20b在CRC组织较正常大肠组织表达下调[5],但miR-20b如何影响大肠癌的发生、发展呢?本研究发现,转染miR-20b mimics至HCT-116细胞后,大肠癌细胞HCT-116的miR-20b表达上调,同时细胞增殖明显受抑,而细胞凋亡率增高,提示miR-20b与CRC细胞的增殖密切相关。

图3 两组细胞凋亡图
以NC组为1,mimics组表示为NC组的倍数。
Bcl-w是 Bcl-2家族抗凋亡成员之一,过表达Bcl-w使细胞凋亡减少。Bcl-w与CRC形成和进展密切相关[11]。在CRC组织中,Bcl-w表达率显著升高,且与TNM分期和淋巴结转移有关,提示Bcl-w与CRC的进展有关[12]。张隽等[13]也发现,Bcl-w在大肠腺瘤组织中不表达,而在CRC表达明显增高,且随肿瘤浸润深度增加和淋巴转移和肝转移的发生,Bcl-w表达亦增加,同时Bcl-w表达阳性CRC患者预后差,也支持上述Bcl-w与CRC的进展有关的观点。我们通过生物信息学预测发现Bcl-w是miR-20b潜在的靶基因之一,并进一步通过双荧光素酶报告基因证实miR-20b能与Bcl-w的3′-UTR结合。转染miR-20b mimics后,Bcl-w mRNA和蛋白的表达水平均下调,与对照组比较,差异有显著性,说明在CRC细胞中,miR-20b通过与Bcl-w的3'-UTR结合,调控Bcl-w的表达,进而影响细胞的增殖和凋亡。
综上所述,miR-20b在CRC的发生发展中起一定作用,为CRC预防及治疗提供新的靶标。但是miRNA的调控机制复杂,一个miRNA不止一个靶基因,因此miR-20b在CRC的功能仍有广阔的研究前景。

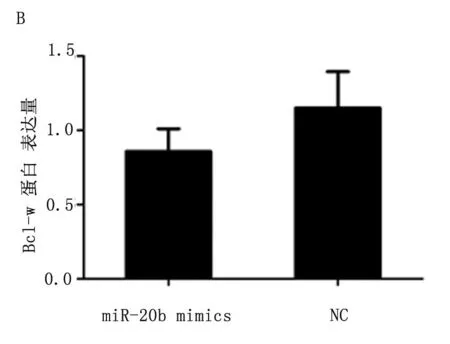

A为两组Bcl-w mRNA表达情况,B为两组Bcl-w蛋白表达情况,C为Western blot检测两组Bcl-w蛋白表达情况。
图5miR-20b对HCT-116细胞Bcl-w表达的影响
参考文献
[1]Harris TJ,McCormick F.The molecular pathology of cancer〔J〕.Nat Rev Clin Oncol,2010,7(5):251-265.
[2]Kristen MN,Glen JW.MicroRNAs and cancer:past,present,and potential future〔J〕.Mol Cancer Ther,2008,7(12):3655-3660.
[3]Divakaran V,Mann DL.The emerging role of microRNAs in cardiac remodeling and heart failure〔J〕.Circ Res,2008,103(10):1072-1083.
[4]Abou-Zeid A,Saad M,Soliman E.MicroRNA 146a expression in rheumatoid arthritis:association with tumor necrosis factor-alpha and disease activity〔J〕.Genet Test Mol Biomarkers,2011,15(11):807-812.
[5]Sarver AL,French AJ,Borralho PM,et al.Human colon cancer profiles show differential microRNA expression depending on mismatch repair status and are characteristic of undifferentiated proliferative states〔J〕.BMC Cancer,2009,9:401
[6]Wu WK,Law PT,Lee CW,et al.MicroRNA in colorectal cancer:from benchtop to bedside〔J〕.Carcinogenesis,2011,32(3):247-253.
[7]Bandrés E,Cubedo E,Agirre X,et al.Identification by Real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues〔J〕.Mol Cancer,2006,5:29.
[8]Yu H,Gao G,Jiang L,et al.Decreased expression of miR-218 is associated with poor prognosis in patients with colorectal cancer〔J〕.Int J Clin Exp Pathol,2013,6(12):2904-2911.
[9]Xin C,Zhang H,Liu Z.miR-154 suppresses colorectal cancer cell growth and motility by targeting TLR2〔J〕.Mol Cell Biochem,2014,387(1-2):271-277.
[10]Cascio S,D'Andrea A,Ferla R,et al.miR-20b modulates VEGF expression by targeting HIF-1 alpha and STAT3 in MCF-7 breast cancer cells〔J〕.J Cell Physiol,2010,224(1):242-249.
[11]Kitamura S,Kondo S,Shinomura Y,et al.Met/HGF receptor modulates bcl-w expression and inhibits apoptosis in human colorectal cancers〔J〕.Br J Cancer,2000,83(5):668-673.
[12]Wilson JW,Nostro MC,Balzi M,et al.Bcl-w expression in colorectal adenocarcinoma〔J〕.Br J Cancer,2000,82(1):178-185.
[13]张隽,乔岐禄,赵建勋,等.Bcl-w在大肠癌中的表达及临床意义〔J〕.中国现代医学杂志,2007,17(12):1413-1417.
(编辑:吴小红)
Effect of MiR-20b on Proliferation and Apoptosis of Colorectal Cancer Cells and Its Mechanism
WUWeiyun,ZHOUYu.DepartmentofGastroenterology,AffiliatedHospitalofGuangdongMedicalCollege,Zhanjiang,524001
【Abstract】Objective To explore the effect and mechanism of on proliferation and apoptosis of colorectal cancer cells.MethodsAfter transfection of miR-20b mimics into HCT-116 cells,the expression of miR-20b was evaluated by real-time quantitative reverse transcriptase-polymerase chain reaction (qRT-PCR),and effect of miR-20b on cell proliferation and apoptosis was determined by CCK-8 assay and flow cytometry,respectively.Bcl-w mRNA and protein was measured by qRT-PCR and western blot.ResultsMiR-20b mimics transfection significantly increased miR-20b expression in HCT-116 cells,inhibited cells proliferation and increased cells apoptosis (P<0.05).MiR-20b could effect on 3′-untranslated region (3′-UTR) of Bcl-w mRNA and decrease renilla luciferase activity.MiR-20b mimics significantly suppressed Bcl-w mRNA and protein level in CRC cells (P<0.05).ConclusionOverexpression of miR-20b in HCT-116 cells may suppress cells proliferation and increase cells apoptosis,probably by downregulating its target gene Bcl-w expression.
【Key words】MicroRNA;Colorectal cancer;Bcl-w;Proliferation;Apoptosis
(收稿日期2014-04-29修回日期 2014-09-30)
中图分类号:R735.3+4
文献标识码:A
文章编号:1001-5930(2015)01-0020-05
DOI:10.3969/j.issn.1001-5930.2015.01.006
通讯作者:周宇
