抗氧化剂对慢性胰腺炎大鼠胰腺纤维化的影响
2015-02-27朱颖孙蕴伟章永平袁耀宗别里克
朱颖 孙蕴伟 章永平 袁耀宗 别里克
·论著·
抗氧化剂对慢性胰腺炎大鼠胰腺纤维化的影响
朱颖 孙蕴伟 章永平 袁耀宗 别里克
目的观察外源性给予四氢吡咯二硫代氨基甲酸盐(PDTC)等氧化剂对慢性胰腺炎(CP)大鼠胰腺纤维化的影响,并探讨其机制。方法 按完全随机法将大鼠分为对照组、CP组、PDTC治疗组、维生素E(Vit E)治疗组、维生素C(Vit C)治疗组。采用腹腔内注射二乙基二硫代氨基甲酸盐(DETC) 750 mg/kg体质量、每周2次的方法制备CP模型。对照组不做任何处理。各治疗组在注射DETC后30 min腹腔内分别注射PDTC 100 mg/kg体质量、Vit E 15 mg/kg体质量、Vit C 15 mg/kg体质量。注射DETC后90 min,24、48、72 h,2、3、4、6周时分批处死大鼠。取胰腺组织行常规病理检查,采用分光光度比值法检测胰腺组织超氧化物歧化酶(SOD)、丙二醛(GSH-PX)和谷胱甘肽过氧化物酶(MDA)活性,免疫组化法检测α-平滑肌肌动蛋白(α -SMA)、结蛋白(Desmin)、胶原Ⅰ及Ⅲ、TGF-β1、纤维连接蛋白(FN)蛋白表达,RT-PCR法检测TGF-β1mRNA、FN mRNA表达。结果 各治疗组6周时胰腺纤维化指标和腺体破坏指标都明显低于CP组(P值均<0.01),VitC组和VitE组空泡样变指数也小于CP组(P值均<0.01)。2周起PDTC组、Vit C组和Vit E组胰腺的SOD、GSH-PX活性均较同时间点CP组升高,而MDA含量较同时间点CP组下降,差异均有统计学意义(P<0.05或<0.01),各治疗组间的差异无统计学意义。2周后各治疗组TGF-β1、FN mRNA水平均较CP组下降(P<0.05或<0.01),但仍高于对照组(P值均<0.05),各治疗组间的差异无统计学意义。结论 PDTC等抗氧化剂通过增强SOD等活性减少氧自由基产生,抑制PSCs的活化,并通过降低TGF-β1分泌,减少胶原Ⅰ、胶原Ⅲ、FN的产生,抑制胰腺的纤维化。
胰腺炎,慢性; 纤维化; PDTC; 抗氧化剂; 胰腺星形细胞
在慢性胰腺炎(CP)的发生和发展过程中,氧化应激不作为单一致病因素,但氧自由基增多导致的胰腺腺泡损伤是CP的重要发病原因[1]。CP患者尤其是多次急性发作者的血清氧自由基浓度明显增高,胰腺组织中亦有氧自由基的积聚,并伴有不同程度抗氧化物质的减少。抗氧化剂治疗已被证明能有效地减轻继发于CP的腹痛[2-3],并通过抑制胰腺星状细胞(pancreatic stellate cells,PSCs)的活化来抑制胰岛的纤维化[4]。本课题组曾采用大鼠腹腔内注射超氧化物歧化酶 (superoxide dismutase,SOD)抑制剂二乙基二硫代氨基甲酸盐(diethyldithiocarbamate,DETC)的方法建立CP模型[5]。本研究应用四氢吡咯二硫代氨基甲酸盐(pyrrolidine derivative of dithiocarbamate,PDTC)等抗氧化剂干预CP大鼠, 观察其对CP大鼠PSCs活化及胰腺组织纤维化的影响,探讨其作用机制。
材料与方法
一、动物模型建立及分组
雄性Wistar大鼠165只,体质量220~250 g,由中国科学院上海实验动物中心提供。通过完全随机法分为对照组、CP组、PDTC治疗组、维生素C(Vit C)治疗组、Vit E治疗组。对照组5只大鼠不做任何处理,其余4组均采用腹腔内注射DETC 750 mg/kg体质量、每周2次的方法制备CP模型[5],每组40只大鼠。各治疗组大鼠在注射DETC后30 min分别注射PDTC 100 mg/kg体质量、Vit E 15 mg/kg体质量、Vit C 15mg/kg体质量。初次注射DETC后90 min,24、48、72 h,2、3、4、6周分批处死大鼠,取胰腺组织,部分液氮保存,部分4%甲醛固定。
二、胰腺组织病理学检查
取固定胰腺组织,常规石蜡包埋、切片、HE染色,由病理科医师阅片,并参考Su等[6]的标准进行CP病理评分。
三、胰腺组织SOD、GSH-PX活性及MDA含量测定
取液氮冷冻的大鼠胰腺组织,剪取50 mg,应用组织匀浆液制备匀浆,4 000 g离心15 min,取上清液。应用蛋白定量试剂盒(南京建成生物工程研究所)定量蛋白浓度。应用SOD、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-PX)检测试剂盒(均购自南京建成生物工程研究所)测定SOD、GSH-PX活性和MDA含量,按试剂盒说明书操作。
四、胰腺组织α -SMA、Desmin、FN、胶原Ⅰ、胶原Ⅲ、TGF-β1蛋白表达检测
采用免疫组化方法检测胰腺组织α-平滑肌肌动蛋白( α-SMA)、结蛋白(Desmin)、纤维连接蛋白(FN)、胶原Ⅰ、胶原Ⅲ、TGF-β1 蛋白表达。抗α-SMA、Desmin免疫组化检测盒和抗胶原Ⅰ、Ⅲ单抗购自美国Sigma公司;抗FN单抗和抗TGF-β1抗体购自福建迈新科技有限公司;羊抗兔IgG购自Santa Cruz生物科技有限公司。按试剂盒说明书操作,最后DAB显色,苏木素复染,透明、封片,光镜下阅片。每切片取5个视野,计算阳性细胞百分比,0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;按染色强度,无着色0分,淡黄色1分,棕黄色2分,棕褐色3分。两分值相乘,0分为阴性(-)、1~4分弱阳性(+)、5~8分阳性(++)、9~12分强阳性(+++)。
五、胰腺组织TGF-β1、FN mRNA检测
取液氮冰冻的胰腺组织,融化后采用Trizol(Gibcol公司)提取组织总RNA。先逆转录成cDNA,再行PCR扩增。TGF-β1正义序列5′-CTTCAGCTCCACAGAGAAGAACTGC-3′,反义序列5′-CACGATCATGTTGGACAACTGCTCC-3′,扩增产物298 bp,FN正义序列:5′-ACATTGATCGCCCTAAAGGA-3′,反义序列:5′-CTGTGGACTGGGTTCCAAT-3′,扩增产物270 bp,以β-actin为内参。引物由上海博亚生物技术有限公司合成。常规PCR扩增,扩增产物经琼脂糖凝胶电泳分离,紫外照相仪摄片,图像分析软件获取条带灰度值,以目的条带与内参条带的灰度值比表示mRNA相对表达量。
六、统计学处理
结 果
一、胰腺组织病理改变
对照组大鼠胰腺组织均正常。CP组大鼠1 d时见胰腺组织内有出血、炎性细胞浸润、空泡样变;2周时出现胰腺导管增生,间质内纤维组织增生,偶见细胞脂肪变性,无明显腺体破坏;3周时胰周和小叶间见较明显纤维组织,腺泡细胞之间也出现纤细的纤维组织;4周时部分腺体萎缩,脂肪浸润,被部分纤维组织替代;6周时胰腺组织间隔明显增宽,大量纤维组织增生,腺体萎缩被纤维组织或脂肪包绕、替代。各治疗组大鼠的胰腺水肿和导管增生明显,炎性细胞浸润较CP组减轻,脂肪浸润少见,组织间隙增宽,但以水肿为主,间隙内未见到明显的纤维组织,胰周、小叶间和小叶内无明显纤维组织增生,偶见细胞脂肪变性,无明显的腺泡破坏,直到6周也未见明显的纤维化和腺泡萎缩、破坏(图1)。
CP组6周时胰腺的空泡样变、叶间纤维化、叶内纤维化、脂肪浸润及纤维化指标、腺体破坏指标的评分均显著高于对照组。各治疗组6周时胰腺的叶间纤维化、叶内纤维化、脂肪浸润、纤维化指标、腺体破坏的评分均显著低于CP组,VitC组和VitE组胰腺的空泡样评分也显著低于CP组(P值均<0.01,图2)。
二、各组大鼠胰腺组织SOD、GSH-PX活性和MDA含量变化
对照组大鼠SOD、GSH-PX活性及MDA含量分别为(6.21±0.48)、(5.62±0.63) NU/mg、(0.20±0.04)nmol/mg。CP组各时间点大鼠胰腺组织SOD、GSH-PX活性均较对照组显著下降,MDA含量均较对照组显著升高(P值均<0.05) 。各治疗组大鼠在72 h内胰腺组织SOD、GSH-PX活性均较对照组显著下降,而显著高于同时间点CP组大鼠,但MDA含量显著高于对照组,而显著低于CP组,差异均有统计学意义(P<0.05或<0.01);2周后SOD、GSH-PX活性较同时间点CP组大鼠显著升高,而MDA含量较同时间点CP组大鼠显著下降,差异均有统计学意义(P<0.05或<0.01)。但各治疗组间的差异均无统计学意义(表2、3、4)。
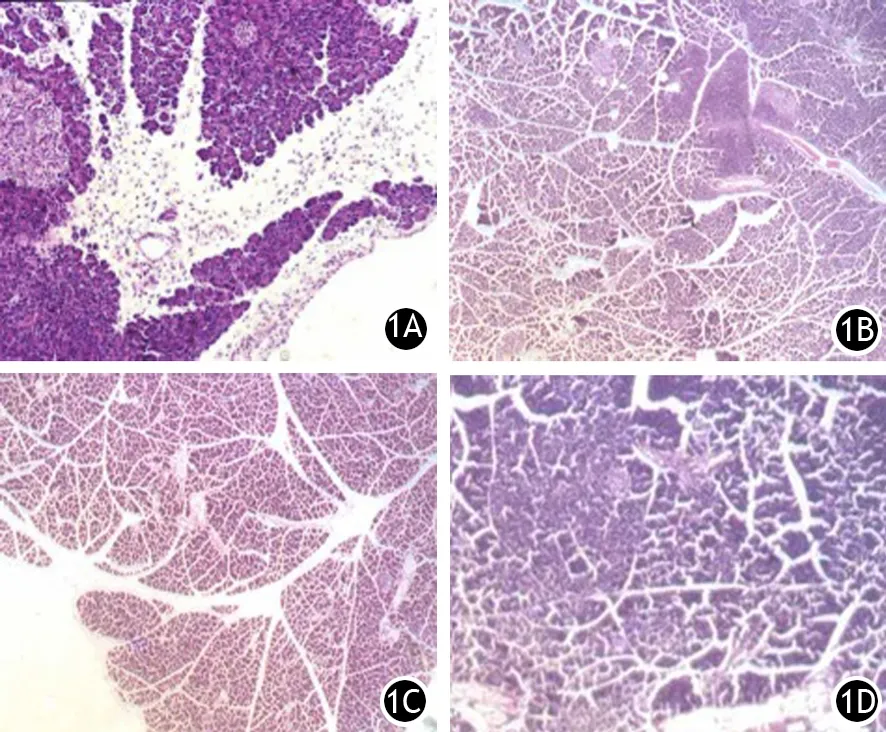
图1 CP组(1A)、PDTC组(1B)、Vit C组(1C )、Vit E组(1D)大鼠6周时的胰腺病理改变(HE ×400)
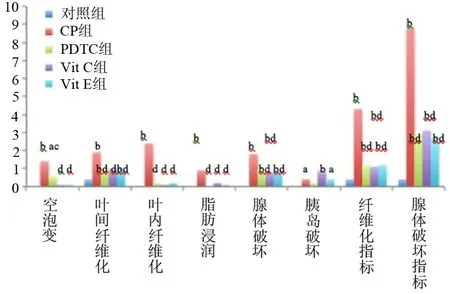
注:与对照组比较,aP<0.05,bP<0.01;与CP组比较,cP<0.05,dP<0.01图2 对照组、CP组及各治疗组6周时的胰腺病理评分
SOD与GSH-PX活性呈正相关(r=0.538,P<0.01),SOD、GSH-PX活性与MDA含量均呈负相关(r值分别为-0.528、-0.502,P值均<0.01)。
SOD、GSH-PX活性与胰腺纤维化、胰腺破坏评分均呈显著负相关(r值分别为-0.531、-0.497、-0.418、-0.560,P值均<0.01),而MDA含量与胰腺纤维化、胰腺破坏评分均呈显著相关(r值分别为0.545、0.493,P值均<0.01)。
表2 各组大鼠胰腺组织SOD活性变化
注:与CP组比较,aP<0.05,bP<0.01
表3 各组大鼠胰腺组织GSH-PX活性变化
注:与CP组比较,aP<0.05,bP<0.01
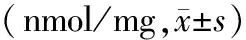
表4 各组大鼠胰腺组织MDA含量变化
注:与CP组比较,aP<0.05,bP<0.01
三、胰腺组织α-SMA、Desmin、TGF-β1、胶原Ⅰ 、胶原Ⅲ、FN蛋白表达
α-SMA和Desmin蛋白表达于小叶间质、血管周边和腺泡旁;TGF-β1表达于小叶间质的结缔组织内,腺泡间也有少量表达;胶原Ⅰ、胶原Ⅲ表达在腺泡之间,呈网格状包绕腺泡;FN主要表达在叶间纤维组织内,呈树枝状分布。
CP组大鼠胰腺组织自2周起α-SMA、Desmin、TGF-β1阳性表达,4、6周时无明显增强;FN、胶原Ⅰ、胶原Ⅲ在2周时弱阳性表达,至4周时呈强阳性表达。各治疗组大鼠胰腺组织α-SMA、Desmin、TGF-β1也阳性表达,但较CP组减弱,呈弱阳性(图3、4);FN、胶原Ⅰ、胶原Ⅲ少量弱阳性表达,未形成树枝状或网格状结构(图5)。
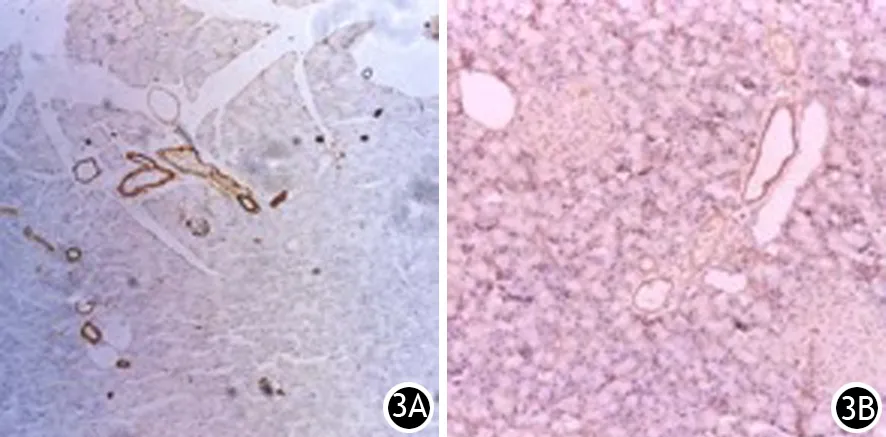
图3 6周时CP组(3A)与PDTC组(3B)大鼠胰腺内α-SMA的表达(免疫组化 ×100)
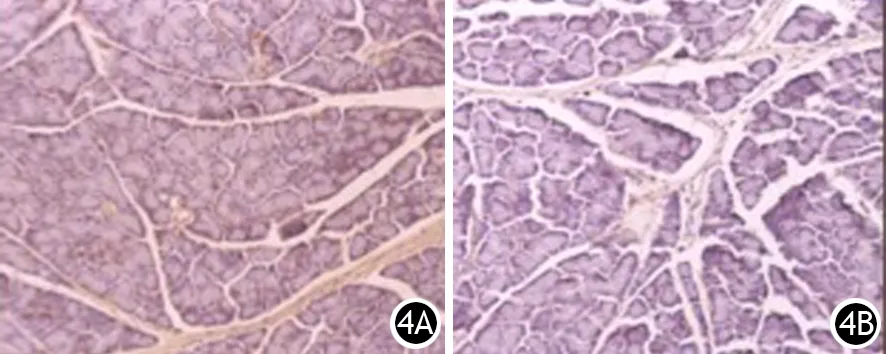
图4 6周时CP组(4A)与PDTC组(4B)大鼠胰腺内TGF-β1的表达(免疫组化 ×100)
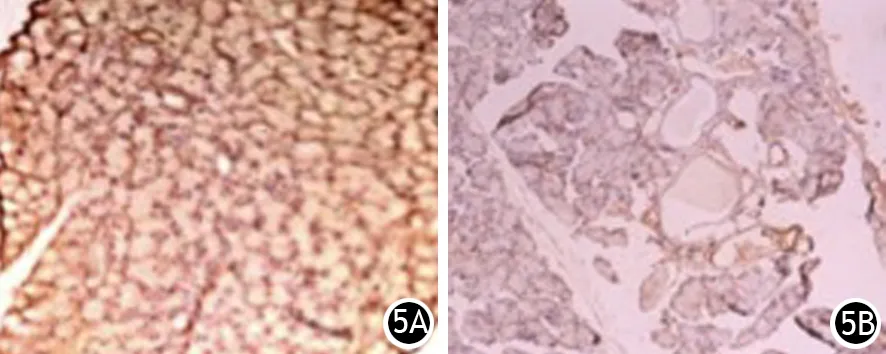
图5 6周时CP组(5A)与PDTC组(5B)大鼠胰腺内胶原I的表达(免疫组化 ×100)
四、胰腺组织TGF-β1、FN mRNA表达
对照组大鼠胰腺组织TGF-β1 、FN mRNA表达量分别为0.4562、0.4147;CP组大鼠胰腺组织TGF-β1 、FN mRNA表达量均较对照组显著增加,各治疗组大鼠胰腺组织TGF-β1、FN mRNA表达量较CP组显著下调,差异均有统计学意义(P值均<0.05),而各治疗组之间的差异均无统计学意义(表5)。
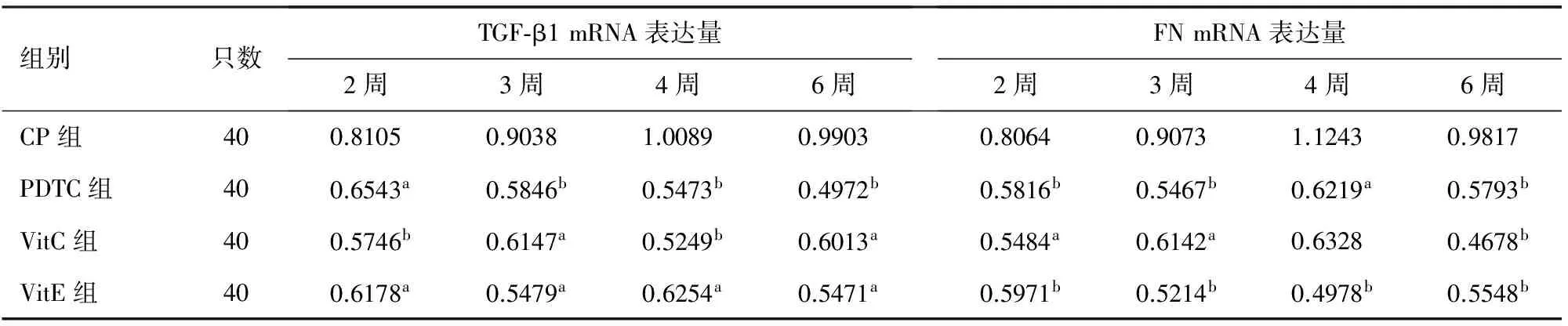
表5 各组大鼠胰腺组织TGF-β1、FN mRNA表达量
注:与CP组比较,aP<0.05,bP<0.01
讨 论
文献报道,氧自由基增多导致的胰腺腺泡损伤是CP的重要发病机制[1]。Dhingra等[3]报道,急慢性胰腺炎患者血清SOD等抗氧化酶减少,应用抗氧化剂治疗可缓解患者的疼痛,并减少CP急性复发。Ryu等[4]报道,抗氧化剂通过抑制胰腺星状细胞(PSCs)的活化而抑制胰岛的纤维化。Lee等[7]报道,抗氧化剂可以通过减少胰岛的纤维化,保护胰腺β细胞。高浓度的Vit C是自由基清除剂,还能使氧化的Vit E还原,两者有协同作用。另有报道证实Vit E的水解产物α生育酚有治疗CP的作用[8-9], PDTC作为一种抗氧化剂,可通过抑制NF-κB的活性减轻重症急性胰腺炎的脏器损伤[10],但对于CP的治疗作用尚无报道。
MDA含量可反映机体内脂质过氧化的程度,并间接反映细胞受损程度,而SOD和GSH-PX是机体清除自由基的重要酶类,SOD和GSH-PX的活性强弱往往提示体内抗氧化作用的强弱。本研究结果显示,腹膜内注入氧化剂DETC后,各时间点胰腺组织的SOD和GSH-PX活性均低于正常对照组,而MDA含量增高,前两者与后者呈负相关,提示DETC通过抑制SOD和GSH-PX活性使机体清除氧自由基的能力下降,造成氧自由基过剩,产生脂质过氧化反应,生成大量MDA,这种作用在72 h内尤为明显。2周后CP组SOD、GSG-PX活性虽有所回升,但仍低于正常对照组,提示大鼠胰腺内自身的抗氧化机制有所激活,但仍低于正常水平。3周后CP组大鼠胰腺出现明显纤维化,并伴有脂肪浸润,腺体破坏等改变,可见长期慢性氧化刺激可能为CP发病机制中的重要因素。而用3种抗氧化剂治疗后,治疗组各时间点胰腺的SOD、GSH-PX活性均高于CP组;MDA含量较CP组减少,提示PDTC、Vit C和Vit E均可通过清除自由基降低脂质过氧化产物有效地对抗了DETC对SOD、GSH-PX活性的抑制作用,增强了清除自由基的能力,保护胰腺细胞。3周后治疗组大鼠胰腺空泡样变和脂肪变性较CP组明显减少,与正常对照组大鼠相比,治疗组大鼠胰腺水肿明显,但增宽的组织间隙内并未见到明显的纤维组织,小叶内的纤维化和腺体的萎缩破坏更是少见,相关性分析也证实了MDA含量与胰腺的纤维化和破坏程度显著相关,而SOD和GSH-PX活性与之呈显著负相关,表明抗氧化剂通过减少体内的氧自由基,避免其对胰腺的腺泡细胞长期攻击而造成细胞变性坏死以及对炎性细胞的趋化作用,减轻胰腺的损害,抑制纤维组织的增生。这也再一次证实氧化应激在CP发病中的作用,抗氧化治疗是抗胰腺纤维化的重要机制。受样本量限制,不管是SOD、GSH-PX活性和MDA含量还是胰腺纤维化程度,3种不同药物治疗组之间的差异无统计学意义。
Desmin和α-SMA是PSCs活化的标志。活化的PSCs促使TGF-β1分泌,TGF-β1反过来又促进PSCs的活化。PSCs分泌的胶原Ⅰ、胶原Ⅲ和FN等胶原成分增多,它们沉积在腺泡周围及间质中,最后在小叶间甚至小叶内形成大量纤维组织,这是CP的病理基础。本研究结果显示,治疗组胰腺组织胶原Ⅰ、胶原Ⅲ、FN、α-SMA、Desmin、TGF-β1在组织内表达均较CP组下调,以胶原Ⅰ、胶原Ⅲ、FN尤为明显。CP组大鼠α-SMA和Desmin主要表达在腺体间质、腺泡旁以及血管周边,治疗组α-SMA主要在血管周围表达,标记正常的平滑肌细胞,而腺泡间仅有少量α-SMA和Desmin表达,提示PSCs的增生和活化被抑制。TGF-β1可由PSCs分泌,一定程度上反映了PSCs的活化与纤维化程度相关。本研究的治疗组TGF-β1分泌量较CP组减少,提示抗氧化剂可抑制TGF-β1的分泌。胶原Ⅰ和胶原Ⅲ是胶原的主要成分,在CP组大鼠胰腺腺泡之间表达,构成网格状包绕腺泡结构,治疗组胶原Ⅰ、Ⅲ在腺泡之间少量表达,不构成网格状,可能跟PSCs活化被抑制及TGF-β1分泌减少有关。
综上所述,PDTC等3种抗氧化剂通过清除多余的氧自由基保护胰腺腺泡细胞,抑制PSCs增殖,导致TGF-β1的分泌减少,胶原Ⅰ、Ⅲ及FN等胶原成分分泌减少,明显减轻大鼠胰腺纤维化和腺体萎缩的程度。但3种抗氧化剂的疗效并无统计学差异。PDTC作为一种新的抗氧化剂,由于可抑制NF-κB活性,其对CP治疗的作用机制有待进一步探索。
[1] Siriwardena AK. Reappraisal of xenobiotic-induced, oxidative stress-mediated cellular injury in chronic pancreatitis: a systematic review[J]. World J Gastroenterol, 2014, 20(11):3033-3043.
[2] Domínguez-Muoz JE. Latest advances in chronic pancreatitis[J]. Gastroenterol Hepatol, 2014, Sep;37 Suppl 3:93-97.
[3] Dhingra R, Singh N, Sachdev V, et al. Effect of antioxidant supplementation on surrogate markers of fibrosis in chronic pancreatitis: a randomized, placebo-controlled trial[J]. Pancreas, 2013, 42(4):589-595.
[4] Ryu GR, Lee E, Chun HJ, et al. Oxidative stress plays a role in high glucose-induced activation of pancreatic stellate cells[J]. Biochem Biophys Res Commun, 2013, 439(2):258-263.
[5] 朱颖,孙蕴伟,袁耀宗,等.持续抑制超氧歧化酶活性诱导大鼠慢性胰腺炎模型[J].中华胰腺病杂志,2013,13(3):183-188.
[6] Su SB, Xie MJ, Sawabu N, et al. Suppressive effect of herbal medicine saikokeishito on acinar cell apoptosis in rat spontaneous chronic pancreatitis[J]. Pancreatology, 2007,7(1):28-36.
[7] Lee E, Ryu GR, Ko SH, et al. Antioxidant treatment may protect pancreatic beta cells through the attenuation of islet fibrosis in an animal model of type 2 diabetes[J]. Biochem Biophys Res Commun, 2011, 414(2):397-402.
[8] Jiang F, Liao Z, Hu LH, et al. Comparison of antioxidative and antifibrotic effects of α-tocopherol with those of tocotrienol-rich fraction in a rat model of chronic pancreatitis[J]. Pancreas, 2011, 40(7):1091-1096.
[9] Li XC, Lu XL, Chen HH. α-Tocopherol treatment ameliorates chronic pancreatitis in an experimental rat model induced by trinitrobenzene sulfonic acid[J]. Pancreatology, 2011, 11(1):5-11.
[10] Zhou CH, Lin Li, Zhu XY, et al. Protective effects of edaravone on experimental chronic pancreatitis induced by dibutyltin dichloride in rats[J]. Pancreatology, 2013, 13(2):125-132.
(本文编辑:屠振兴)
·读者·作者·编者·
关于非法网站冒用我刊名义进行征稿的特别提醒
近期我们发现一些网站冒用“中华胰腺病杂志”名义征稿,并承诺“职称论文权威快速代发”。为此,我刊特别提醒各位作者,向《中华胰腺病杂志》投稿,一定要登录中华医学会首页(http://www.cma.org.cn),进入“业务中心”,在“杂志社远程稿件管理系统”中投稿,或直接发送到本刊邮箱(Email: yixianbingxue@163.com)进行投稿,以免上当。本刊联系电话:021-31161362。
Effect of antioxidants on pancreatic fibrosis of rats with chronic pancreatitis
Zhuying,Sunyunwei,ZhangYongping,YuanYaozong,BieLike.DepartmentofGastroenterology,RuijinHospital,ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai200025,China
Correspondingauthor:BieLike,Email:BK_ERCP@163.com
Objective To investigate the effect of antioxidants including PDTC on pancreatic fibrosis of rats with chronic pancreatitis. Methods The rats were randomly divided into 5 groups including control group, CP group, PDTC treatment group, vitamin E treatment group and vitamin C treatment group. The CP model was in ducad by using intraperitoneal injection of DETC (750 mg/kg), twice a week. The control group received no treatment. After DETC injection, the treatment groups received an intraperitoneal injection of PDTC (100 mg/kg), vitamin E (15 mg/kg), vitamin C (15 mg/kg), respectively. Rats were sacrificed at 90 min, 24 h, 48 h, 72 h, 2 w, 3 w, 4 w, 6 w after first injection of DETC. Pancreatic tissue was taken for routine pathological examination. The activity of SOD, GSH-PX and MDA content were detected by spectrophotometric ratio method. α-SMA, desmin collagen Ⅰ, Ⅲ, TGF-β1, FN were detected by immunohistochemical assay. The expression of TGF-β1, FN mRNA was measured by RT-PCR. Results At 6w, the fibrosis and the parameters for damage of the pancreas in the three treatment groups were significantly better than that in CP group (P<0.01), the vacuolar degeneration index in vitamin E group and vitamin C group was also better than that in CP group (P<0.01). From the 2nd week, the activity of SOD, GSH PX in PDTC group, Vit C group and Vit E group was higher than that in CP group, while the MDA activity was lower than that in CP group, and the difference was statistically significant (P<0.01 orP<0.05). No significant difference was found among the three treatment groups. The mRNA levels of TGF-β1 and FN of the treatment groups were lower than those of CP group (P<0.05 orP<0.01), but higher than those of the control group (P<0.05). There was no significant difference among the three treatment groups (P>0.05). Conclusions PDTC and the other antioxidants can reduce oxygen free radicals by increasing the activity of SOD, suppressing the activation of PSCs, reducing the secretion of TGF-β1, Collagen Ⅰ, Ⅲ, FN and eventually inhibit the progress of pancreatic fibrosis.
Pancreatitis, chronic ; Fibrosis; PDTC; Antioxidants; Pancreatic stellate cells
10.3760/cma.j.issn.1674-1935.2015.06.008
200025 上海,上海交通大学医学院附属瑞金医院消化内科
别里克,Email: BK_ERCP@163.com
2015-03-17)
