健康种植体周围龈下微生物多样性研究*
2015-02-25陈一陈新钟科孙勇廖丽斐
陈一 陈新 钟科 孙勇 廖丽斐
(1.川北医学院第二临床医学院·南充市中心医院口腔科,四川 南充 637000;2.成都军区机关医院,四川 成都 610083;3.兵器工业521医院口腔科,陕西 西安 71000)
健康种植体周围龈下微生物多样性研究*
陈一1陈新2钟科2孙勇2廖丽斐3
(1.川北医学院第二临床医学院·南充市中心医院口腔科,四川 南充 637000;2.成都军区机关医院,四川 成都 610083;3.兵器工业521医院口腔科,陕西 西安 71000)
目的 研究正常种植体周围龈下微生物群落的多样性,为牙种植术后进行临床维护与干预提供微生物学依据。方法 采用PCR-DGGE技术初步对收集到的种植术后3个月正常种植体周围龈沟液及邻近天然牙龈沟液中的微生物群落进行多样性分析,成像后切取34条优势条带,将克隆测序获得的16SrDNA序列提交GenBank数据库进行对比分析。结果 克隆结果显示所检测到的微生物群落可分为17个不同的种属,其中包括有厌氧菌、需氧菌、真菌等,同时发现有牙周可疑致病菌的存在。结论 种植体植入口腔这一复杂的微生态环境中,各微生物群落在各时期均维持一定的动态平衡能防止种植体周围炎的发生。
种植体; PCR-DGGE; 微生物群落; 多样性分析
口腔微生物群落较为复杂,约有700余种。而种植体植入口腔这样一个有菌的环境,并要在这一环境中行使功能,就要保证种植体周围微生物群落的动态平衡。有研究表明[1~3]种植体周可疑致病菌主要为中间普氏菌、伴放线杆菌、福赛拟杆菌聚核梭杆菌、牙龈卟啉单胞菌和螺旋体;进一步研究发现[4]成功种植体周与正常牙周有着相似的微生物群落,如链球菌属、放线杆菌属、韦容球菌属、梭杆菌等。回顾文献,多数研究致力于研究种植体周围龈下微生物群落组成,而正常种植体周围龈下微生物群落多样性及动态变化模式方面的研究较少。本文旨在应用分子生物学的方法来研究正常种植体周围龈下微生物群落的组成及其动态变化模式,完善牙种植体周围微生物多样性的信息,为提高种植修复的成功率及预防种植体周围炎的发生提供参考。
1 对象与方法
1.1 对象 选择2012年2月成都军区机关医院口腔科接受BEGO系统两段式种植体义齿修复的患者11例,其中男性8例,女性3例,年龄(50.8±9.5)。
1.2 方法
1.2.1 种植体周及天然牙周龈沟液的采集 整个操作过程由同一位口腔医师进行培训后完成。分别采集种植体穿龈部分暴露于口腔3个月时的龈沟液作为实验组,种植体邻近的健康临牙的龈沟液作为对照组。
采用前请患者用清水漱口,刮除取样牙颈部附着的牙石、菌斑。棉球隔湿,轻轻吹干待测牙的颊面及颈部,以20g左右的力量将2×8mm的Whatman I号无菌滤纸条前端轻轻插入样本种植体近颊点龈沟内,遇到轻微阻力时停止,放置40s后取出滤纸条,迅速放入消毒好的EP管中。间隔1min后,再用新的滤纸条重复上述操作,多次采集龈沟液以提高样本中的DNA总量(舍弃沾有血渍和被唾液污染的样本)。种植牙位邻牙的龈沟液的采集方法与前者一致,采集完毕后称重,计算得出龈沟液重量,做好标记,放入-80℃冰箱中冻存备用。
1.2.2 龈沟液样本DNA的提取、16S rDNA V3区PCR扩增 采用上海康迪生物公司的DP316-微量样品基因组DNA提取试剂盒按操作说明提取龈沟液内总DNA,随后,使用Bio-Rad iCycle PCR仪进行PCR扩增。
1.2.3 变性梯度凝胶电泳(DGGE)及图谱分析 将样本总DNA进行PCR扩增,再将PCR产物采用美国Bio-Rad Dcode sytem进行变性梯度凝胶电泳。紫外光呈像,将DGGE凝胶中的优势条带切割分离、纯化、克隆,再进行蓝白斑筛选,将阳性克隆交于上海华大基因公司克隆测序,并将所测定的16SrDNA序列提交GenBank数据库进行比对,构建系统发育树,从而对龈下优势微生物群落结构进行分析。
2 结果
测序结果显示切割分离DGGE凝胶,共得到优势条带34条,测序结果与GenBank数据库比对后可按其种属分为17组,其中包括原核类微生物(各种口腔常见细菌、密螺旋体)、真核类生物(真菌类)以及一些未获培养的菌属。
原核类微生物:牙龈卟啉单胞菌属、普雷沃氏菌属、链球菌属、月牙形单胞菌属、巴斯德氏菌属、消化链球菌属、密螺旋体菌属、纤毛菌属、梭菌属、噬二氧化碳细胞菌属、棒杆菌属、口腔古细菌;真核生物:真菌类;以及其他未获培养的菌属。各条带对应种属如图1所示。
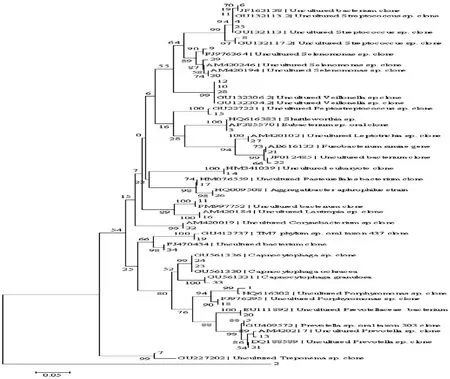
图1 各条带对应种属图
Figure 1 Different genus
3 讨论
分子生物学技术的不断发展为微生物多样性研究提供了新的手段, DGGE技术利用序列不同的DNA在凝胶中解链条件不同的原理,进行DNA样本的扩增和电泳分离,获取的凝胶图谱即可反映样品微生物的多样性、丰富度等特征。该技术已逐渐应用于多种口腔疾病的微生物研究,如牙髓炎、牙周炎、龋病等[5~7]。
本实验结果表明,健康种植体及邻近健康天然牙周围龈下群落相似,主要由月牙形单胞菌属、普雷沃氏菌属、韦容球菌属、链球菌属、梭菌属等厌氧菌属组成,进一步证实了种植体龈沟液内细菌来源于天然牙周"细菌库"这一说法,两者之间会互相影响互相迁移[8]。
种植术后3个月内均可检测到有牙龈卟啉单胞菌属、密螺旋体、口腔古细菌、梭菌属等牙周可疑致病菌的存在。牙龈卟啉单胞菌作为牙周病的主要致病菌已被证实[9],本实验中健康种植体及天然牙周龈下微生物群落中均可检测到牙龈卟啉单胞菌,但并未导致种植体周围炎及牙周炎的发生,故本实验支持牙龈卟啉单胞菌为内源性条件致病菌。 本实验结果中发现,口腔古细菌在健康种植体及健康邻牙的龈下菌群中也广泛存在。在牙周病患者的牙周袋、牙髓病根尖周炎性组织和健康人群的龈袋中发现了口腔古细菌的存在,其是否参与感染的发生及其致病性有待进一步研究证实[10]。
4 结论
种植义齿的健康状况与其龈下微生物群落具有直接关系,维持种植体周围微生物群落的动态平衡是维持种植体成功的重要条件之一,这一动态平衡的破环是导致种植体周围炎的始动因子。在种植术后3个月种植体周及正常天然牙周均有牙龈卟啉单胞菌、口腔古细菌等口腔条件致病菌的存在,应在维护种植体周健康的同时加强对口腔天然牙周的维护,从而为种植体穿龈结构与周围软组织的结合提供稳定的微生态环境。
[1]Van Winkelhoff AJ, Loose BG, Vander Reijden WA,etal. Porphyromonas gingival, Bacteroides forsythus and other putative periodontal pathogens in subjects with and without periodontal destruction[J]. Periodonto1, 2009, 29(11):1023-1028.
[2]Mombelli A, Microbiology and antimicrobial therapy of per-implants[J]. Periodontol, 2002, 28:177-180.
[3]Quirynen M, De Soete M, van Steenberghe D. Infectious risks for oral implants:a review of the literature[J].Clin Oral Implants Res, 2002.13(1):1-19.
[4]王钰, 焦艳军. 人工种植牙龈沟内细菌的研究[J]. 中国口腔种植学杂志, 2007, 12(4):161-164.
[5]Zijinge V,Harmsen HJ,Kleinfelder JW,etal.Denaturing gradient gel electrophoresis analysis to study bacterial community strutture in pockets of periodontitis patients[J].Oral Microbial Immunology,2003,8(1):59-65.
[6]Li Y, Ku CY, Xu J,etal. Survey of oral microbial diversity using PCR based denaturing gradient gel electrophoresis [J]. Dent Res,2005, 84(1):559-564.
[7]Ruth GL, Peter G, Sharon A,etal. Molecular analysis of the sub gingival micro biota in health and disease [J]. Apple environ Microbial, 2007, Jan: 516-523.
[8]QUIRYNEN M, De SOETE M, Van STEENBERCHE D. Infectious risks for oral implants: a review of the literature[J].Clin Oral Implants Res,2002,13(1):1-19.
[9]Bong-Kyu Choi, Seong-Hee Park, Yun Jung Yoo,etal. Detection of major putative. Periodontopathogens in Korean advanced adult periodontitis patients using a nucleic acid-based approach [J]. Periodontol 2000;71: 1387-1394.
[10] 张慧翼,万呼春. 古菌与牙周病的关系[J]. 国际口腔医学杂志,2008,4(35):134-136.
Microbial diversity research of the health implant under the gum
CHEN Yi1,CHEN Xin2,ZHONG Ke2,etal
(1.DepartmentofStomatology,TheCentralHospitalofNanchong,Nanchong637000,Sichuan,China;2.ChengduMilitaryDistrictAdministrationHospital,Chengdu610083,China; 3.DepartmentofStomatology,521HospitalofWeaponsIndustry,Xian710000,China)
Objective To detect the diversity of the microflora from normal implants gingival crevicular fluid, and provide a reference for the clinical maintenances and interventions after the dental implant surgery. Methods The gingival crevicular fluid in the normal implants and the nearly health tooth at 3months after the dental implant were selected. Diversity were analyzed with PCR-DGGE. 34 Advantage bandings were put to cloning and sequencing. Then submit the determination of 16 SrDNA sequence to the GenBank database and had a similarity comparison analysis consequence. Results The detected microbial community from the cloning result could be divided into 17 different species, including anaerobic bacteria, aerobic bacteria, fungi, etc. The existence of periodontal suspicious pathogenic bacteria was found at the same time. Conclusion When the implants implanted to the oral, which have a complex micro ecological environment, in order to prevent the occurrence of inflammation around the implant, the microbial community in different periods are maintained certain dynamic balance.
Implant; PCR-DGGE; Microbial community; Diversity analysis)
成都军区“十一五”面上B类课题(MB09039)
钟科,Tel:13808008012
R 782.12
A
10.3969/j.issn.1672-3511.2015.02.026
2014-07-10; 编辑: 张文秀)
