碱性成纤维细胞生长因子在大鼠腮腺萎缩和再生过程中的表达及意义
2015-02-24刘士维,卢浩,柳康等
碱性成纤维细胞生长因子在大鼠腮腺萎缩和再生过程中的表达及意义
刘士维,卢浩,柳康,张赐童,刘麒麟,孙宾,张伟*
(吉林大学口腔医院 口腔颌面外科,吉林 长春130021)
头颈部的放射治疗、炎症等常会引起涎腺分泌功能障碍,影响患者的生活质量,因此,治疗涎腺萎缩,促进腺体功能恢复日益引起人们的重视。碱性成纤维细胞因子(bFGF)是目前公认的最强的促血管生成因子和促创伤修复因子之一[1],已有国外学者研究表明bFGF在大鼠下颌下腺中有表达并可以促进下颌下腺组织修复[2]。与下颌下腺相比,腮腺在组织结构以及功能上与其有一定的区别,虽有学者已证实bFGF存在于大鼠的腮腺组织中[3],但对bFGF在腮腺组织萎缩及再生过程中表达变化及生理功能的研究还未见报道,本实验通过建立Wistar大鼠腮腺主导管结扎和再通模型[4],研究在此过程中bFGF的表达及与腮腺细胞增殖的线性关系。
1材料和方法
1.1实验对象
7周龄SPF级雄性Wistar大鼠84只,体重约200-250 g,购于吉林大学动物实验中心。84只Wistar大鼠随机分为3组——空白对照组6只(不做任何处理)、腮腺主导管结扎组42只及主导管结扎再通组36只,常规饲养。
1.2腮腺创伤和再生模型的建立
结扎组和再通组大鼠10%水合氯醛3 mL·kg-1行腹腔麻醉,游离腮腺主导管和伴行的面神经颊支,用1号线双重结扎主导管,皮肤对位缝合。术后给予200单位青霉素,回笼常规饲养。结扎组大鼠在术后1 d、3 d、5 d、7 d、14 d、28 d、60 d处死,沿腮腺主导管切取右侧腮腺,立即放置4%多聚甲醛溶液中固定,再通组大鼠在导管结扎第14天取出结扎线,确保导管再通,分别于再通后1 d、3 d、5 d、7 d、14 d、28 d处死,同样方法获取腮腺标本。
1.3组织学观察
腮腺标本置于4%多聚甲醛溶液中固定24h后,梯度乙醇脱水、二甲苯透明、浸蜡、包埋,制成4 μm切片,行苏木精—伊红(Hematoxylin-Eosin,HE)染色,置于光镜下观察组织学变化。
1.4免疫组织化学观察
应用UltraSensitiveTM SP法免疫组织化学染色,DAB显色,试剂:兔抗鼠多克隆抗体(bFGF)(购于武汉博士德公司,中国)、兔抗鼠多克隆抗体PCNA抗体(购于Immunoway公司,美国),抗体浓度稀释1∶200。方法:苏木精轻度复染、盐酸酒精分化、氨水返蓝,镜下观察bFGF、PCNA的表达变化。
1.5统计分析

2结果
2.1大鼠腮腺结扎后与再通后的形态学改变
结扎组:导管结扎1天后腺体体积较正常腺体增大,随后2天有缩小趋势,第3天大至恢复正常大小,第7天时腺体明显萎缩,至28天时萎缩到正常腺体三分之二,颜色加深,质地变硬,腺小叶结构模糊。
再通组:主导管再通后,腺体颜色、体积、质地逐渐恢复正常,再通后14天时,腺体外观已恢复至正常腺体相近。
2.2组织学观察结果
2.2.1正常腮腺:腺体表面覆有被膜并且深入到腺体内,将腺体分隔开,形成许多腺叶和腺小叶,腺体是由腺泡细胞组成,腺泡细胞大小均匀,规则排列,其周围广泛散在有导管(包括闰管、纹管及排泄管)(见图1A)。
2.2.2结扎组:第1天时可见导管稍有扩张,但腺体无实质性改变;3天时导管增多,腺泡减少,腺小叶出现结构紊乱;5天、7天时腺泡细胞继续萎缩、减少,导管扩张,出现导管样结构(见图1B);14天时,导管样结构更多,少数的腺泡细胞分布在小叶边缘,大量淋巴细胞浸润;28天时,腺泡细胞几乎全部消失,腺体几乎全部是导管样结构,且相邻导管间有发生融合的倾向(见图1C)。
2.2.3再通组:第1天时萎缩的腺体未发生明显改变,还可见大量扩张的导管(见图1D);第3天时导管样结构减少;5天时,腺小叶周围出现新生的腺泡增多,且体积增大,导管样结构明显减少(见图1D);7天时,新生的腺泡已占绝大多数,形态趋近正常,但排列不够密实;14天、28天时腺泡细胞充盈,腺小叶结构恢复近似正常(见图1F)。

图1 大鼠腮腺主导管结扎及再通术后不同时间点的
2.3免疫组织化学染色结果
2.3.1bFGF免疫组化染色结果
①bFGF正常腮腺:在正常腺体中bFGF主要在导管上皮细胞和部分腺泡细胞中散在阳性表达(见图2A)。
②结扎组:主导管结扎后bFGF的吸光度值增加,3天达峰值(0.177±0.010),主要在腺泡细胞的胞浆和基质中表达,随后bFGF的表达渐平稳,7天后在腺泡细胞的基底膜和导管样结构周围表达。bFGF在各点的阳性表达情况见图2B、C及表1,与正常腮腺相比较二者具有统计学意义。
③再通组:主导管再通1d后腺泡细胞吸光度值增加,3d达峰值(0.288±0.027),且主要在新生腺泡细胞的胞浆和导管内皮细胞中表达,7d后表达下降,导管细胞的bFGF表达维持在较恒定的水平。bFGF在各点的阳性表达情况见图2D、E、F及表1,与正常腮腺相比较二者具有统计学意义。

图2 大鼠腮腺主导管结扎及再通术后不同时间点的
2.3.2PCNA免疫组化染色结果
①结扎组:在结扎3天后PCNA的表达显著上升,在腺泡和导管中都有表达,5天后腺泡细胞中PCNA达到峰值,随后降低并保持稳定。PCNA在不同时间点的阳性表达情况见图3A、B、C及表2。
②再通组:在导管再通1天PCNA的平均阳性表达上升,5天达到峰值,7天后降低并趋于平稳。PCNA在不同时间点的阳性表达情况见图3D、E、F及表2。
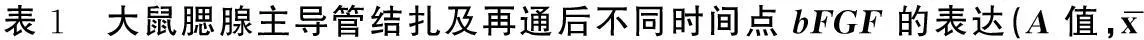
±s)
a:与0 d相比,P<0.05;b:与3 d相比,P<0.05; c:与5 d相比,P<0.05;*:Welch检验 #:Kruskal-Wallis检验

±s)
a:与0 d相比,P<0.05;b:与5 d相比,P<0.05;*:Welch检验

图3 大鼠腮腺主导管结扎及再通术后不同时间点的PCNA
3讨论
腮腺是口腔三大涎腺之一,其萎缩后的再生及功能的恢复较为复杂,本实验通过对腮腺主导管进行结扎和再通,来建立腮腺萎缩和再生模型[4],在此过程中观察到的典型变化为:主导管结扎后腮腺腺泡萎缩,数量减少、消失,导管样结构增多,bFGF的吸光度值逐渐升高;主导管再通后导管样结构减小,消失,腺泡细胞逐渐恢复正常,bFGF的吸光度值先升高再减低。对于腺体萎缩过程中,腺泡减少、消失,不同学者观点不同,有人认为腺泡细胞分化成了导管样结构[5-7]。有人认为是其自身凋亡所至,而半胱氨酸天冬氨酸蛋白水解酶在凋亡过程中起主要作用[8]。导管再通后腺泡细胞重新出现,对于新生的腺泡可能来源于残留在萎缩腺体中的腺泡再分化,也可能来源于剩余导管细胞的增殖和再分化[4]。
碱性成纤维细胞生长因子(bFGF)是一种生物性极强的多肽因子,最早是1995年vanSettenGB在唾液中检测到的。有研究证实[3]腮腺的腺泡细胞和导管上皮细胞可以产生bFGF,产生的bFGF存在于细胞外基质中。在正常状态下并不活跃,一旦损伤刺激出现,其就被激活并大量释放[9],且已存在的bFGF还会刺激分泌它的细胞产生更多的bFGF[10]。本研究观察到腮腺主导管结扎1 d、3 d后,bFGF阳性表达增加,在第3天时达到峰值,随后阳性表达降低但保持平稳,原因可能是因为当损伤刺激出现后,激发了细胞基质中bFGF的前体使其大量释放,虽然产生bFGF的腺泡细胞的不断萎缩,数量减少,但已经释放出来的bFGF会刺激腺泡细胞产生更多的bFGF,但随着大量腺泡细胞萎缩、消失,分泌功能降低,而导管上皮细胞分泌的bFGF较平稳,故总体bFGF表达下降。而主导管再通后随着腺泡细胞的恢复、再生,分泌bFGF的量也增加,在导管再通3d时达到峰值,同时分泌的bFGF也为腺泡细胞的增生提供条件,但随着损伤刺激去除的时间延长,腺体逐渐恢复正常,bFGF的表达也趋于稳定。主导管由结扎到再通,bFGF的表达部位由腺泡细胞的胞浆和基质,到腺泡细胞的基底膜和导管样结构周围,再到新生腺泡细胞的胞浆和导管内皮细胞,可能是由于腺泡细胞的萎缩凋亡,产生的导管样结构作为分泌单位去分化的产物,在导管再通后又重新分化为腺泡和导管细胞[11]的缘故。
本实验结果表明:主导管结扎1 d后,PCNA的表达开始有所增强,3 d后PCNA的阳性细胞数明显增多,可看见大量细胞核有丝分裂像,在第5 d达到峰值,7 d后下降并保持稳定,而bFGF的分泌从1 d后开始增强,3 d达到峰值,随后降低并保持稳定,说明bFGF能够刺激细胞发生有丝分裂,是一种强丝裂原,并且可以调控和稳定细胞状态,延长细胞存活期,这与Hom DB[12]和LObb RR[13]的观点一致。主导管再通后,PCNA和bFGF的线性关系跟结扎组一致,笔者认为原因有可能是bFGF激发了导管样结构向腺泡细胞转化,刺激了新生腺泡细胞的增殖[10],还有可能是因为bFGF影响细胞周期,使更多量的细胞进入增殖状态[14],但具体作用机制尚需进一步研究。值得一提的是,在上述过程中,高度分化的肌上皮细胞也发生有丝分裂,且数量逐渐增多,此与Redman的报道相一致[15]。
综上,在腮腺主导管结扎和再通的过程中,腺泡细胞由萎缩、消失到再生、恢复正常状态,腺泡细胞和导管样结构相互转化,bFGF与细胞增殖成正相关性。通过研究bFGF在腮腺萎缩及再生中的表达和意义,对唾液腺的萎缩治疗提供新的指导意义。
参考文献:
[1]Folkman J,klagskrun M.Angiogenic factors[J].Science,1987,235:442.
[2]Y Okazaki,H Kagami,T Hattori,et al.Acceleration of rat salivary glands tissue repair by basic fibroblast growth factor[J].Archives of Oral Biology,2000,45:911.
[3]Osamu Amano,Yoshino Yoshitake,Katsuzo Nishikawa,et al.Basic fibroblast growth factor in rat salivary glands[J].Cell Tissue Res,1993,273:467.
[4]Takahashi S,Schoch E,Walker NI.Origin of acinar cell regeneration after atrophy of the rat parotid induced by duct obstruction[J].Int J Exp Pathol,1998,79(5):293.
[5]Standish SM,Shafer WG.Serial histologic effects of rat submaxillary and sublingual salivary gland duct and blood vessel ligation[J].J Dent Res,1957,36(6):866.
[6]Tamarin A.Submaxillary gland recovery from obstruction.I.Overall changes andelectron microscopic alterations of granular duct cells[J].J Ultrastruct Res,1971,34(3):276.
[7]Tamarin A.Submaxillary gland recovery from obstruction.II.Electron microscopic alterations of acinar cells [J].J Ultrastruct Res,1971,34(3):288.
[8]Takahashi S,Gobe GC,Yoshimura Y,et al.Participation of the Fas and Fasligand systems in apoptosis during atrophy of the rat submandibular glands[J].Int J Exp Pathol,2007,88(1):9.
[9]Santiago FS,Lowe HC,Day FL,et al.Early growth response factor-1 induction by injury is triggered by release and paracrine activetion by fibroblast growth factor-2[J].Am J Pathol,1999,154:937.
[10]Schweigerer L,Neufeld G,Friedman J,et al.Capillary endothelial cells express basic flbroblast growth factor,a mitogen that promotes their owngrowth[J].Nature,1987(112):835.
[11]Takahashi S,Shinzato K,Nakamura S,et al.Cell death and cell proliferation in the regeneration of atrophied rat submandibular glands after duct ligation[J].Oral Pathol Med,2004,33(1):23.
[12]Hom DB,Maisel RH.Angiogenic growth factors:their effects and potential in soft tissue wound healing[J].Ann Otol Rhinol Laryngol,1992,101:349.
[13]LObb RR,Alderman ER,Fett JW.lnduction of angiongenesis bv bovine brain derived class heparinbinding growthfactor[J].Biochenistry,1985,24:49.
[14]周延冲,主编.多肽生长因子的基础与临床[M].北京:中国科学技术出版社,1992:26.
[15]Redman RS.Myoepithelium of salivary glands[J].Micros Res Tech,1994,27:25.
收稿日期:(2013-11-19)
文章编号:1007-4287(2015)03-0359-04
通讯作者*
