益生菌对炎症性肠病诱导和维持缓解疗效的meta分析
2015-02-23王霄腾戴金锋
王霄腾 戴金锋 吕 宾
浙江中医药大学附属第一医院消化内科(310006)
益生菌对炎症性肠病诱导和维持缓解疗效的meta分析
王霄腾*戴金锋吕宾#
浙江中医药大学附属第一医院消化内科(310006)

关键词炎症性肠病;有益菌种;随机对照试验;Meta分析
炎症性肠病(inflammatory bowel disease, IBD)是一种病因不明的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD),病程特点为症状缓解与复发交替出现,目前观点认为其发病主要与环境因素、遗传易感性、肠道菌群紊乱、自身免疫功能障碍有关[1-3]。IBD的常规治疗药物包括氨基水杨酸(ASA)制剂、激素、免疫抑制剂以及生物制剂如肿瘤坏死因子-α(TNF-α)抗体,后三类药物尽管疗效确切,但长期免疫抑制带来的不良反应不容忽视。益生菌是一类对人体有益的活性微生物,具有调节和稳定肠道内环境的作用,能调节肠黏膜免疫功能和肠屏障通透性,改善肠道菌群平衡和肠道功能紊乱,近年来广泛应用于IBD的治疗。越来越多的临床研究探讨了益生菌对IBD诱导和维持缓解的疗效,但结果存在较大争议。本研究采用meta分析方法对此问题进行系统评价,以期为益生菌在IBD临床治疗中的应用提供依据。
资料与方法
一、检索策略
计算机检索外文数据库PubMed、Cochrane Central Register of Controlled Trials(CENTRAL)、Embase、Web of Science(检索年限:1966年6月-2014年6月)和中文数据库中国期刊全文数据库(CNKI)、中国生物医学文献数据库(CBM)、万方数据库(检索年限:1978年6月-2014年6月),手工检索最近一年内国内外相关会议论文和资料。联合使用主题词和关键词进行检索,英文检索词:inflammatory bowel disease, IBD, ulcerative procto-colitis, ulcerative colitis, UC, Crohn’s disease, CD, probiotics,Lactobacillus,Bifidobacterium,Escherichiacoli;中文检索词:炎症性肠病、溃疡性结肠炎、克罗恩病、益生菌、微生态制剂、乳杆菌、双歧杆菌、大肠杆菌。查阅所获资料的参考索引和相关文献。
二、文献纳入和排除标准
纳入标准:①益生菌用于IBD诱导和(或)维持缓解的随机对照试验(RCTs);②研究对象经结肠镜和活检病理检查确诊为IBD;③试验至少包括益生菌组和对照组,提供可测量的结局指标,如诱导缓解率、临床复发率等;④对重复研究纳入最新发表者。排除标准:①文献综述;②非RCTs;③未提供测量方法和结局;④研究对象为妊娠或哺乳期妇女;⑤研究对象存在严重并发症或并存其他病因明确的肠道疾病。
三、文献资料提取和质量评价
绘制文献资料提取表,内容主要包括第一作者、发表时间、研究对象、干预措施、疗程、结局指标、不良反应等。由2名研究者根据文献纳入和排除标准独立筛选文献、提取文献资料、评价文献质量并交叉核对,意见不一致时向第三方咨询并协商决定。文献资料不完整时,与作者联系获取。
文献质量评价使用Cochrane Handbook 5.10[4]中的偏倚风险评估(assessing risk of bias)工具,条目包括:①随机分配方法是否正确;②是否实施分配隐藏;③对研究对象、治疗方案实施者、结局测量者、统计人员是否采用盲法;④研究结果数据是否完整;⑤是否存在选择性报告所致的偏倚;⑥是否存在其他偏倚。同时采用Jadad评分评价文献质量,≥3分考虑文献质量可。
四、统计学分析
应用Cochrane协作网提供的RevMan 5.20软件进行meta分析,计数资料计算OR值及其95% CI,P<0.05为差异有统计学意义。纳入研究间异质性的分析采用χ2检验,P>0.10且I2<50%时,认为各研究间无异质性,采用固定效应模型进行合并;二者中任一不符合条件,则采用随机效应模型进行合并。对存在异质性的研究行亚组分析和敏感性分析。
结果
一、文献检索结果
摘要共检索到国内外文献1 986篇,其中英文1 556篇,中文430篇。通过阅读文题和排除综述、评论、动物实验和非RCTs后得到62篇文献;阅读全文,根据纳入和排除标准进行筛选并剔除低质量文献,最终得到22篇RCTs[5-26],包括UC和CD患者1 870例,其中9篇为UC(8篇)或CD(1篇)活动期诱导缓解治疗,9篇为UC(4篇)或CD(5篇)缓解期维持缓解治疗,2篇为UC诱导缓解和维持缓解治疗,2篇为CD诱导缓解和维持缓解治疗;20项研究为口服给药,2项研究为经肠道给药。所有入选文献均有明确的诊断、纳入和排除标准,12篇采用随机数字表法产生随机序列,9篇实施中心隐藏,18篇采用双盲法,所有文献随访描述完整,19篇研究结果数据完整,19篇不存在选择性报告偏倚;Jadad评分5分9篇,4分5篇,3分8篇。文献基本资料见表1。
二、益生菌对UC活动期诱导缓解的疗效
共10项研究[5-14]评价了益生菌对UC活动期诱导缓解的疗效,结局指标包括诱导缓解率[5-11,13-14]和治疗应答率[8-12]。在以诱导缓解率为结局指标的9项研究中,2项因同时使用激素而予以排除(其中一项使用益生菌前还使用了抗菌药物)[6,14],其余研究中益生菌制剂包括VSL#3[7,9-10]、大肠杆菌[5,13]、乳杆菌[8]和双歧杆菌[11],对照组使用安慰剂或ASA或安慰剂+ASA和(或)免疫抑制剂。异质性检验显示各研究间存在异质性(χ2=19.97,P=0.003, I2=70%),剔除文献13行敏感性分析,异质性消除(χ2=5.25,P=0.39, I2=5%),采用固定效应模型;合并分析显示益生菌组诱导缓解率为 45.3%, 对照DB-RCT:双盲随机对照试验;EcN:大肠杆菌Nissle 1917;VSL#3:益生菌合剂;L.reuteri:罗伊乳杆菌;B.Longum:长双歧杆菌;Synergy 1:菊糖+低聚果糖;Cipro:环丙沙星(ciprofloxacin);LGG:鼠李糖乳杆菌GG(L.rhamnosusGG);L.acidophilus:嗜酸乳杆菌;B.animalissubsp.Lactis:乳双歧杆菌;6-MP:6-巯基嘌呤;AZA:硫唑嘌呤;L.johnsonii:约式乳杆菌;S.boulardii:布拉氏酵母菌组为28.3%,益生菌对UC活动期诱导缓解的疗效显著优于对照组(OR=2.34, 95% CI: 1.56~3.52,P<0.000 1)(图1)。
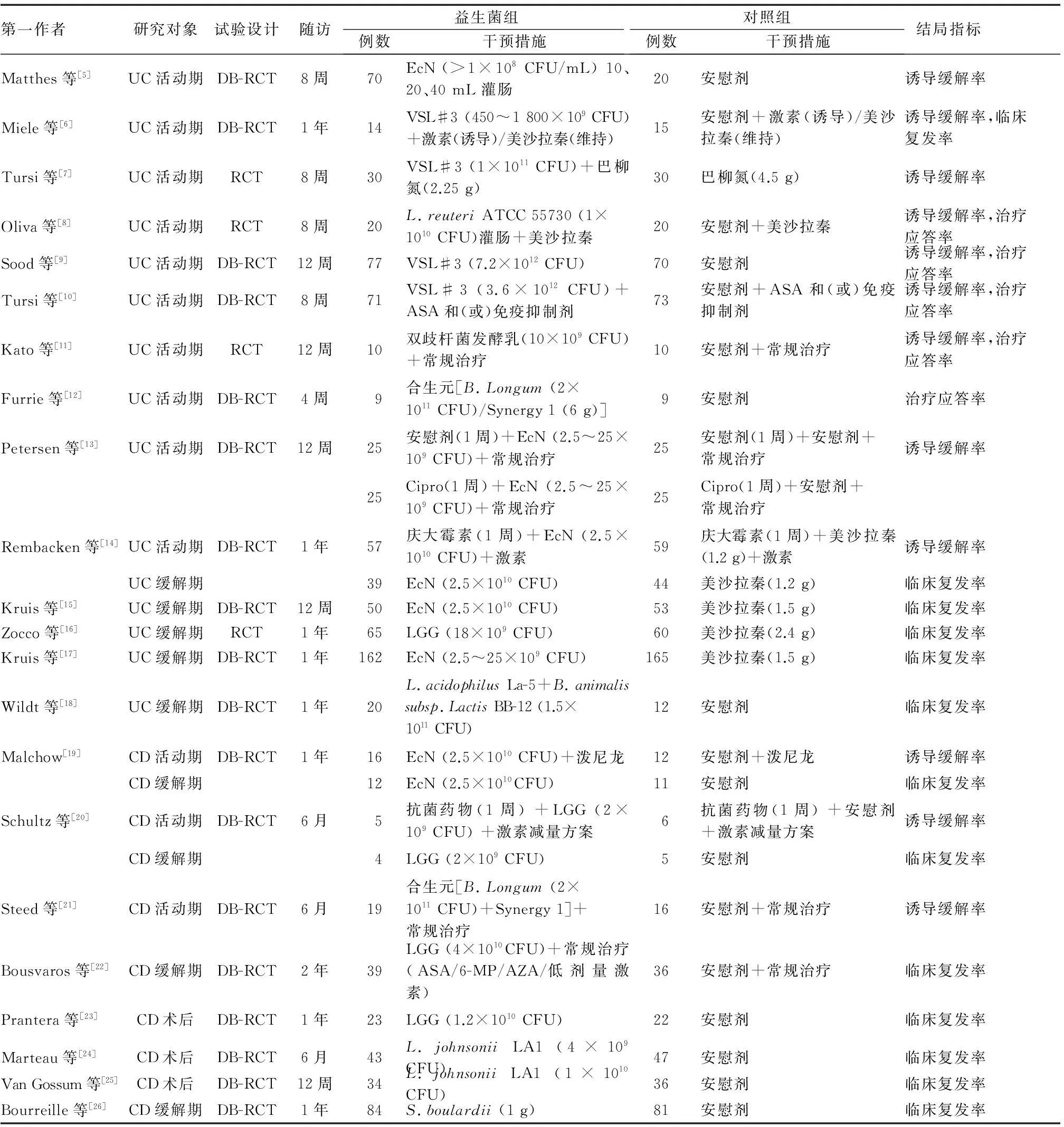
表1 纳入文献基本资料
注:表中剂量均为每日用药量
按研究对象不同(成人和儿童)行亚组分析,成人亚组各研究间无异质性(χ2=3.67,P=0.45, I2=0%),采用固定效应模型;合并分析显示益生菌组诱导缓解率显著高于对照组(46.9%对31.0%,OR=2.20, 95% CI:1.45~3.33,P=0.000 2)。儿童亚组仅有一项研究[8],该研究结果显示益生菌组诱导缓解率显著高于对照组(31%对0%,P<0.05)。
在以治疗应答率为结局指标的5项研究中,益生菌制剂包括VSL#3[9-10]、双歧杆菌[11-12]和乳杆菌[8],对照组使用安慰剂或安慰剂+ASA和(或)免疫 抑制剂。异质性检验显示各研究间无异质性(χ2=2.11,P=0.71, I2=0%),采用固定效应模型;合并分析显示益生菌组治疗应答率为50.3%,对照组为26.9%,UC活动期对益生菌治疗的应答率显著优于对照组(OR=3.18, 95% CI: 2.00~5.08,P<0.000 01)。
三、益生菌对UC缓解期维持缓解的疗效
共6项研究[6,14-18]评价了益生菌对UC缓解期维持缓解的疗效,结局指标为临床复发率,益生菌制剂包括大肠杆菌[14-15,17]、VSL#3[6]、乳杆菌[16]和乳杆菌/双歧杆菌合剂[18],对照组使用ASA和(或)安慰剂。异质性检验显示各研究间无异质性(χ2=9.07,P=0.11, I2=45%),采用固定效应模型;合并分析显示益生菌组临床复发率为29.1%,对照组为31.5%,益生菌对UC缓解期维持缓解的疗效与对照组无明显差异(OR=0.84, 95% CI: 0.59~1.21,P=0.35)(图2)。
按对照组药物不同(美沙拉秦和安慰剂)行亚组分析,两亚组各研究间均无异质性(美沙拉秦亚组:χ2=1.41,P=0.70, I2=0%;安慰剂亚组:χ2=0.49,P=0.49, I2=0%),均采用固定效应模型;合并分析显示益生菌对UC缓解期维持缓解的疗效与美沙拉秦无明显差异(OR=1.00, 95% CI: 0.68~1.45,P=0.98),但显著优于安慰剂(OR=0.15, 95% CI: 0.04~0.60,P=0.008)。
四、益生菌对CD活动期诱导缓解的疗效
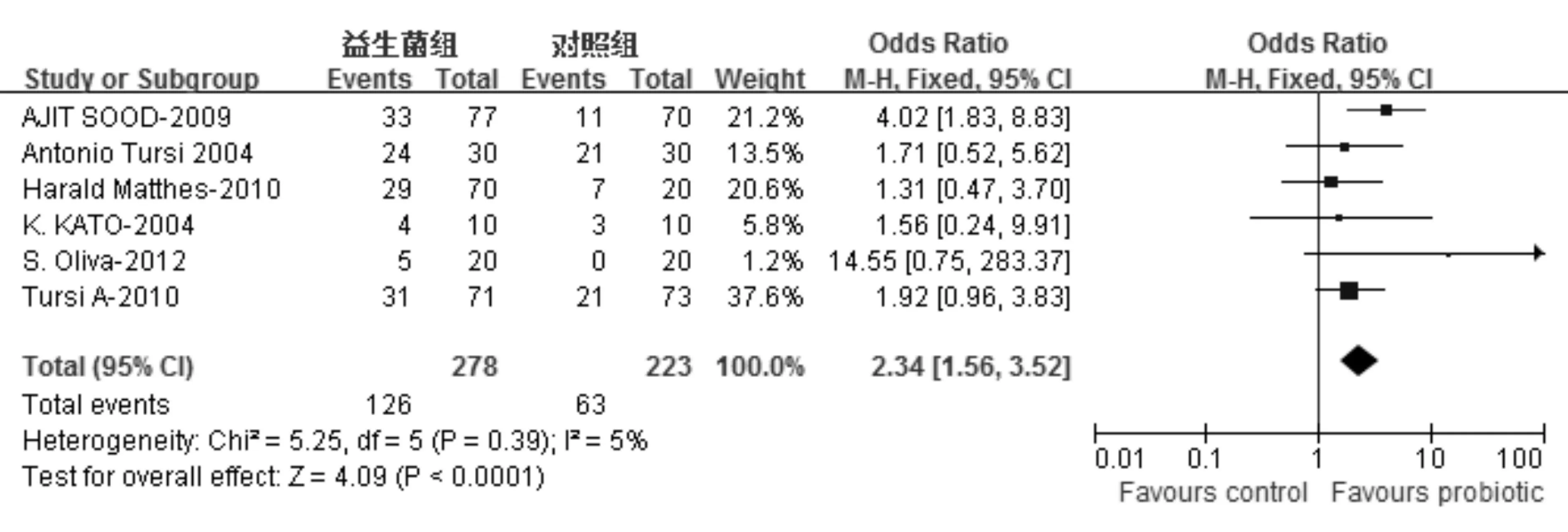
图1益生菌对UC活动期诱导缓解的疗效
仅3项研究[19-21]评价了益生菌对CD活动期诱导缓解的疗效,结局指标为诱导缓解率,益生菌制剂包括大肠杆菌[19]、乳杆菌[20]和双歧杆菌[21],对照组使用安慰剂+常规治疗(包括激素)。异质性检验显示各研究间无异质性 (χ2=1.65,P=0.44,I2=0%),采用固定效应模型;合并分析显示益生菌组诱导缓解率为60.0%,对照组为61.8%,益生菌对CD活动期诱导缓解的疗效与对照组无明显差异(OR=0.92, 95% CI: 0.32~2.64,P=0.88)(图3)。
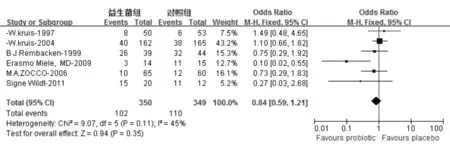
图2 益生菌对UC缓解期维持缓解的疗效
五、益生菌对CD缓解期维持缓解的疗效
共7项研究[19-20,22-26]评价了益生菌对CD缓解期维持缓解的疗效,结局指标为临床复发率,益生菌制剂包括乳杆菌[20,22-25]、大肠杆菌[19]和酵母菌[26],对照组使用安慰剂或安慰剂+常规治疗(包括激素)。异质性检验显示各研究间无异质性(χ2=5.51,P=0.48, I2=0%),采用固定效应模型;合并分析显示益生菌组临床复发率为28.0%,对照组为27.3%,益生菌对CD缓解期维持缓解的疗效与对照组无明显差异(OR=1.00, 95% CI: 0.65~1.55,P=0.98)(图4)。
六、益生菌治疗IBD的安全性
共16项研究[5-11,14-18,22-24,26]提供了益生菌治疗IBD期间不良反应发生情况的确切资料,其中2项统计的是不良事件发生率[18,24],予以排除。异质性检验显示各研究间无异质性(χ2=11.63,P=0.24, I2=23%),采用固定效应模型;合并分析显示益生菌组不良反应发生率为8.3%,对照组为8.0%,两组间无明显差异(OR=1.06, 95% CI: 0.73~1.55,P=0.76)。
七、发表偏倚分析
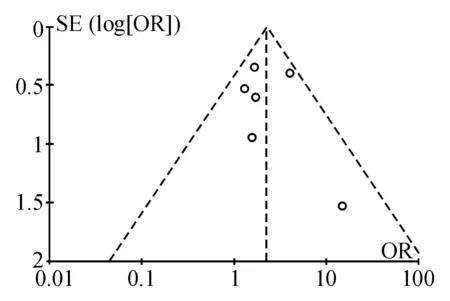
对益生菌对UC活动期诱导缓解(图5)、UC缓解期维持缓解和CD缓解期维持缓解的疗效作漏斗图分析,图示左右基本对称,提示发表性偏倚较小。益生菌对CD活动期诱导缓解的疗效分析纳入文献较少(<5个),故不作发表偏倚分析。
讨论
IBD作为一种慢性复发性疾病,临床病程常表现为发作期与缓解期交替,因此在活动期诱导缓解、在缓解期避免复发成为IBD治疗的关键。本研究系统评价了益生菌制剂对IBD的疗效,纳入22项与益生菌诱导和维持IBD缓解相关的RCTs的meta分析显示, 益生菌能有效缓解UC临床症状,提高诱导缓解率,在维持缓解、减少临床复发方面的作用与美沙拉秦相似;然而对于CD的诱导和维持缓解,益生菌疗效均不显著。
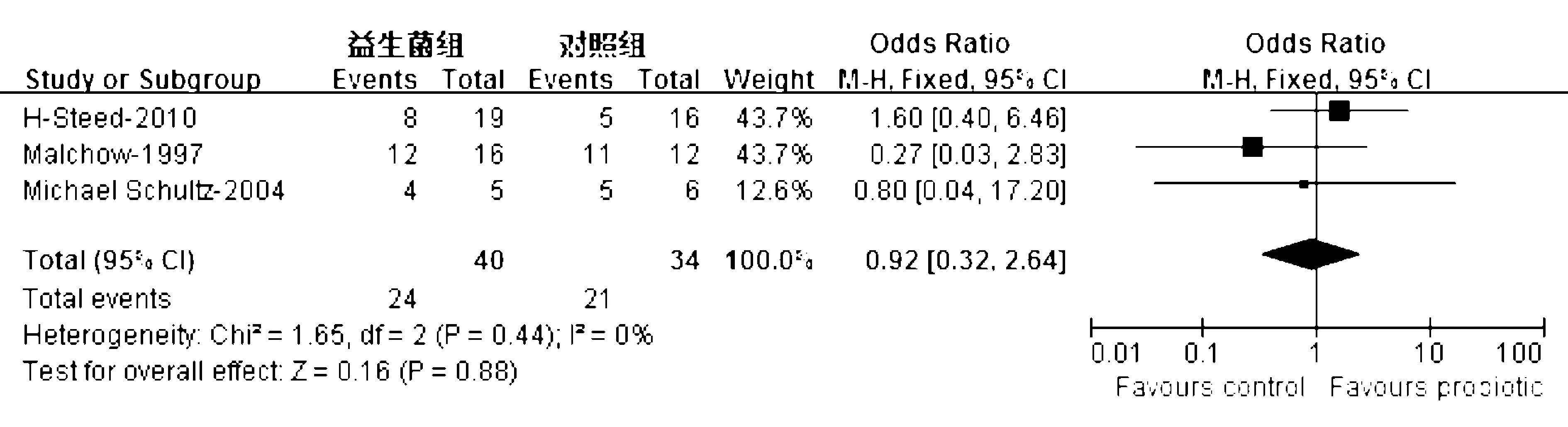
图3益生菌对CD活动期诱导缓解的疗效
近年关于益生菌制剂对UC疗效的研究较多见,本研究筛选出高质量RCTs 14篇,从活动期诱导缓解和缓解期维持缓解两方面进行分析,结果显示益生菌与安慰剂或ASA相比,在UC活动期患者中能取得优异的治疗应答率(50.3%对26.9%,OR=3.18,P<0.000 01)和诱导缓解率(45.3% 对28.3%, OR=2.34,P<0.000 1)。然而最近一项双盲RCTs发现,在UC活动期诱导缓解方面,益生菌与安慰剂相比并未显现出应有的优越性,取得的诱导缓解率甚至低于安慰剂(54%对89%)[13],作者对益生菌此种负性作用的解释为,研究使用的益生菌制剂EcN可能以共生的方式促进可能与IBD相关的致病性大肠杆菌生长,而该组患者在疗程开始前未使用抗菌药物杀灭大肠杆菌。此外,亚组分析发现在UC缓解期维持缓解方面,益生菌与美沙拉秦疗效相当。
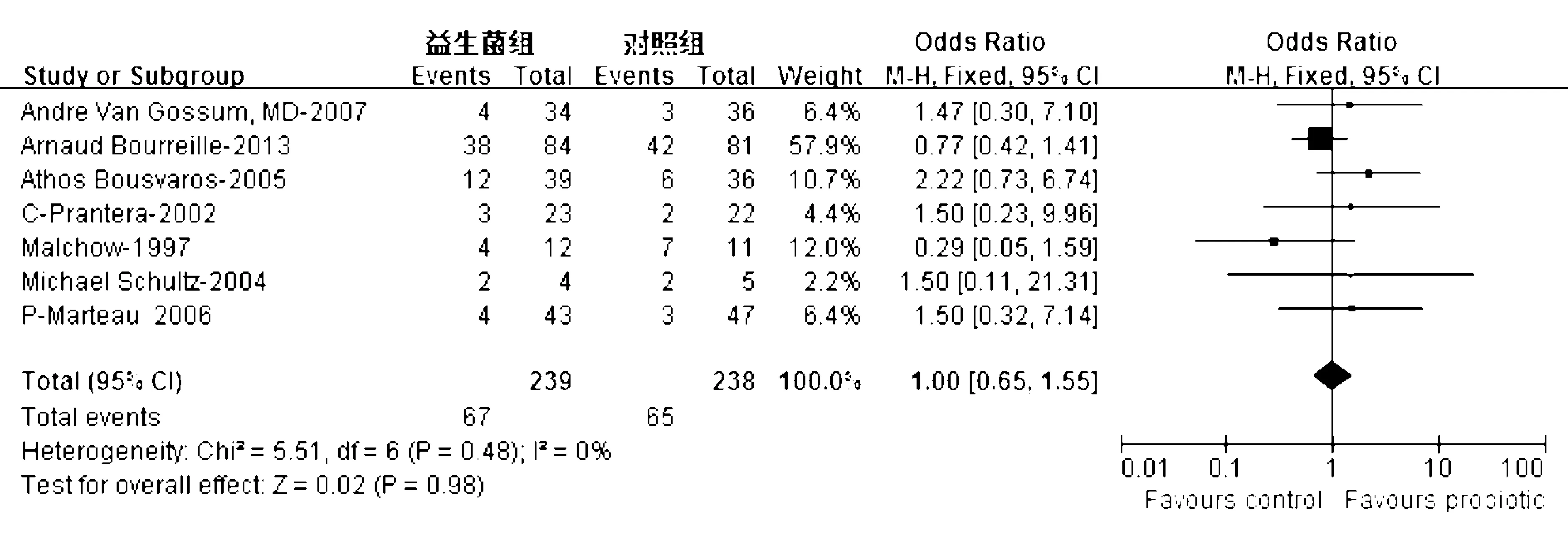
图4 益生菌对CD缓解期维持缓解的疗效
益生菌对UC活动期诱导缓解的疗效
目前关于益生菌制剂对CD疗效的研究并不多,本研究纳入高质量RCTs 8篇,同样从活动期诱导缓解和缓解期维持缓解两方面进行分析,结果显示益生菌与安慰剂相比并不增加CD活动期的诱导缓解率(60.0%对61.8%, OR=0.92,P=0.88),在降低临床复发率方面亦不存在优势(28.0%对27.3%, OR=1.00,P=0.98),提示益生菌在CD治疗中的作用有限。但本研究纳入CD诱导缓解率分析的研究数量偏少,该结果有待开展更多大样本RCTs加以证实。
通常认为益生菌制剂治疗IBD过程中的不良反应发生率低,本研究分析结果证实了这一观点。不良反应主要为腹胀、腹泻、黑便、头晕、耳鸣等且均较轻微,益生菌组与对照组相比不良反应发生率并未增加(8.3%对8.0%, OR=1.06,P=0.76),因此可以认为益生菌制剂用于治疗IBD的安全性值得信赖。
随着对IBD病理生理学研究的不断深入,越来越多的证据表明肠道菌群紊乱、侵袭性和保护性菌株失衡可能通过抗原刺激、肠黏膜免疫功能异常、肠上皮细胞代谢和肠壁通透性改变等在IBD的发生、发展中起重要作用。肠道菌群失调引起肠上皮屏障功能减退、促炎介质过表达以及保护信号缺失,一系列过度免疫应答最终导致IBD发生[27]。因此,应用益生菌制剂调节或恢复肠道菌群平衡成为新的IBD治疗手段之一,其作用机制可能包括调节肠道免疫反应和肠道菌群组成及其活性、改善肠屏障功能等多个方面,一方面通过抑制肠道内致病菌对肠上皮细胞的黏附,减少肠上皮细胞受损的机会,阻止细菌易位,避免肠道免疫细胞激活,另一方面通过调节肠上皮细胞间连接,改善肠上皮物理屏障功能。
综上所述,本研究通过系统性分析发现,益生菌在UC活动期诱导缓解和缓解期维持缓解方面均有较好疗效,对CD则未显示出治疗优势。本次meta分析的局限性主要在于各研究间益生菌制剂的种类、剂量、用法、疗程等因素不尽相同,疗效评价指标亦不完全一致,上述治疗方案和评价指标的差异可能会影响最终评价结果。今后需开展大样本、高质量、评价标准一致的RCTs以明确益生菌制剂在IBD诱导和维持缓解方面的疗效。
参考文献
1 Devkota S, Wang Y, Musch MW, et al. Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10-/- mice[J]. Nature, 2012, 487 (7405): 104-108.
2 Frank DN, Robertson CE, Hamm CM, et al. Disease phenotype and genotype are associated with shifts in intestinal-associated microbiota in inflammatory bowel diseases[J]. Inflamm Bowel Dis, 2011, 17 (1): 179-184.
3 Manichanh C, Borruel N, Casellas F, et al. The gut microbiota in IBD[J]. Nat Rev Gastroenterol Hepatol, 2012, 9 (10): 599-608.
4 Higgins JP, Green S eds. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011][S/OL]. The Cochrane Collaboration, 2011. Available from www.cochrane-handbook.org.
5 Matthes H, Krummenerl T, Giensch M, et al. Clinical trial: probiotic treatment of acute distal ulcerative colitis with rectally administeredEscherichiacoliNissle 1917 (EcN)[J]. BMC Complement Altern Med, 2010, 10: 13.
6 Miele E, Pascarella F, Giannetti E, et al. Effect of a probiotic preparation (VSL#3) on induction and maintenance of remission in children with ulcerative colitis[J]. Am J Gastroenterol, 2009, 104 (2): 437-443.
7 Tursi A, Brandimarte G, Giorgetti GM, et al. Low-dose balsalazide plus a high-potency probiotic preparation is more effective than balsalazide alone or mesalazine in the treatment of acute mild-to-moderate ulcerative colitis[J]. Med Sci Monit, 2004, 10 (11): PI126-PI131.
8 Oliva S, Di Nardo G, Ferrari F, et al. Randomised clinical trial: the effectiveness ofLactobacillusreuteriATCC 55730 rectal enema in children with active distal ulcerative colitis[J]. Aliment Pharmacol Ther, 2012, 35 (3): 327-334.
9 Sood A, Midha V, Makharia GK, et al. The probiotic preparation, VSL#3 induces remission in patients with mild-to-moderately active ulcerative colitis[J]. Clin Gastroenterol Hepatol, 2009, 7 (11): 1202-1209, 1209.e1.
10Tursi A, Brandimarte G, Papa A, et al. Treatment of relapsing mild-to-moderate ulcerative colitis with the probiotic VSL#3 as adjunctive to a standard pharmaceutical treatment: a double-blind, randomized, placebo-controlled study[J]. Am J Gastroenterol, 2010, 105 (10): 2218-2227.
11Kato K, Mizuno S, Umesaki Y, et al. Randomized placebo-controlled trial assessing the effect of bifidobacteria-fermented milk on active ulcerative colitis[J]. Aliment Pharmacol Ther, 2004, 20 (10): 1133-1141.
12Furrie E, Macfarlane S, Kennedy A, et al. Synbiotic therapy (Bifidobacteriumlongum/Synergy 1) initiates resolution of inflammation in patients with active ulcerative colitis: a randomised controlled pilot trial[J]. Gut, 2005, 54 (2): 242-249.
13Petersen AM, Mirsepasi H, Halkjr SI, et al. Ciprofloxacin and probioticEscherichiacoliNissle add-on treatment in active ulcerative colitis: A double-blind randomized placebo controlled clinical trial[J]. J Crohns Colitis, 2014, 8 (11): 1498-1505.
14Rembacken BJ, Snelling AM, Hawkey PM, et al. Non-pathogenicEscherichiacoliversus mesalazine for the treatment of ulcerative colitis: a randomised trial[J]. Lancet, 1999, 354 (9179): 635-639.
15Kruis W, Schütz E, Fric P, et al. Double-blind comparison of an oralEscherichiacolipreparation and mesalazine in maintaining remission of ulcerative colitis[J]. Aliment Pharmacol Ther, 1997, 11 (5): 853-858.
16Zocco MA, dal Verme LZ, Cremonini F, et al. Efficacy ofLactobacillusGG in maintaining remission of ulcerative colitis[J]. Aliment Pharmacol Ther, 2006, 23 (11): 1567-1574.
17Kruis W, Fric P, Pokrotnieks J, et al. Maintaining remission of ulcerative colitis with the probioticEscherichiacoliNissle 1917 is as effective as with standard mesalazine[J]. Gut, 2004, 53 (11): 1617-1623.
18Wildt S, Nordgaard I, Hansen U, et al. A randomised double-blind placebo-controlled trial withLactobacillusacidophilusLa-5 andBifidobacteriumanimalissubsp.lactisBB-12 for maintenance of remission in ulcerative colitis[J]. J Crohns Colitis, 2011, 5 (2): 115-121.
19Malchow HA. Crohn’s disease andEscherichiacoli. A new approach in therapy to maintain remission of colonic Crohn’s disease?[J]. J Clin Gastroenterol, 1997, 25 (4): 653-658.
20Schultz M, Timmer A, Herfarth HH, et al.LactobacillusGG in inducing and maintaining remission of Crohn’s disease[J]. BMC Gastroenterol, 2004, 4: 5.
21Steed H, Macfarlane GT, Blackett KL, et al. Clinical trial: the microbiological and immunological effects of synbiotic consumption - a randomized double-blind placebo-controlled study in active Crohn’s disease[J]. Aliment Pharmacol Ther, 2010, 32 (7): 872-883.
22Bousvaros A, Guandalini S, Baldassano RN, et al. A randomized, double-blind trial ofLactobacillusGG versus placebo in addition to standard maintenance therapy for children with Crohn’s disease[J]. Inflamm Bowel Dis, 2005, 11 (9): 833-839.
23Prantera C, Scribano ML, Falasco G, et al. Ineffectiveness of probiotics in preventing recurrence after curative resection for Crohn’s disease: a randomised controlled trial withLactobacillusGG[J]. Gut, 2002, 51 (3): 405-409.
24Marteau P, Lémann M, Seksik P, et al. Ineffectiveness ofLactobacillusjohnsoniiLA1 for prophylaxis of postoperative recurrence in Crohn’s disease: a randomised, double blind, placebo controlled GETAID trial[J]. Gut, 2006, 55 (6): 842-847.
25Van Gossum A, Dewit O, Louis E, et al. Multicenter randomized-controlled clinical trial of probiotics (Lactobacillusjohnsonii, LA1) on early endoscopic recurrence of Crohn’s disease after lleo-caecal resection[J]. Inflamm Bowel Dis, 2007, 13 (2): 135-142.
26Bourreille A, Cadiot G, Le Dreau G, et al; FLORABEST Study Group.Saccharomycesboulardiidoes not prevent relapse of Crohn’s disease[J]. Clin Gastroenterol Hepatol, 2013, 11 (8): 982-987.
27Clavel T, Haller D. Bacteria- and host-derived mechanisms to control intestinal epithelial cell homeostasis: implications for chronic inflammation[J]. Inflamm Bowel Dis, 2007, 13 (9): 1153-1164.
(2014-09-21收稿;2014-11-02修回)
·短篇论著·
Probiotics for Induction and Maintenance of Remission in Inflammatory Bowel Disease: A Meta-analysis
WANGXiaoteng,DAIJinfeng,LÜBin.DepartmentofGastroenterology,theFirstAffiliatedHospitalofZhejiangChineseMedicalUniversity,Hangzhou(310006)
Correspondence to: LÜ Bin, Email: lvbin@medmail.com.cn
Background: Recently, probiotics have been widely used for treatment of inflammatory bowel disease (IBD), however, the effect of probiotics on induction and maintenance of remission in IBD remains controversial. Aims: To systematically evaluate the effect of probiotics on induction and maintenance of remission in IBD. Methods: PubMed, CENTRAL, Embase, Web of Science, CNKI, CBM, and Wanfang Database were retrieved to collect the randomized controlled trials (RCTs) using probiotics for induction and/or maintenance of remission in IBD. The data were extracted and cross-checked independently by two reviewers, and the quality of trials was evaluated by the Cochrane Collaboration’s tool for assessing risk of bias and Jadad scoring. A meta-analysis was conducted by using RevMan 5.20 software. Results: Twenty-two RCTs involving 1 870 cases of ulcerative colitis (UC) and Crohn’s disease (CD) were included. Meta-analysis showed that: 1. probiotics were superior to controls in induction of remission in active UC (OR=2.34, 95% CI: 1.56-3.52,P<0.000 1); 2. probiotics were superior to placebo (OR=0.15, 95% CI: 0.04-0.60,P=0.008) but similar to mesalazine (OR=1.00, 95% CI: 0.68-1.45,P=0.98) in preventing clinical relapse in inactive UC; 3. probiotics were not superior to controls in induction of remission in active CD (OR=0.92, 95% CI: 0.32-2.64,P=0.88); 4. probiotics were not superior to controls in preventing clinical relapse in inactive CD (OR=1.00, 95% CI: 0.65-1.55,P=0.98); 5. As for incidence of adverse effects, there was no significant difference between probiotics and controls (OR=1.06, 95% CI: 0.73-1.55,P=0.76). Conclusions: Probiotics has satisfactory effect on induction and maintenance of remission in UC but has not shown significant benefit in CD.
Key wordsInflammatory Bowel Disease;Probiotics;Randomized Controlled Trial;Meta-Analysis
通信作者背景:近年来益生菌广泛应用于炎症性肠病(IBD)的治疗,但其诱导和维持缓解的疗效仍存在争议。目的:系统评价益生菌对IBD诱导和维持缓解的疗效。方法:计算机检索PubMed、CENTRAL、Embase、Web of Science、CNKI、CBM和万方数据库,收集益生菌用于IBD诱导和(或)维持缓解的随机对照试验(RCTs)。由2名研究者独立提取文献资料并交叉核对,以Cochrane偏倚风险评估工具和Jadad评分评价文献质量。应用RevMan 5.20软件进行meta分析。结果:共纳入22项RCTs,包括溃疡性结肠炎(UC)和克罗恩病(CD)患者1 870例。Meta分析显示:①UC活动期诱导缓解率:益生菌疗效优于对照组(OR=2.34, 95% CI: 1.56~3.52, P<0.000 1);②UC缓解期临床复发率:益生菌疗效优于安慰剂(OR=0.15, 95% CI: 0.04~0.60, P=0.008),与美沙拉秦无明显差异(OR=1.00, 95% CI: 0.68~1.45, P=0.98);③CD活动期诱导缓解率:益生菌疗效与对照组无明显差异(OR=0.92, 95% CI: 0.32~2.64, P=0.88);④CD缓解期临床复发率:益生菌疗效与对照组无明显差异(OR=1.00, 95% CI: 0.65~1.55, P=0.98);⑤不良反应发生率:益生菌与对照组无明显差异(OR=1.06, 95% CI: 0.73~1.55, P=0.76)。结论:益生菌在UC诱导和维持缓解方面均有较好疗效,对CD则未显示出治疗优势。
DOI:*Email: rainbowlove44@126.com
