塞来昔布联合吉西他滨动脉灌注抑制人肺癌A549细胞移植瘤的研究
2015-02-08赵保成刘洪强王赛博郑晓辉
何 阳,赵保成,刘洪强,王赛博,郑晓辉,曹 军
(上海市徐汇区大华医院,上海 200237)
塞来昔布联合吉西他滨动脉灌注抑制人肺癌A549细胞移植瘤的研究
何 阳,赵保成,刘洪强,王赛博,郑晓辉,曹 军
(上海市徐汇区大华医院,上海 200237)

目的研究塞来昔布联合吉西他滨经动脉灌注抑制人肺癌A549细胞移植瘤的作用。方法人肺癌A549细胞系经传代培养后,移植于40只祼大鼠建立肺癌裸大鼠模型。将荷瘤鼠均分为假手术组、吉西他滨组、塞来昔布组、联合组。假手术组动脉注入生理盐水0.2 mL。吉西他滨组、塞来昔布组分别经动脉灌注吉西他滨100 mg/kg及塞来昔布25 mg/kg。联合组灌注吉西他滨100 mg/kg+塞来昔布25 mg/kg。观察干预前后各组大鼠肿瘤体积的变化,计算荷瘤鼠的抑瘤率,流式细胞仪检测细胞的凋亡率,采用Western blot法检测各组Bcl-2以及Caspase-3表达情况。结果吉西他滨组、塞来昔布组和联合组的抑瘤率分别为54.18%,49.52%和88.59%;联合组移植瘤组织的Bcl-2表达量均低于其他3组(P均<0.05),Caspase-3表达量及凋亡指数均高于其他3组(P均<0.05)。结论塞来昔布与吉西他滨动脉灌注都能抑制肺癌裸大鼠移植瘤的生长,二者联合应用效果更好,诱导细胞凋亡是两者协同抗肿瘤作用的机制。
塞来昔布;吉西他滨;动脉灌注化疗;肺癌
肺癌是临床常见的恶性肿瘤之一,肺癌患者5年的生存率仅为16.1%,在癌症死亡患者中肺癌是男性第一死亡因素,是女性第三死亡因素,因此积极探寻有效的治疗方式成为研究重点[1]。环氧合酶-2(COX-2)不仅能够促进肿瘤血管和淋巴管形成,抑制肿瘤细胞凋亡,而且对促进肿瘤细胞生长、转移及将前致癌物质转化为致癌物质有主导作用。动物试验表明,选择性COX-2抑制剂塞来昔布灌胃可抑制裸鼠移植瘤的生长[2]。还有试验报道,第三代化疗药吉西他滨应用于中晚期肺癌的介入化疗中,不仅能够直接杀灭恶性肿瘤细胞,同时可抑制肿瘤血管生成,发挥间接抗肿瘤作用,且近期有效率高于第三代静脉化疗方案[3]。但是关于塞来昔布联合吉西他滨动脉灌注抑制人肺癌A549 细胞移植瘤的实验研究尚少见,为此笔者以体外实验方法进行了研究,旨在为今后从分子角度采用此种方式治疗肺癌奠定基础。
1 实验资料
1.1材料 人肺癌A549(上海市肿瘤研究所)。SPF级裸大鼠40只、BALB/C裸小鼠4只(北京智鼠多宝公司),动物合格证SYXK(沪)2007-0001,裸大鼠体质量(180±15)g,8~10周龄,雌雄各半;裸小鼠体质量(22.1±2.1)g,4~5周龄,雌雄各半。饲养相对湿度40%~50%,温度22~25 ℃,摄食、饮水自由同等。塞来昔布(辉瑞公司),吉西他滨(豪森药业)。Annexin V-FITC/PI凋亡试剂盒(上海炎彬化工科技有限公司);ECL试剂盒(BestBIO 公司),半胱氨酸蛋白酶(Caspase)-3,B淋巴细胞瘤(Bcl)-2,GAPDH 抗体(Santa cruz),鼠抗人二抗(碧云天)。
1.2方法
1.2.1细胞培养 将人肺癌A549细胞复苏,用含10%胎牛血清的DMEM培养液培养,取生长良好的细胞用0.25%胰蛋白酶消化、离心,收集细胞用1 mL冰PBS稀释成5×106mL-1,以0.2 mL接种于4只BALB/C裸小鼠右腋皮下(因为裸小鼠接种成瘤容易,直接用肺癌细胞株接种裸大鼠成瘤困难,所以先接种裸小鼠,取得足够量肿瘤组织),待肿瘤长至体积约为10 mm×10 mm×10 mm时移植于裸大鼠耳后造模。
1.2.2造模分组 将瘤结无破溃、生长良好的腋下接种荷瘤裸小鼠4只处死,无菌条件下剥离瘤结,清除坏死组织,在生理盐水中将瘤结反复剪切为2 mm×2 mm×2 mm大小的瘤组织块,然后接种于裸大鼠右耳后皮下。肿瘤于8 d后接种成功,肿瘤生长3周后体积2 650~2 800 mm3,对荷瘤裸大鼠根据性别分层后分为假手术组、吉西他滨组、塞来昔布组、联合组,每组10只。
1.2.3给药方法 用10%水合氯醛3.5 g/kg腹腔麻醉各组荷瘤大鼠,颈部正中皮肤切开,暴露右颈动脉;采用改良Seldinger技术将静脉留置针插入右颈动脉,先在C臂机DSA下使用稀释的碘克沙醇0.2 mL行手推动脉造影,诊断肿瘤的供血动脉并明确肿瘤的显影情况;再经导管灌注药物或盐水,缓慢推注,灌注时间30 s,随后缝合皮肤。假手术组经导管注入生理盐水0.2 mL,吉西他滨组予吉西他滨100 mg/kg导管灌注,塞来昔布组予塞来昔布25 mg/kg导管灌注,联合组予吉西他滨100 mg/kg、塞来昔布25 mg/kg导管灌注。
1.2.4肿瘤体积及抑瘤率测量方法 采用游标卡尺测量肿瘤长短径,肿瘤体积(mm3)=肿瘤长径×肿瘤短径2/2。用药后第16天处死各组大鼠,取出皮下肿瘤称质量,抑瘤率 =(1-药物组瘤质量/荷瘤假手术组瘤质量)×100%。计算Q值并判断两药的联合效应[4]:若E(A+B)设为两药联用抑瘤率,EA和EB为各单药抑瘤率,则Q=E(A+B)/[EA+(1-EA)×EB],Q值0.85~1.15提示两药作用相加,Q>1.15提示两药协同, Q<0.85提示两药拮抗。
1.2.5组织检测 取新鲜瘤组织,用10%甲醛溶液固定后,将肿瘤组织制成单细胞悬液,离心去除细胞碎片,收集细胞(每组至少1×106个细胞),按Annexin V-FITC/PI凋亡试剂盒说明书操作,流式细胞仪检测移植瘤细胞凋亡率。苏木素-伊红(HE)染色检测各组肿瘤细胞形态;Western blot法检测Bcl-2和Caspase-3表达水平:SDS-PAGE分离胶电泳;4%SDS-PAGE浓缩胶电泳。PVDF膜半干转100 V,30 min。5%脱脂奶粉封闭过夜。一抗1∶1 000过夜,二抗1∶5 000孵育1 h。按操作试剂盒说明操作。
2 结 果
2.1裸大鼠情况 40只裸大鼠实验完成时均存活,饮水、进食、活动状态良好,各组手术切口愈合好,均未见感染。
2.2各组荷瘤鼠肿瘤体积比较 各组移植瘤治疗前体积比较差异无统计学意义(P均>0.05)。治疗后,吉西他滨组、塞来昔布组、联合组肿瘤体积均小于假手术组(P均<0.05),吉西他滨组肿瘤体积小于塞来昔布组(P均<0.05),联合组小于吉西他滨组和塞来昔布组(P均<0.05)。见表1。
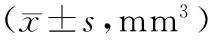
表1 治疗前后各组荷瘤鼠肿瘤体积比较
注:①与假手术组比较,P<0.05;②与联合组比较,P<0.05;③与塞来昔布组比较,P<0.05。
2.3各组移植瘤质量及抑瘤率比较 吉西他滨组、塞来昔布组、联合组移植瘤质量均明显低于假手术组(P均<0.05), 联合组明显低于吉西他滨组、塞来昔布组(P均<0.05);联合组抑瘤率明显高于吉西他滨组、塞来昔布组,其Q值>1.15。见表2。
2.4各组Bcl-2和Caspase-3蛋白表达情况 假手术组Bcl-2蛋白相对表达量为1.20±0.09,吉西他滨组为0.67±0.15,塞来昔布组为0.80±0.07,联合组为0.26±0.08, 联合组Bcl-2表达量明显低于其余3组(P均<0.05),吉西他滨组及塞来昔布组明显低于假手术组(P均<0.05)。假手术组Caspase-3蛋白相对表达量为0.53±0.05,吉西他滨组为0.99±0.06,塞来昔布组为0.87±0.03,联合组为1.46±0.18,吉西他滨组及塞来昔布组Caspase-3蛋白表达量明显高于假手术组(P均<0.05),联合组Caspase-3蛋白表达量明显高于其余3组(P均<0.05)。
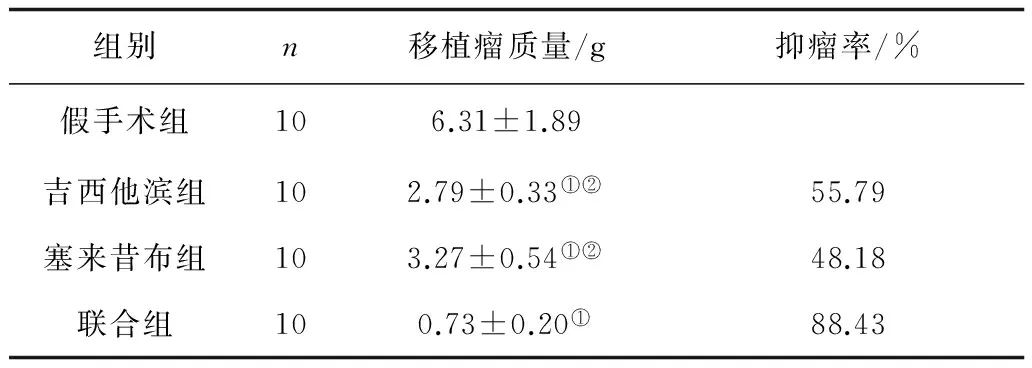
表2 各组移植瘤质量及抑瘤率比较
注:①与假手术组比较,P<0.05;②与联合组比较,P<0.05。
2.5各组肿瘤组织HE染色表现 假手术组未见明显细胞凋亡表现,见图1;吉西他滨组可见凋亡细胞致密浓缩核染色质,凋亡小体形成,核碎裂,可见较多空泡,见图2;塞来昔布组可见相应的凋亡表现,见图3;联合组上述核碎裂及空泡更加明显,见图4。
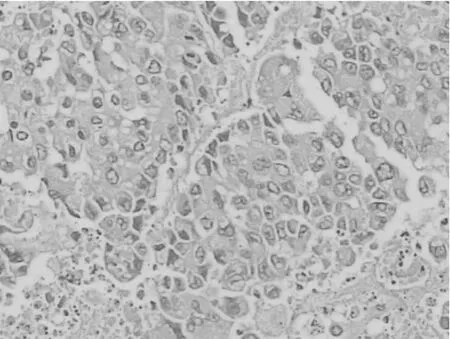
图1 假手术组HE染色表现(×200倍)
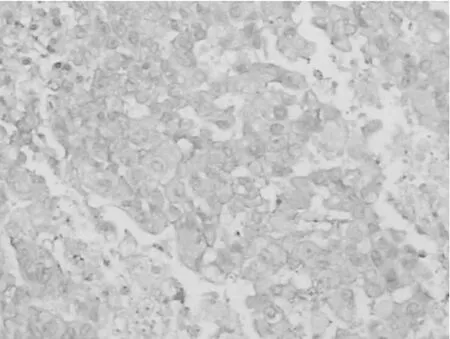
图2 吉西他滨组HE染色表现(×200倍)
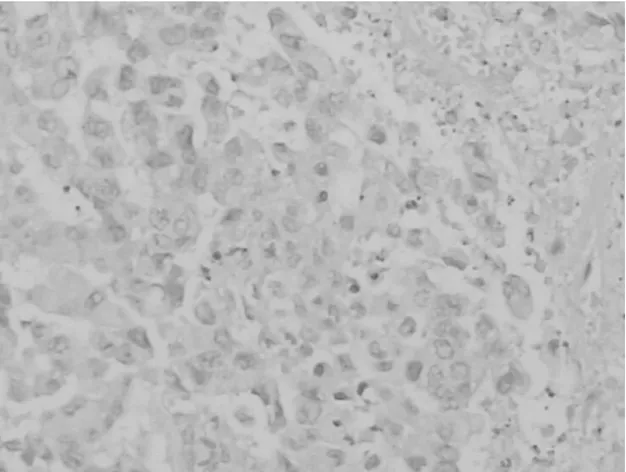
图3 塞来昔布组HE染色表现(×200倍)
2.6各组移植瘤细胞凋亡率比较 移植瘤细胞凋亡率假手术组为(4.0±1.4)%,吉西他滨组为(8.9±1.9)%,塞来昔布组为(10.5±2.7)%,联合组为(24.5±6.1)%,吉西他滨组、塞来昔布组肿瘤细胞凋亡率明显高于假手术组(P均<0.05),联合组凋亡率明显高于其余3组(P均<0.05)。

图4 联合组HE染色表现(×200倍)
3 讨 论
肺癌中约85%为非小细胞肺癌(non-smallcelllungcancer,NSCLC),就诊时多数患者为Ⅲ~Ⅳ期[5]。关于肺癌发病机制目前尚不明确,多数研究认为,瘤内血管密度与肺癌的预后密切相关,血管形成是肿瘤具有恶性特征的关键。肿瘤细胞、白细胞以及内皮细胞、上皮细胞等宿主细胞均能释放多种因子而诱导血管形成。目前研究还认为,炎症是肺癌及其他恶性肿瘤形成的关键因素,在成人肿瘤患者中有25%以上是由炎症引起的[6]。其中COX-2是目前已知的肺癌促炎因子之一,同时也是诱导肺癌转移的核心调控分子之一。COX-2基因主要定位于1号染色体的1q25.2~25.3,大约有8.3kb,编码604个氨基酸残基组成的多肽,而关于COX-2表达的调控主要是通过刺激细胞,然后经过一系列信号传导并作用在转录水平上进而诱导COX的表达,而其中的刺激因素主要有生长因子、细胞因子以及炎症递质和促癌剂等[7]。
基于肿瘤依赖于血管生成这一病理基础,抗血管生成化疗成为当前研究的热点之一。吉西他滨作为新的抗代谢类抗癌药物,其主要作用在DNA合成期和晚G1期,同时可阻止细胞从G1期到S期;其不仅能够直接杀灭恶性肿瘤细胞,而且可抑制肿瘤新生血管生成,从而发挥抗肿瘤的作用[8]。
鉴于COX-2与肿瘤的发生发展密切相关,同时COX-2的过度表达不仅不利于肿瘤的治疗,同时也将会是肿瘤耐药的相关机制。因此提出COX抑制剂可能会提高肿瘤治疗的敏感性,且对抑制肿瘤新生血管的生成有一定作用。目前多数试验研究已证实,COX-2抑制剂能够通过抑制肿瘤细胞增殖、微血管生成及诱导凋亡等作用抑制肿瘤生长。Hida等[9]研究发现,COX-2抑制剂对化疗有增敏作用,选择性COX-2抑制剂JET-522可降低多种抗肿瘤药物包括多西紫杉醇、长春瑞滨等对肺癌细胞的IC50,最多可达70%。塞来昔布是新一代高效COX-2选择性抑制剂,可通过多条途径有效地抑制宫颈癌、前列腺癌等多种恶性肿瘤细胞的生长,诱导细胞周期阻滞[10-11]。有研究表明裸鼠胰腺癌移植瘤可被塞来昔布和吉西他滨联合抑制[12]。
局部动脉灌注介入治疗是近年发展起来的一种新的治疗方式,此种治疗方式不仅能够使无法实施手术切除肿瘤患者可以重新手术切除,同时对缩小癌组织体积、降低手术难度也具有显著作用。由于肺癌组织主要由支气管动脉供血,局部动脉灌注介入治疗可使肿瘤组织的药物浓度达到静脉给药的48倍,从而提高化疗药物的治疗作用。
A549细胞裸大鼠肺癌模型便于行动脉插管及介入实验,成瘤率高,可重复性好[13]。在此模型的基础上,本研究发现吉西他滨与塞来昔布动脉给药后均能抑制细胞凋亡,上调凋亡蛋白Caspase-3 的表达,下调抗凋亡蛋白Bcl-2的表达,其中联合组效果更为明显。两者联用可能是通过上调Caspase-3表达和下调Bcl-2表达而促进A549细胞移植瘤凋亡,为二者在肺癌介入灌注治疗的临床应用提供了理论依据,但其具体机制尚需进一步研究。
[1] 我国癌症5年生存率30.9%(一)[J]. 疾病监测,2014,29(10):826
[2] 陈刚,段惠君. 不同剂量塞来昔布对人肺癌裸鼠移植瘤的治疗作用及机制研究[J]. 肿瘤,2008,28(10):837-841
[3]YuanZ,LiWT,YeXD,etal.Intra-arterialinfusionchemotherapyforadvancednon-small-celllungcancer:preliminaryexperienceonthesafety,efficacy,andclinicaloutcomes[J].JVascIntervRadiol,2013,24(10):1521-1528
[4]WangW,QinSK,ChenBA,etal.Experimentalstudyonantitumoreffectofarsenictrioxideincombinationwithcisplatinordoxorubicinonhepatocellularcarcinoma[J].WorldJGastroenterol,2001,7(5):702-705
[5]LiaoBC,LinCC,ShihJY,etal.TreatingpatientswithALK-positivenon-smallcelllungcancer:latestevidenceandmanagementstrategy[J].TherAdvMedOncol, 2015,7(5):274-290
[6] 陆俊国,杨磊,谭清和,等. 非小细胞肺癌组织COX-2和HER-2表达及其临床意义[J]. 中华肿瘤防治杂志,2010,17(3):206-208;212
[7]JiangC,WangQ,XuZ,etal.Cyclooxygenase-2knockdownusingretinoicacidchalcone(RAC),apromisingtherapeuticstrategyforcoloncancer[J].AmJCancerRes,2015,5(6):2012-2021
[8] 宫铁红,刘玉乔,马艳丽,等. 单药吉西他滨治疗老年晚期非小细胞肺癌的疗效观察[J]. 现代中西医结合杂志,2011,20(18):2240-2241
[9]HidaT,KozakiK,ItoH,etal.Significangrowthinhibitionofhumanlungcancercellsbothinvitroandinvivobythecombineduseofaselectivecyclooxygenase-2inhibitor,JTE-522,andconbentionalanticanceragents[J].ClinCancerRes,2002,8(7):2443-2447
[10]JeonYW,AhnYE,ChungWS,etal.Synergisticeffectbetweencelecoxibandluteolinisdependentonestrogenreceptorinhumanbreastcancercells[J].TumourBiol,2015,36(8):6349-6359
[11]MohammadinejadP,AryaP,EsfandbodM,etal.Celecoxibversusdiclofenacinmildtomoderatedepressionmanagementamongbreastcancerpatients:Adouble-blind,placebo-controlled,randomizedtrial[J].AnnPharmacother,2015,49(9):953-961
[12] 徐刚,吴凯,王兴鹏,等. 塞来昔布与吉西他滨合用对胰腺癌的抑制作用及其机制[J]. 中华医学杂志,2005,85(14):986-991
[13] 曹军,何阳,刘洪强,等. 肺癌A549裸大鼠移植瘤模型的建立及应用[J]. 介入放射学杂志,2014,23(10):901-905
Inhibiting effect of arterial perfusion of Celecoxib combined with Gemcitabine on A549 Cell Lines Xenograft
HE Yang, ZHAO Baocheng, LIU Hongqiang,WANG Saibo, ZHENG Xiaohui, CAO Jun
(Dahua Hospital of Xuhui District, Shanghai 200237, China)
Objective It is to compare the inhibiting effect on human lung adenocarcinoma who were treated with celecoxib combined with gemcitabine through arterial perfusion. Methods Human lung adenocarcinoma derived A549 cells were transplanted into 40 BALB/c-nu mice to establish lung cancer model. The models were divided into 4 groups: animals in sham operation group (A group)were treated with normal saline via arterial route, animals arterial perfusion with gemcitabine(B group) were treated with gemcitabine 100 mg/kg, animals arterial perfusion with celecoxib(C group) were treated with celecoxib 25 mg/kg, animals arterial perfusion with gemcitabine and celecoxib(D group)were treated with gemcitabine 100 mg/kg and celecoxib 25 mg/kg.Then dynamical change of tumor volume and tumor inhibiting rate were assessed , the inhibition rate was calculated,cell apoptosis was detected by flow cytometry,and Bcl-2 and Caspase 3 expressions were investigated using western blot. Results The inhibition rate of A group B group and C group were 54.18%,49.52% and 88.59%. Expression of Bcl-2 in lung adenocarcinoma of D group was lower than other three group(P<0.05),while expression of Caspase-3 was up regulated. Apoptotic index of lung adenocarcinoma of D group were higher than other three groups,Transplanted tumors in arterial and intravenous chemotherapy group(P<0.05). Conclusion Human lung adenocarcinoma can be inhibited by celecoxib combined with gemcitabine through arterial perfusion, synergism anti-tumor activity was happened through inducing the apoptosis of tumor cell.
celecoxib;gemcitabine;arterial chemotherapy; lung cancer
何阳,男,硕士研究生,研究方向为肿瘤微创介入。
曹军,E-mail:13611890000@163.com
上海市卫生局青年科研项目(20124Y096);上海市自然科学基金资助项目(12ZR1428900)
10.3969/j.issn.1008-8849.2015.32.003
R-332
A
1008-8849(2015)32-3542-04
2015-03-15
