α硫辛酸后处理对脓毒症大鼠急性肾损伤的影响及机制
2015-02-07李国福赵阳朱孟杰秦含玉臧彬
李国福,赵阳,朱孟杰,秦含玉,臧彬
(中国医科大学附属盛京医院ICU,沈阳 110004)
·论著·
α硫辛酸后处理对脓毒症大鼠急性肾损伤的影响及机制
李国福,赵阳,朱孟杰,秦含玉,臧彬
(中国医科大学附属盛京医院ICU,沈阳 110004)
目的探讨α硫辛酸(ALA)后处理对脓毒症大鼠急性肾损伤的影响及其可能机制。方法32只雄性SD大鼠随机分成4组:正常对照组(A组)、ALA后处理对照组(B组)、脓毒症组(C组)和脓毒症联合ALA后处理组(D组)。A、B 2组均行假手术,C、D 2组行盲肠结扎穿孔术(CLP)复制脓毒症模型。B、D 2组大鼠术后立即给予ALA 200 mg/kg灌胃。24 h后检测大鼠血清肌酐(SCr)、尿素氮(BUN)、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6-)及白细胞介素1β(IL-1β)水平,肾组织行PAS染色观察病理学改变,免疫印迹法测定NF-κB相关蛋白表达。结果脓毒症可以诱发肾脏病理学改变,与A组相比,C组SCr和BUN含量分别增加了178%和66%(P<0.01),TNF-α、IL-6及IL-1β水平分别增加55%、114%和110%(P<0.01);同时NF-κB p65的磷酸化水平(144%)和细胞核内的表达(102%)显著增加(P<0.01),并IκBα的表达下降61%(P<0.01)。早期给予ALA可以明显改善上述变化,与C组相比,D组SCr和BUN含量分别下降了48%和26%(P<0.05),TNF-α、IL-6及IL-1β水平分别降低25%、37%和40%(P<0.05);同时NF-κB p65的磷酸化水平和细胞核内的表达显著减少41%和49%(P<0.05),IκBα的相对表达水平增加103%(P<0.05)。结论ALA抑制NF-κB的活化,从而改善脓毒症相关急性肾损伤。
急性肾损伤;α硫辛酸;脓毒症;核转录因子-κB
脓毒症是指由感染引起的全身炎性反应综合征,常导致休克甚至多器官衰竭,是临床危重症最主要的死亡原因之一。尽管临床上针对重症脓毒症的医疗技术在不断改善,但全球每天仍有约14 000人死于其并发症[1,2]。脓毒症急性肾损伤(acute kidney injury,AKI)是最常见、最严重的脓毒症并发症,发病率高达50%,死亡率高达70%,是脓毒症患者死亡的最主要原因,但目前仍无有效的治疗手段[3]。α硫辛酸(α-lipoic acid,ALA)是一种公认的强抗氧化剂,在多种疾病的研究中已显示出益处。Cadiric等[4]报道ALA能减弱盲肠结扎和穿孔(caecal ligation and puncture,CLP)诱导的脓毒症大鼠的急性肺损伤并降低死亡率。但ALA在脓毒症相关肾损伤中是否具有保护作用未见相关报导。本研究拟评估ALA对脓毒症大鼠急性肾损伤的影响及可能机制。
1 材料与方法
1.1 实验动物及分组
清洁级健康雄性SD大鼠32只,由中国医科大学附属盛京医院动物实验中心提供,[SCXK(京)2009-0004],体质量200~250 g。随机分为4组:正常对照组(A组,n=8)、ALA后处理对照组(B组,n= 8)、Sepsis组(C组,n=8)及Sepsis联合ALA后处理组(D组,n=8)。本实验经中国医科大学动物实验伦理委员会批准,实验方法和目的符合人类道德伦理标准和国际惯例。
1.2 模型建立及药物处理
大鼠腹腔注射10%水合氯醛350 mg/kg麻醉后,将大鼠仰卧位四肢固定于手术台上。行腹正中切口,逐层分离皮肤、腹膜。进入腹腔,将肠道推向一侧,找到盲肠。采用经典的CLP方法复制大鼠脓毒症模型。找到盲肠后,结扎盲肠末端1/2,在结扎的盲肠末端用12号针头穿2个孔,并结扎肠系膜动脉,在盲肠末端留置4号手术线1根,打活结,可见被结扎的盲肠立即缺血变色,术毕分层缝合关腹。造模结束后,B、D 2组大鼠立即给予ALA 200 mg/kg灌胃。
1.3 检测指标和方法
1.3.1 血清肌酐(SCr)及尿素氮(BUN)测定:CLP后24 h处死大鼠,心脏取血,常温下1 500 r/min离心10 min,留取上清,按照试剂盒说明书操作,苦味酸法测定SCr,二乙酰肟法测定BUN含量。
1.3.2 肾脏病理组织学检测:取肾组织1 mm3置10%甲醛中固定,乙醇梯度脱水,石蜡包埋,切成5 μm薄片,行PAS染色,光镜下观察。
1.3.3 血清中肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)及白细胞介素1β(IL-1β)水平测定:全血标本离心取血清,按照试剂盒说明书,ELISA法测定相关指标水平。
1.3.4 Westen blot方法分析NF-κB相关蛋白表达:取各组大鼠肾组织,组织裂解液(20 mmol/L Tris-HCl,pH7.5,1%Triton,0.2 mmol/L NaCl,2 mmol/L EDTA,2 mmol/L EGTA,1 mmol/L DTT,2 mmol/L Aprotinin)裂解组织提取蛋白。蛋白定量后,40 μg上样蛋白进行10%SDS-PAGE凝胶电泳,70 V恒压转膜2.5 h后,将PVDF膜以5%脱脂奶粉室温下封闭2 h后,分别加入NF-κB抗体(1∶100)、p-p65抗体(1∶100)和IκBα抗体(1∶100),4℃孵育过夜。HRP标记的相应二抗(1∶5 000)37℃孵育45 min,化学发光(ECL)试剂显色。凝胶图像处理系统分析目标条带的光密度值,以β-actin和Lamin A为内参进行标化处理。
1.4 统计学方法
2 结果
2.1 各组SCr、BUN水平变化
A、B 2组均行假手术,B组给予ALA后与A组相比SCr、BUN无明显变化;而C组造模后24 h SCr、BUN水平与A组相比有明显升高,分别增加178%和66%,差异具有统计学意义(P<0.01);早期给予ALA处理可使SCr、BUN明显降低,与C组相比,D组SCr、BUN含量分别下降48%和26%,差异具有统计学意义(P<0.05)。见表1。

表1 各组SCr、BUN测定结果Tab.1 Results of SCr and BUN in different groups
2.2 肾脏组织病理学变化
A、B 2组大鼠的肾小管微绒毛和基底层有广泛的PAS阳性区域,表明肾脏组织具有完整的结构。而C组的形态学改变以刷状缘缺失、肾小管变性及皮质小管空泡形成为特征。早期给予ALA,即D组可以减慢CLP手术24 h后的这些病理改变的进展。见图1。
2.3 各组TNF-α、IL-6及IL-1β测定结果
C组TNF-α、IL-6及IL-1β水平与对照组相比明显升高,分别增加55%、114%和110%,差异均具有统计学意义(P<0.01),早期给予ALA处理即D组可使TNF-α、IL-6及IL-1β水平明显降低,与C组相比分别下降25%、37%和40%,差异具有统计学意义(P<0.05)。见表2。
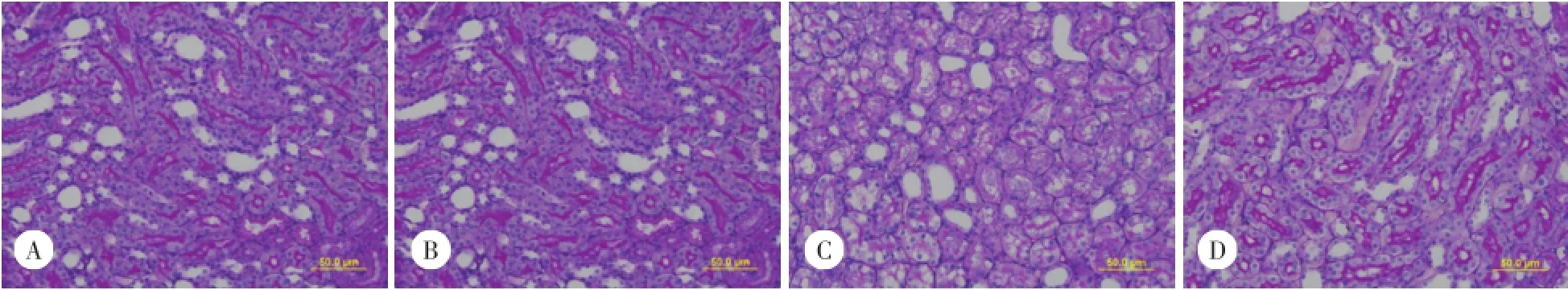
图1 肾组织PAS染色 ×200Fig.1 PAS staining of kidney×200

表2 各组TNF-α、IL-6及IL-1β测定结果Tab.2 TNF-α、IL-6 and IL-1β results in different groups
2.4 NF-κB相关蛋白表达变化
CLP手术后24 h,与A组相比,C组肾组织中NF-κB p65的磷酸化及细胞核表达显著增加,IκBα的表达水平明显降低。NF-κB p65和p-p65的相对表达量分别增加了102%和144%,IκBα的相对表达水平降低了61%,差异具有统计学意义(P<0.01)。早期给予ALA处理即D组可以明显减少NF-κB p65在细胞核中的表达及其磷酸化水平,并恢复IκBα的表达水平。与C组相比,D组NF-κB p65和p-p65的相对表达量分别降低了49%和41%,IκBα的相对表达水平增加了103%,差异具有统计学意义(P<0.05)。见图2。

图2 肾组织IκBα、p-p65和NF-κB p65的表达Fig.2 Relative expression of IκBα,p-p65 and NF-κB p65 in the kidney
3 讨论
脓毒症是AKI的常见病因,在ICU中大约有35%到50%的AKI是由于脓毒症引起的[5]。CLP诱导脓毒症模型已被广泛地用于研究预防和治疗脓毒症的新药物,它能够模拟人体疾病的病变特点以及病程[6,7]。本实验结果显示,CLP可以诱发实验大鼠肾脏明确的组织病理学损伤,术后早期给予ALA处理,明显改善了脓毒症导致的肾损伤。此外,早期的ALA处理亦显著抑制了炎性因子在血清中的表达,并且抑制了脓毒症大鼠肾组织中激活了的NF-κB通路,提示ALA对抗脓毒症导致肾损伤的可能保护机制。
ALA已被临床试验和体内研究证实是安全有效的。Cremer等[8]给大鼠灌胃ALA的LD50大于2 000 mg/kg。本研究中使用ALA 200 mg/kg给大鼠灌胃,结果表明,早期给予ALA处理降低了CLP术后脓毒症的死亡率,降低了血清Cr和BUN水平,并减弱肾的组织损伤。ALA在本研究中观察到的有益作用,与先前研究结果[9]ALA具有针对不同的急慢性肾病的明显的保护作用相一致。因此,本研究不仅进一步证明了ALA对于脓毒症相关多器官功能障碍的治疗效果,同时也表明,未来对ALA治疗潜力的深入研究将是值得的。
研究发现血液中TNF-α在炎性反应或内毒素休克时出现较早,并迅速达到高峰,从而诱发“次级”细胞因子如IL-1β、IL-6及趋化因子IL-8等的产生[10,11]。大量炎性因子的释放引起毛细血管的通透性增加,血中白细胞增多、渗出、聚集,最终导致全身炎性反应综合征(SIRS)。多种炎性介质的释放及其所导致的SIRS或抗炎性反应综合征,是促进休克恶化甚至发展为多器官功能不全综合征及引起死亡的重要因素之一[12]。本研究发现,在大鼠CLP造模之后,血清中TNF-α,IL-6和IL-1β的增加被早期给予ALA显著抑制。这些数据表明,ALA减少CLP术后释放的炎性因子,减轻肾损伤,提高生存率。
NF-κB是一个重要的转录因子,抑制NF-κB活性可使脓毒性休克时的促炎性因子的产生减少,从而减少多器官衰竭的发生并降低病死率[13,14]。临床上,在急性炎症和脓毒症患者中,NF-κB与DNA结合活性增强,并与临床严重程度以及致死率相关[15]。而抑制NF-κB通路在预防或治疗人类疾病中是必不可少的[16,17]。这些发现促使我们研究ALA是否减少CLP模型中NF-κB在肾组织中的活化。本研究中,CLP术后大鼠肾组织中的NF-κB p65的磷酸化及细胞核表达显著增加,早期的ALA处理显著抑制了NF-κB的活化。这表明ALA在抗氧化,阻止炎性疾病发生发展的治疗效果可能与抑制NF-κB活化有关。
本研究仍有一些局限性。各组动物的数目相对较少,可能增加统计数据的偏倚;其次,研究只关注了CLP手术后24 h的肾组织变化,并且ALA在其他时间点是否有类似的益处还有待进一步研究。
综上所述,ALA后处理在CLP手术诱导的脓毒症大鼠中,减轻急性肾损伤,其可能机制是通过减少炎性因子的释放和抑制NF-κB的活化。
[1]Fry DE.Sepsis,systemic inflammatory response,and multiple organ dysfunction:the mystery continues[J].Am Surg,2012,78(1):1-8.
[2]Dombrovskiy VY,Martin AA,Sunderram J,et al.Rapid increase in hospitalization and mortality rates for severe sepsis in the United States:a trend analysis from 1993 to 2003[J].Crit Care Med,2007,35(5):1244-1250.
[3]Holthoff JH,Wang Z,Patil NK,et al.Rolipram improves renal perfusion and function during sepsis in the mouse[J].J Pharm Expe Thera,2013,347(2):357-364.
[4]Cadirci E,Altunkaynak BZ,Halici Z,et al.Alpha-lipoic acid as a potential target for the treatment of lung injury caused by cecal ligation and puncture-induced sepsis model in rats[J].Shock,2010,33(5):479-484.
[5]孟广蕊,李春盛.肾损伤分子-1对于脓毒症相关肾损伤的早期预测价值[J].首都医科大学学报,2012,33(3):394-398.
[6]Hubbard WJ,Choudhry M,Schwacha MG,et al.Cecal ligation and puncture[J].Shock,2005,24(Suppl 1):52-57.
[7]Doi K,Leelahavanichkul A,Yuen PS,et al.Animal models of sepsis and sepsis-induced kidney injury[J].J Clin Invest,2009,119(10):2868-2878.
[8]Cremer DR,Rabeler R,Roberts A,et al.Safety evaluation of alphalipoic acid(ALA)[J].Regul Toxicol Pharmacol,2006,46(1):29-41.
[9]Veljkovic AR,Nikolic RS,Kocic GM,et al.Protective effects of glutathione and lipoic acid against cadmium-induced oxidative stress in rat's kidney[J].Ren Fail,2012,34(10):1281-1287.
[10]何双双,林春水,古妙宁,等.盐酸戊乙奎醚对失血性休克-内毒素二次打击大鼠肾损伤的保护作用[J].南方医科大学学报,2011,31(5):899-902.
[11]Walley KR,Lukacs NW,Standiford TJ,et al.Balance of inflammatory cytokines related to severity and mortality of murine sepsis[J]. Infect Immun,1996,64(11):4733-4738.
[12]Huang W,Tang Y,Li L.HMGB1,a potent proinflammatory cytokine in sepsis[J].Cytokine,2010,51(2):119-126.
[13]Collins T,Read MA,Neish AS,et al.Transcriptional regulation of endothelial cell adhesion molecules:NF-kappa B and cytokine-inducible enhancers[J].FASEB J,1995,9(10):899-909.
[14]Liu SF,Malik AB.NF-kappa B activation as a pathological mechanism of septic shock and inflammation[J].Am J Physiol Lung Cell Mol Physiol,2006,290(4):L622-645.
[15]Arnalich F,Garcia-Palomero E,Lopez J,et al.Predictive value of nuclear factor kappa B activity and plasma cytokine levels in patients with sepsis[J].Infect Immun,2000,68(5):1942-1945.
[16]Ying Z,Kampfrath T,Sun Q,et al.Evidence that alpha-lipoic acid inhibits NF-kappa B activation independent of its antioxidant function[J].Inflamm Res,2011,60(3):219-225.
[17]Yoo TH,Lee JH,Chun HS,et al.alpha-Lipoic acid prevents p53 degradation in colon cancer cells by blocking NF-kappa B induction of RPS6KA4[J].Anticancer Drugs,2013,24(6):555-565.
(编辑 裘孝琦)
Efficacy ofα-Lipoic Acid Treatmenton Sepsis-induced Acute Kidney Injury in Ratsand Its Mechanisms
LIGuo-fu,ZHAOYang,ZHUMeng-jie,QIN Han-yu,ZANGBin
(DepartmentofCriticalCare Medicine,Shengjing Hospital,China MedicalUniversity,Shenyang 110004,China)
ObjectiveTo investigate the impact of α-lipoic acid(ALA)treatment on sepsis-induced acute kidney injury in rats and explore the mechanisms.MethodsA total of 32 male SD rats were randomized into 4 groups:normal control group(group A),ALA-treated control group(group B),sepsis group(group C)and sepsis with ALA treated group(group D).Group A and B underwentsham operation,while CLP operations were conducted in group C and D.Rats in both group B and group D were then administered with 200 mg/kg ALA by oral gavage immediately after the surgicalprocedure.Twenty-fourhours afterthe surgicalprocedure blood sampleswere obtained forthe evaluation ofcreatinine,BUN,TNF-α,IL-6 and IL-1β.Ratkidneys were rapidly removed forPAS stain.Western blotwas employed to determine the expression ofNF-κB.ResultsPathologicalchanges ofkidney were induced by sepsisand the levelofcreatinine,BUN,TNF-α,IL-6 and IL-1βwere significantly increased by 178%,66%,55%,114%and 110%(P<0.01).respectively;simultaneously the phosphorylation and nuclear expression of NF-κB p65 in kidney tissues were significantly increased by 144%and 102%(P<0.01).Sepsis-induced acute kidney injury also significantly reduced the expression of IκBα by 61%(P<0.01).These changes were significantly suppressed by early ALA treatment.Compared with C group,the level of creatinine,BUN,TNF-α,IL-6 and IL-1β were significantly decreased by 48%,26%,25%,37%and 40%(P<0.05),respectively,and the relative expression of IκBα was increased by 103%(P<0.05).ConclusionThe present study demonstrated that ALA can suppress the activation of NF-κB,thus ameliorating sepsis-related acute kidney injury.
acute kidney injury;α-lipoic acid;sepsis;NF-κB
R692.5
A
0258-4646(2015)07-0557-04
国家自然科学基金(81471847);辽宁省自然科学基金(2014021003);沈阳市科学技术项目计划(F14-158-9-40)
李国福(1968-),男,教授,博士.
E-mail:ligf@sj-hospital.org
2014-12-15
网络出版时间:
