介孔二氧化硅/β-环糊精修饰传感器测定柔红霉素
2015-02-02马腾飞刘桂华黄杉生
马腾飞,刘桂华,黄杉生
(上海师范大学生命与环境科学学院,上海201418)
介孔二氧化硅/β-环糊精修饰传感器测定柔红霉素
马腾飞,刘桂华,黄杉生*
(上海师范大学生命与环境科学学院,上海201418)
以介孔二氧化硅、超分子β-环糊精修饰玻碳电极制备新型柔红霉素电化学传感器。采用X-射线衍射、原子力显微镜及场发射扫描电镜对修饰材料及修饰电极进行表征;以循环伏安法和电化学交流阻抗等方法研究修饰电极的电化学特性。由于介孔二氧化硅较大的比表面积和β-环糊精对柔红霉素的特异性结合,该修饰电极对于柔红霉素有较好的电流响应。在优化实验条件下,该传感器对柔红霉素的响应范围分为两部分:1.0×10-6~5.0×10-5mol/L,线性相关系数r=0.9950;5.0×10-5~2.5×10-4mol/L,线性相关系数r= 0.9990。检测限为2.0×10-7mol/L(信噪比S/N=3)。
介孔二氧化硅;β-环糊精;柔红霉素;电化学传感器
0 引言
随着人类生存环境的恶化,各类癌症发生率越来越高,人们也致力于寻找更多更有效的对抗肿瘤的手段。目前,最常用也被认为最有效的是化学药物疗法[1]。柔红霉素(DNR)是一种典型的蒽环类抗肿瘤抗生素,对造血系统肿瘤和实体肿瘤具有高效作用,在临床化疗方案中呈现出明显的剂量一效应性关系,对于在年轻人群中发病率高而且有望治愈的肿瘤,如急性白血病、恶性淋巴瘤霍奇金淋巴瘤以及乳腺癌等疾病具有不可替代的作用[2]。目前常用检测手段是高效液相色谱法[3],另外还有毛细管电泳法[4]、极谱法[5]、HPLC-MS联用法[6]、分光光度法[7]、荧光法[8]等用于这类药物的分析,也有采用电化学方法测定。已有方法各有优缺点,发展一种能够高效精确检测柔红霉素的方法无论对药物分析还是药物筛选及临床有效用药都具有重要意义。
介孔二氧化硅(SBA-15)常被用作生物活性物质包埋剂。具有稳定有序的介孔结构、有利于吸附或包裹大量的分子、较大的比孔容积以及巨大的比表面积、无毒、可降解性和良好的生物兼容性等特点,常被应用于生物和医药学、环境治理等领域。
β-环糊精(β-CD)具有内疏水外亲水的空腔结构,常被用作包合剂,可与许多客体分子形成包合物。Pattarapond Gonil等利用β-环糊精的客体识别性能包合壳聚糖(CS),形成环糊精壳聚糖包合物(CD-g-CS),然后在中性条件下利用失水甘油基三甲基氯化胺碱化包合物CD-g-CS,形成了碱化环糊精壳聚糖包合物QCD-g-CS,该化合物表现出了更强的抗菌性[9]。
该文合成了SBA-15,将SBA-15和β-环糊精(β-CD)自组装到玻碳电极(GCE)的表面,采用循环伏安、交流阻抗、微分脉冲伏安法等化学方法对修饰电极电化学特性进行了表征。传感器用于柔红霉素(DNR)的测定,结果满意。
1 实验部分
1.1 主要仪器与试剂
电化学试验均在CHI760C电化学分析仪(上海辰华仪器公司,中国)进行,采用三电极体系:以修饰的玻碳电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为辅助电极。透射电子显微镜采用JEOL-2100型(TEM,日本JEOL公司),X射线衍射仪采用 Rigaku Corporation SA-HF3(XRD,日本Rigaku公司),原子力显微镜采用NanoScopeⅢa型 SPM 系 统 (AFM,Digital Instruments Bruker AXS GmbH),紫外-可见分光光度计为UV-1800型(UV-Vis,日本岛津公司),扫描场发射电镜为 S-4800型场扫描电镜(FESEM,日本Hitachi公司)。
Tris-HCl、浓硫酸、氯化钾以及氯金酸购自(上海)化学试剂有限公司,β-环糊精来自国药集团,柔红霉素对照品来自上海创赛科学仪器有限公司,注射用盐酸柔红霉素来自浙江海正药业有限公司;原硅酸四乙酯、聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物(EO20PO70EO20,Pluronic P123)购自于Aldrich公司。其余试剂购自上海润捷化学试剂有限公司;实验中所用试剂级别均为分析纯,实验用水为Milli-Q18.2MΩ超纯水。
1.2 介孔二氧化硅的制备及表征
介孔二氧化硅(SBA-15)依据文献[10-11]报道的方法进行制备。以Pluronic P123(1.0 g)为模版剂,加入H2O(10.0 g)和2 mol/L HCl(30.0 g),在室温下搅拌至澄清后,加入TEOS(2.1 g)作为硅源剂,搅拌20 min形成均一混合液。混合液转移至聚四氟乙烯内衬的结晶釜中,35℃静置条件下陈化24 h后,在80℃静置结晶48 h。混合液经过滤除去母液,以超纯水洗涤,100℃烘干6 h。所得产物悬浮于乙醇-HCl混合液中1 h以除去模版。混合液过滤,以超纯水洗涤至pH值接近中性,80℃烘干24 h。之后在550℃焙烧8 h,研磨,得到有序的、孔连通性较好的SBA-15。将制备所得SBA-15粉末以H2O为溶剂超声1 h分散均匀备用。
制得的介孔二氧化硅以X-射线衍射(XRD,图1)、场发射扫描电镜(FESEM,图2)和透射电镜(TEM,图3)进行结构确证和形貌表征,结果表明该工作成功获得所需SBA-15。其颗粒直径约为500 nm,比表面积约为800 cm2/g,介孔尺寸为约为5 nm。1.3 电极的制备

图1 SBA-15的XRD图Fig.1 XRD image of SBA-15
玻碳电极(GCE)依次用1.0 μm,0.3 μm,和0.05 μm α-氧化铝粉末在麂皮上抛光打磨至形成平整光滑的表面。之后用去离子水冲洗干净,依次在硝酸-乙醇(V∶V=1∶1)和超纯水中分别超声15 min,取出室温晾干,置于0.5 mol/L的硫酸中采用循环伏安法活化至峰电流平稳。将介孔二氧化硅0.0050 g分散在25 mL纯水中超声1 h,分散均匀后,取6 μL滴加到新处理好的玻碳电极表面,40℃条件下烘干后,在电极表面形成一层SBA-15膜,以去离子水洗涤除去表面未结合的SBA-15,得到修饰有介孔二氧化硅的电极,标记为SiO2/GCE。以H2O为溶剂配置浓度为1 mmol/L的β-环糊精溶液,将修饰电极浸入其中静置,取出,室温晾干,β-环糊精通过氢键作用结合到介孔二氧化硅表面,以超纯水冲洗表面未结合的β-环糊精,将所得电极记为β-CD/SiO2/GCE。

图2 SBA-15的FESEM图Fig.2 FESEM image of SBA-15

图3 SBA-15的TEM图Fig.3 TEM image of SBA-15

图4 裸GCE的AFM图(a),修饰有SBA-15的SiO2/GCE电极的AFM图(b),修饰β-CD后的β-CD/SiO2/GCE电极的AFM图(c)Fig.4 AFM images of the different modified electrode GCE(a),SiO2/GCE(b),β-CD/SiO2/GCE(c)
2 结果与讨论
2.1 逐层修饰电极的形貌及电化学表征
原子力显微镜(AFM)是一种高分辨的扫描探针显微镜,可以提供真正的三维表面图。图4为采用原子力显微镜获得的每一层修饰电极的形貌图。从图4a中,可明显看出,裸玻碳电极(GCE)为光滑的平面。修饰SBA-15后,可明显看到电极表面形貌发生较大变化(图4b),说明介孔二氧化硅成功修饰到了电极表面。图4c显示,以β-环糊精修饰电极之后,电极表面形貌进一步发生明显变化。图4从表面形态上证明电极的每一层修饰都是成功的。
图5为逐层修饰电极在1 mmol/L[Fe(CN)6]4-/3-(含0.1 mmol/L KCl)溶液中获得的循环伏安曲线。由于不同电极其界面电子转移阻值不同,其对应的循环伏安曲线中峰电流也会发生相应变化,Ret值越大则对应峰电流越小。裸GCE的循环伏安曲线峰电流最大 (图5曲线a)。而SiO2/ GCE电极由于二氧化硅膜骨架阻力作用,电子传导能力最弱,峰电流最小(图5曲线b)。进一步修饰β-CD后,峰电流亦响应增大(图5曲线c)。传感器的峰电流变化趋势与交流阻抗相一致,进一步说明电极的每层修饰都是成功的。
2.2 柔红霉素与β-CD结合的紫外-可见分光光度法表征
柔红霉素(DNR)为经典蒽醌类药物,其蒽醌结构可插入β-环糊精的疏水空腔结构中,造成柔红霉素紫外-可见吸收光谱 (UV-Vis吸收光谱)的改变(图6)。浓度为0.01 mol/L的柔红霉素水溶液在波长为480 nm~500 nm范围内有一强宽吸收峰(图6曲线a),是由蒽醌结构中共轭π键电子发跃迁而产生的光吸收,其摩尔吸光系数ε>10000[12]。而β-环糊精由多个D-β比喃葡萄糖单元构成的多糖,分子中不含有共轭不饱和生色基团,故在300 nm~700 nm区间不产生光吸收。图6曲线b为加入β-环糊精之后0.01 mol/L的柔红霉素水溶液(含β-CD 0.02 mol/L)的紫外-可见吸收光谱,在最大吸收峰480 nm~500 nm范围吸收强度明显增加,530 nm处有一肩峰,吸收强度亦增加。这可能是由于柔红霉素嵌入β-环糊精疏水内腔后,对柔红霉素产生增色效应,使其光吸收强度增加。由图6可说明柔红霉素和β-环糊精发生了静电结合作用。

图5 GCE(a)、SiO2/GCE(b)、β-CD/SiO2/GCE(c)在1 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)(0.1 mmol/L KCl)溶液中的循环伏安曲线Fig.5 Cyclic voltammograms of the different modified electrode in 1 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1) (0.1 mmol/L KCl)solution(a)GCE,(b)SiO2/GCE, (c)β-CD/SiO2/GCE

图6 DNR溶液(0.01mol/L)UV-Vis吸收谱图(a)和DNR/β-CD(0.01(mol/L)/0.02(mol/L))溶液的UV-Vis吸收谱图(b)Fig.6 UV-Vis spectra of 0.01mol/L DNR(a)and 0.01 (mol/L)/0.02(mol/L)DNR/β-CD(b)
2.3 柔红霉素(DNR)在电极上的电化学行为
图7为裸GCE和β-CD/SiO2/GCE在含DNR 0.02 mmol/L的Tris-HCl溶液 (0.1 mmol/L;pH= 7.0)中的循环伏安图。结果显示,与DNR在裸GCE上-0.65 V处的还原峰(图7 a)相比,其在β-CD/SiO2/GCE上的还原峰信号(图7 b)明显增强,峰形更好,且出峰位置正移约0.5 V。说明介孔二氧化硅/β-环糊精修饰电极对DNR有强响应。
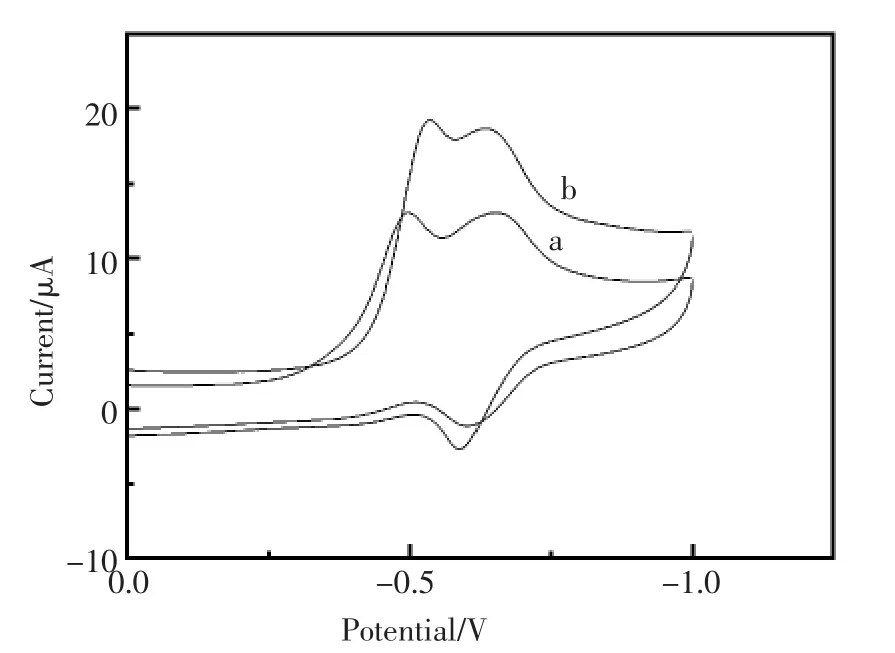
图7 裸GCE(a)和修饰电极β-CD/SiO2/GCE(b)在含DNR 0.02 mmol/L的Tris-HCl溶液(0.1 mmol/L;pH=7.0)中的循环伏安图Fig.7 Cyclic voltammograms of the different modified electrode in 0.02 mmol/L DNR(0.1 mmol/L Tris-HCl;pH=7.0) (a)GCE,(b)β-CD/SiO2/GCE
2.4 扫速对DNR电化学信号的影响
图 8为 β-CD/SiO2/GCE在含 DNR 0.02 mmol/L的Tris-HCl溶液(pH=7.0)中,不同的电位扫描速度下的循环伏安图。由图可见,氧化峰电流均随着扫速的增加而增加,但其峰电位基本不变。内插图为氧化峰电流与扫速的线性关系图,线性回归方程为Ipc(μА)=-17.511υ(mV/s)+ 0.039,r=0.9996。由此说明,在100 mV/s~600 mV/s范围内,氧化峰电流与扫描速度成良好的线性关系,该反应为表面控制的电极反应过程。
2.5 β-环糊精修饰时间对DNR电化学信号的影响

图8 修饰电极β-CD/SiO2/GCE在0.02 mmol/L DNR(0.1 mmol/L Tris-HCl;pH=7.0)中不同扫速的循环伏安图Fig.8 Cyclic voltammograms of the β-CD/SiO2modified electrode in 0.02 mmol/L DNR(0.1 mmol/L Tris-HCl; pH=7.0)at various scan rates

图9 SiO2/GCE在β-环糊精溶液(1 mmol/L)中分别修饰20 min、40 min、60 min、80 min后,在0.02 mmol/L DNR(0.1 mmol/L Tris-HCl;pH=7.0)中的循环伏安图;内插图:峰电流与β-CD修饰时间的关系图Fig.9 Cyclic voltammograms of the β-CD/SiO2modified electrode at different assembly time:20 min,40 min, 60 min,80 min in 0.02 mmol/L DNR(0.1 mmol/L Tris-HCl;pH=7.0)solution.Inset:plots of peak currents versus modified time
考察了电极在β-环糊精修饰液中浸泡时间对DNR电化学信号的影响(图9,内插图为氧化峰电流随β-CD修饰时间的变化)。将修饰电极SiO2/GCE浸入1 mmol/L的β-环糊精修饰液中,室温静置,分别组装20 min、40 min、60 min、80min。在含 DNR 0.02 mmol/L的 Tris-HCl溶液(pH=7.0)中测定。结果显示,当组装时间为40 min时,修饰效果最好,氧化峰电流达到最大值。这可能是由于当时间少于40 min时,β-CD组装量未能完全覆盖SiO2/GCE表面结合位点,有效表面积未能达到最大值,电化学信号响应值较小;而当修饰时间过长(>40 min)时,β-CD结合量过多,导致SiO2/GCE上介孔二氧化硅间隙及介孔通道堵塞,溶液中DNR未能与内部β-CD有效结合产生电化学反应信号,从而导致电极有效表面积下降。因此,可认为组装40 min为β-CD最佳修饰时间。

图10 β-CD/SiO2/GCE在pH=5.0、6.0、6.5、7.0、7.5、8.0的0.02 mmol/L DNR(0.1 mmol/L Tris-HCl;pH=7.0)溶液中的循环伏安图;内插图:峰电流与pH值的关系图Fig.10 Cyclic voltammograms of the β-CD/SiO2modified electrode at different pH:5.0、6.0、6.5、7.0、7.5、8.0 in 0.02 mmol/L DNR(0.1 mmol/L Tris-HCl;pH=7.0)solution.Inset:plots of peak currents versus pH
2.6 待测液pH值对电化学信号的影响
通常电极的氧化还原反应过程会有质子和电子的参与,因此待测液的pH值往往对电化学信号有一定影响。图10为β-CD/SiO2/GCE分别在pH值为5.0、6.0、6.5、7.0、7.5、8.0的底液中(含DNR 0.02 mmol/L)的循环伏安图,内插图为氧化峰电流与溶液pH值之间的关系图。如图所示,当溶液pH值在5.0~7.5范围内,氧化峰电流随着pH值的增加而增大,当pH值增大到8.0时氧化峰电流开始减小。同时,随着pH值的增大,氧化峰位置发生负移。以上结果显示,当溶液pH值为7.5时,修饰电极对DNR的响应值最大,故后续工作的DNR溶液pH值控制为7.5。
2.7 修饰电极对DNR的检测限及线性
图11为修饰电极β-CD/SiO2/GCE对一系列浓度DNR(pH=7.5)的DPV电流响应值。从图中可以看出,当DNR浓度低于50 μmol/L时,其电流响应值随着DNR浓度增加而迅速增加并成良好线性关系 (左上内插图)。在50 μmol/L~250 μmol/L范围内,DPV响应电流依然成良好线性关系(右上内插图)。当DNR浓度高于250 μmol/L,其电流响应值达到饱和,不再有明显变化。图11内插图显示了该传感器对不同浓度的DNR响应电流与浓度的线性校正关系。该线性范围分为两部分:1.0×10-6~5.0×10-5mol/L,线性相关系数r=0.9950;5.0×10-5~2.5×10-4mol/L,线性相关系数r=0.9990。检测限为2.0×10-7mol/L(信噪比S/N=3)。
2.8 修饰电极的重现性、稳定性及抗干扰实验
维持试液中柔红霉素浓度为1.0×10-5mol/L,分别加入甘露醇800 μmol/L、尿酸400 μmol/L之后测定,发现甘露醇、尿酸对柔红霉素的检测几乎没有干扰。相同方法制备的5支电极对同一浓度的柔红霉素进行检测,RSD为1.52%。修饰电极对同一浓度柔红霉素(25 μmol/L、100 μmol/L)连续测定20圈后的电流响应值仍保持原来的95%以上。该传感器为无酶传感器,不存在酶对环境要求较高等不利因素,所以电极有很好的稳定性且易于保存。
2.9 DNR传感器的初步应用
注射用盐酸柔红霉素制剂含两种成分,盐酸柔红霉素和辅料D-甘露糖醇,药品标准为每支含盐酸柔红霉素20 mg(效价)和D-甘露糖醇100 mg(百分含量:99.0%~110%)。将注射用盐酸柔红霉素分别以Tirs-HCl缓冲溶液配置为171.0 mg/L、342.0 mg/L的样品溶液。以标准加入法测定DNR浓度。结果示于表1,检测结果与药品标准一致。表明由此方法制备的DNR传感器为测定DNR实际样品含量测定提供了一种可供选择的方法。

图11 β-CD/SiO2/GCE对不同浓度DNR(pH=7.5)的DPV电流响应值;内插图:DPV电流响应值对浓度的校正曲线Fig.11 DPVs of β-CD/SiO2/GCE electrode against the concentration of DNR(pH=7.5);Inset:plots of DPV and the concentration of DNR

表1 注射用盐酸柔红霉素样品的含量测定Tab.1 Detection of DNR in the sample of daunorubicin hydrochloride for injection
3 结论
以玻碳电极为基底,修饰具有高比表面积和生物亲和性的介孔二氧化硅、结合具有与柔红霉素选择性的β-环糊精,可成功构建一种新型的抗癌药DNR的电化学传感器。介孔二氧化硅结合β-环糊精有效增大了电极有效表面积,β-环糊精与DNR的特异性结合,使得该传感器具有良好的选择性和抗干扰性。同时,实验结果显示该传感器同时具有很好的稳定性和重现性,为DNR的检测提供了一种可供选择的简便、快速高灵敏度的检测方法。
[1]Landis-Piwowar K,Milacic V,Chen D,et al.The proteasome as a potentialtarget for novel anticancer drugs andchemosensitizers[J].Drug Resist Update,2006,9:263-273.
[2]Murphy G,Lawrence W J,Lenhar R.AmericanSociety-Textbookof Clinical Oncology,2nd Edn [M].Atlanta: American Cancer Society,1995.
[3]Bozdag S,Capan Y,Vural I.AA H覦ncal Method Validation in Determination of Mitoxantrone by HPLC[J]. Acta Pharmaceutica Turcica,2004,46:43.
[4]Nina G,Blaschke G,Boos J,et al.Determination of free and liposome-associated daunorubicin and daunorubicinol in plasma by capillary electrophoresis[J].Journal of Chromatography A,2002,979(1):379-388.
[5]Golabi S M,Hassan-Zadeh V.Polarographic determination of mitoxantrone in pharmaceutical preparations and biological media[J].Talanta,1996,43(3):397-406.
[6]Lachatre F,Marquet P,Ragot S,et al.Simultaneous determination of four anthracyclines and three metabolites in human serum by liquid chromatography-electrospray mass spectrometry[J].Journal of Chromatography B:BiomedicalSciencesand Applications, 2000,738(2):281-291.
[7]Sastry Chilukuri SP,Jana SVM Lingeswara Rao.Determination of doxorubicin hydrochloride by visible spectrophotometry[J].Talanta,1996,43(11):1827-1835.
[8]Alykov,Nm,T.V.Nekrest'yanova,et al.Reconcentration and fluorimetric determination of anthracycline antibiotics[J].Journal of analytical chemistry of the USSR, 1991,46(8):1193-1195.
[9]Pattarapond Gonil, Warayuth Sajomsang, Uracha Rungsardthong Ruktanonchai,et al,Novel quatemized chitosan containing P-cyclodextrin moiety:Synthesis, haracterization and antimicrobial activity[J].Carbohydrate Polymers,2011,83:905-913.
[10]Choi M,Heo W,Kleitz F,et al.Facile synthesis of high quality mesoporous SBA-15 with enhanced control of the porous network connectivity and wall hickness[J]. Chemical Communications,2003,12:1340-1341.
[11]Galarneau A,Cambon H,Renzo F D,et al.True microporosity and surface area of mesoporous BA-15 silicas as a function of synthesis temperature[J].Langmuir,2001, 17(26):8328-8335.
[12]屈海云,程圭芳,彭惠琦,等.抗癌药物柔红霉素的光谱电化学研究[J].高等学校化学学报,2001,22(12): 2000-2004.
Deterination of DNR based on mesoporous silica/β-cyclodextrin modified sensor
Ma Teng-fei,Liu Gui-hua,Huang Shan-sheng*
(Life and Environmental Sciences College,Shanghai Normal University,Shanghai 201418,China)
A novel electrochemical sensor for DNR detection based on mesoporous silica/β-cyclodextrin modified GCE was developed.The nanostructure of the synthesized mesoporous silica were characterized by X-ray diffraction (XRD),field emission scanning electron microscopy (FESEM)and Atomic Force Microscope(AFM).Cyclic voltammetry(CV)and electrochemical impedance spectroscopy(EIS)experiments were carried out to investigate the electrochemical properties of the modified electrode.The sensor exhibited good amperometric response towards daunorubicin (DNR)due to the large specific area and specific binding among the DNR,mesoporous silica and βcyclodextrin.Under optimum conditions,the current response of the sensor increased linearly with the concentration of DNR from 1.0×10-6~5.0×10-5mol/L(with a relative coefficient r=0.9950)and 5.0×10-5~2.5×10-4mol/L(with a relative coefficient r=0.9990).The detection limit was 2.0×10-7mol/L (S/N=3).The results indicated that the modified electrode showed a good performance in reproducibility,stability.
mesoporous silica;β-cyclodextrin;DNR;electrochemical sensor
*通信联系人,E-mail:sshuang@shnu.edu.cn
