蛋白激酶活性及抑制性检测研究进展
2015-02-02申聪聪阳明辉
申聪聪,阳明辉
(中南大学化学化工学院,湖南长沙410083)
蛋白激酶活性及抑制性检测研究进展
申聪聪,阳明辉*
(中南大学化学化工学院,湖南长沙410083)
蛋白激酶催化蛋白磷酸化是一种非常重要的蛋白质翻译后修饰方式,能够调节细胞内大多数蛋白的功能,在众多生理过程中发挥着至关重要的作用。磷酸化过程的异常以及激酶的过度表达往往与许多疾病密切相关,如癌症、糖尿病和老年痴呆症。因而,测定蛋白激酶的活性及筛选蛋白激酶抑制剂对基础生物医学研究和酶靶药物的开发是非常重要的。近年来,研究工作者们采用电化学法、比色法以及荧光检测法等方法研究了对蛋白激酶活性及抑制性的检测。该文回顾了蛋白激酶活性测定及抑制性检测的研究进展,主要关注了荧光检测法的应用,并对其未来的发展进行展望。
蛋白激酶;磷酸化;抑制剂筛选;荧光分析
0 引言
蛋白激酶(PKA)催化蛋白磷酸化是一种非常重要的蛋白质翻译后修饰方式,能够调节细胞内大多数蛋白的功能。蛋白的磷酸化修饰与众多生理过程紧密相关,如细胞间信号传导、代谢调控、DNA损伤修复、基因转录和细胞凋亡等[1-4]。蛋白激酶是一种磷酸转移酶,通常是将三磷酸腺苷(ATP)上的γ-磷酸基团转移到底物蛋白特定的酪氨酸(Tyr)、苏氨酸(Thr)和丝氨酸(Ser)残基上。蛋白激酶是酶家族的重要成员,随着人类基因测序工程的完成,已鉴定有518种蛋白激酶,占整个人类基因编码蛋白的1.7%[5]。活性正常的蛋白激酶体系是细胞信号传导运作的核心,但当其活性异常或者过度表达时就会引起某些蛋白磷酸化过程的异常。人类许多疾病就和蛋白磷酸化异常密切相关,如癌症[6]、糖尿病[7]及老年痴呆[8]等。由于蛋白激酶调控着每个组织、每个器官、甚至每个细胞的生死,从而已成为治疗这些复杂疾病的重要药物靶点。因此,测定蛋白激酶的活性及筛选蛋白激酶抑制剂在生物医学诊断以及酶靶药物开发等领域激起了人们的兴趣。
传统测定蛋白激酶的方法有放射性同位素标记法[9-11]、电化学法[12]、表面等离子共振法[13]、质谱法[14-15]和免疫法[16]等,这些检测手段和方法在一定程度上促进了对蛋白激酶活性研究,然而各自又具有一定的局限性。放射性元素标记ATP技术,检测方法直接,灵敏度高,但存在放射性污染,不能进行组织标记;免疫法对磷酸化识别抗体的要求较高,专一性不强,费用高。因此,开发快速、简便、经济、灵敏度高且无需标记的蛋白激酶活性检测及高通量筛选抑制剂方法是非常必要的。
近年来,多种纳米材料因其具有粒径较小、生物相容性好和表面积大等优点而广泛用于化学和生物分析检测方法中。在众多检测方法中,荧光分析法具有信号读出简便、非放射性、操作简单、容易实现均相分析和高通量分析等优点。近年来,科学研究者逐渐地将两者结合在一起来增强测定蛋白激酶活性的灵敏度和选择性[17-19]。该文综述了蛋白激酶活性测定及抑制剂筛选的研究进展,着重介绍了近年来基于荧光法测定蛋白激酶活性及抑制剂筛选的方法,并对其未来的发展进行了展望。
1 蛋白激酶活性的检测的常用方法
由于蛋白磷酸化过程伴有ATP的参与和磷酸根基团的转移,因此要实现蛋白激酶活性检测,常用方法包括将底物多肽、ATP或其它与蛋白磷酸化相关的一些分子进行修饰或标记,或者在磷酸化过程中通过磷酸根基团的转移引入电活性或荧光性物质,还可以在磷酸化后引入能与磷酸根离子有特异性作用的基团。该文主要从电化学法、比色法、共振光散射法、表面等离子体共振(SPR)法和荧光分析法几个方面来介绍蛋白激酶活性以及抑制性测定最新研究进展。
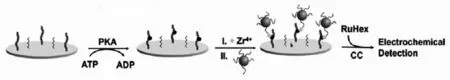
图1 基于Zr4+和DNA-AuNPs电化学测定蛋白激酶的原理图Fig.1 Schematic of electrochemical detection of kinase activity using Zr4+and DNA-AuNPs
1.1 电化学法
电化学法由于具有仪器简单、灵敏度高、可以实现原位检测等优点而广泛用于生物分析检测中。近年来许多文献报道了利用电化学方法测定蛋白激酶活性及抑制性。Kraatz课题组提出了利用纳米金(Au NP)作为探针,采用方波伏安法氧化还原氯化物检测蛋白激酶的活性及抑制性[20]。姚守拙课题组开发了一种基于锆阳离子 (Zr4+)介导的新型非标记电化学传感器测定蛋白激酶活性的方法[21]。如图1,将一端带有半胱氨酸的多肽底物组装在金电极表面,利用巯基乙醇进行封闭,以减少非特异性吸附。由于Zr4+能够特异性地结合磷酸根,加入DNA修饰的Au NPs后,在Zr4+的存在下,带负电荷的DNA-AuNPs就和蛋白磷酸化后的多肽通过Zr4+结合起来。再加入带正电荷的电活性物质六氨合钌离子([Ru(NH3)6]3+,RuHex),通过电化学计时电量法(CC)测出电极表面RuHex的总电量,从而测定蛋白激酶的活性。在蛋白磷酸化的过程中加入抑制剂,通过蛋白激酶活性的抑制可以进行有效的蛋白激酶抑制剂的筛选。此电化学传感器省略了蛋白修饰、ATP标记以及生物分子特异性识别过程,操作简单,灵敏度高,给其它酶活性检测提供了一种新的思路。接着为了更加简化测定蛋白激酶活性的过程,姚守拙课题组又建立了一种石英晶体微天平电极法一步测定蛋白激酶活性,此法省略了蛋白磷酸化的过程,耗时短(仅仅只需10 min)[22]。
1.2 比色法
比色法检测不需要昂贵复杂的仪器,可通过裸眼观察颜色变化来判断反应的进程。由于设计简单、成本低、实用性强受到了科学研究者广泛的关注并有望应用于实时诊断。Au NPs、金纳米棒(Au NRs)和银纳米颗粒(Ag NPs)由于它们独特的表面等离子体共振(SPR)特性(Au NP聚集颜色从红色变为蓝色,Ag NP聚集从黄色变为灰色)而大量用于比色分析法中。基于纳米颗粒的比色法生物检测一般通过交联聚集 (纳米颗粒间特异性作用)和非交联聚集(改变纳米颗粒稳定环境)两种途径来实现。首次报道利用交联聚集比色法测定蛋白激酶活性和抑制性的是brust课题组[23]。如图2A,将底物多肽固定在Au NP上,在ATP的γ磷酸基团上修饰生物素,进行蛋白磷酸化反应后,修饰有生物素的γ磷酸基团转移到Au NP表面的多肽上。此时再将修饰有亲和素 (avidin)的Au NP加入溶液中,生物素(biotin)与亲和素的特异性结合使得Au NP迅速团聚,溶液由红色变为蓝色。当加入蛋白激酶的抑制剂时,溶液颜色变色的程度就取决于抑制剂的浓度。这也意味着比色法不仅可以测定抑制剂的活性,也能够在筛选高效抑制剂的过程中提供定量信息。尽管此法为测定蛋白激酶活性提供了新的思路,但是过程复杂、需要标记、耗时长,Katayama课题组就基于非交联聚集开发了一种快速、简单检测蛋白激酶活性的方法[24]。如图2B,柠檬酸盐还原的Au NP表面带负电荷,与带正电荷且一端带有半胱氨酸的多肽底物相互作用后会发生电荷中和而聚集。当多肽底物磷酸化后,磷酸根优先与多肽上的正电荷中和而使Au NP稳定,不易聚集。基于此现象Katayama课题组又利用金纳米棒(AuNRs)纵向的SPR带对溶液、底物、粒子间距的敏感性,建立了一种更高灵敏度的比色法生物传感器。这种方法几乎可以高选择、高灵敏地筛选所有的蛋白激酶[25]。
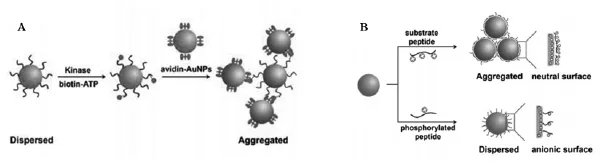
图2 比色法测定蛋白激酶原理图(A)基于生物素和亲和素特异性结合交联聚集AuNP测定蛋白激酶[23](B)基于缩氨酸吸附非交联聚集AuNP测定蛋白激酶活性[24]Fig.2 Schematic of colorimetric kinase assays.(A)Kinase assay based on phosphorylation-induced crosslinking AuNP aggregation via biotin-avidin interaction[23].(B)Colorimetric assay of kinase activity based on noncrosslinking AuNP aggregation induced by peptide adsorption[24]
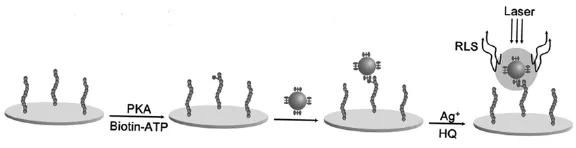
图3 基于Biotin-ATP用RLS法测定蛋白激酶活性示意图Fig.3 Schematic of RLS based on biotin-ATP detection of protein kinase activity
1.3 共振光散射法
当入射光的能量与一个震荡偶极子的能量相似时,就会发生共振光散射(RLS),且两个或更多偶极子强烈耦合共振光散射会剧烈增强,信号也明显地放大。利用该微列阵技术能够高通量地进行蛋白激酶的活性分析,也可以并列多组高效筛选抑制剂。王和他的课题组利用共振光散射法提出了一种新颖、灵敏的测定蛋白激酶活性方法[26]。如图3,先用生物素修饰ATP,再把固定在基底上的底物多肽在蛋白激酶PKA和生物素-ATP存在下发生蛋白磷酸化,那么蛋白磷酸化位点就引入了生物素。然后将亲和素修饰的AuNPs能通过生物素和亲和素的相互作用特异性结合在磷酸化的多肽上。随后通过银染反应,增大AuNPs的粒径,从而实现了RLS信号的放大。该方法具有极高的灵敏度,也可以有效地测定实际样品,比如细胞和组织提取物等中的PKA,并有望对抑制剂进行高通量的筛选,这对新药的开发意义重大。
1.4 表面等离子体共振法
SPR是发生在金属和电介质界面上的光学传感技术,通过探测发生在传感芯片表面折射率以及质量的变化来研究发生在芯片表面的相互作用,可实时检测生物分子间结合与解离的动态过程,具有灵敏、快速、免标记、耗样量少和灵敏度高等优点。同时使用羧甲基化葡聚糖芯片(Dextran)、亲和素芯片 (SA)和氨基三乙酸芯片(NTA)等在检测待测物的过程中能大大地降低非特异性吸附,使其成为一种研究分子间相互作用的理想技术。Yoshiki Katayama课题组基于此开发了一种快速、简便测定蛋白激酶活性的方法[27]。如图4,在金膜表面固定一端带有半胱氨酸的多肽底物,蛋白磷酸化后,加入锌(Ⅱ)化合物(生物素化的Zn2L3+),最后加入链酶亲和素(SA)进一步放大信号。还可以利用SPR成像技术同时检测多个芯片上的反应,来分析固定在芯片上的多肽探针,此法常用来评估芯片表面蛋白磷酸化的程度,对测定蛋白激酶活性及抑制剂筛选非常有效。

图4 基于磷酸根捕获分子用SPR法测定蛋白激酶活性示意图Fig.4 Schematic of SPR based on phosphate capture molecule detection of protein kinase activity
1.5 荧光法
在过去的十几年间,荧光分析法由于它灵敏度高、操作简单、容易实现均相分析、样品用量少等优点而广泛用于生物分析检测中。为了实现更加灵敏、简便的检测,近年来陆续出现了一系列荧光检测法。接下来就主要从聚集猝灭荧光法[28-29]、荧光共振能量转移法(FRET)[30-32]、荧光偏振法(FP)[33]、荧光成像法[34]及免蛋白磷酸化荧光法[35]介绍基于荧光法测定蛋白激酶活性及抑制剂筛选。
1.5.1 聚集猝灭荧光法
纳米材料的性质随其尺寸、形貌、聚集态的不同表现各异,而且聚集态与分散态的纳米颗粒的荧光强度、拉曼信号及紫外吸收等性质也不同,比如量子点(QDs)在聚集状态下会显著地猝灭荧光。基于此性质,聂舟课题组设计了一种基于CdTe量子点自聚集免标记荧光法测定细胞裂解液中PKA的活性[28]。如图5,多肽底物带正电荷,加入表面富含负电荷的CdTe QDs溶液中,带正电的多肽包裹住CdTe QDs促使其发生自聚集,荧光强度降低。然而蛋白磷酸化后的多肽引入了带负电的磷酸根,中和了多肽上的正电荷,再加入CdTe QDs,此时避免了CdTe QDs的自聚集,荧光强度明显增强。该实验现象明显,甚至裸眼就可以观察到,即将比色法与荧光法相结合,进一步提高了灵敏度。而且利用聚集猝灭荧光法成功并高效地筛选出了人血清中4种不同的蛋白激酶抑制剂[28]。
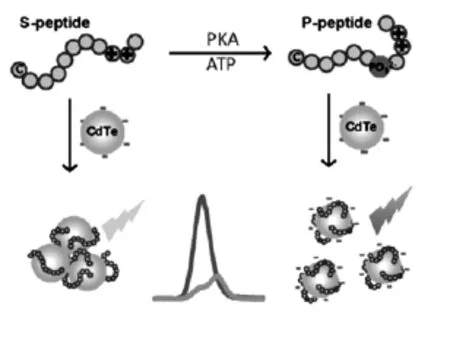
图5 基于CdTe QDs自聚集荧光法测定蛋白激酶活性示意图Fig.5 Schematic of Fluorescence based on CdTe QDs self-aggressive detection of protein kinase activity
1.5.2 荧光共振能量转移法(FRET)
目前,在荧光法测定中FRET是应用较多的方法之一,根据实验设计特定的荧光探针,通过控制供体和受体的排列方式、距离等促使FRET的发生。早期使用编码荧光蛋白测定蛋白激酶活性,随着荧光新材料的出现,QDs、金属纳米粒子、有机染料及荧光共轭聚合物等也作为新型荧光探针用于蛋白激酶活性测定和抑制剂筛选。基于此李正平课题组开发了一种基于荧光共轭聚合物及金属离子介导的荧光共振能量转移方法实现高灵敏检测蛋白激酶活性[30]。如图6,金属锆离子(Zr4+)与荧光共轭聚合物(PFPaa),通过配位作用形成的配合物作为荧光探针。荧光标记的底物多肽磷酸化后,在溶液中利用Zr4+与磷酸化位点的特异性识别将PFPaa与标记在底物上的荧光基团拉近,产生强烈的FRET,并对荧光信号进行放大,由此建立了一种简单、均相、通用型分析方法,适合于各类蛋白激酶活性分析,并可应用于蛋白激酶抑制剂的高通量筛选。此方法对于细胞信号传导研究、疾病诊断及以蛋白激酶为靶标的靶向药物筛选都具有较好的应用前景。但是FRET的荧光探针制备比较复杂,还需进一步创新开发出更加简便的荧光探针制备方法。
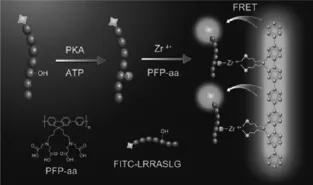
图6 荧光共振能量转移法测定蛋白激酶活性示意图Fig.6 Schematic of FRET detection of protein kinase activity
1.5.3 荧光偏振法
荧光偏振法(FP)通过荧光偏振程度的变化来进行分析检测,操作简单,可在均相溶液中进行。IMAP亲和溶液 (含有表面固定三价金属离子的纳米颗粒)是一项专利技术,且蛋白磷酸化提供与金属离子特异性结合的位点。基于此,Sportsman课题组设计了一种均相、免标记的蛋白激酶活性法[33]。如图7,荧光标记的底物表现出低的荧光偏振,磷酸化之后,加入IMAP亲和溶液,由于磷酸根位点与纳米粒子的结合使得荧光偏振的程度大大增强,故能够定量、快速地测定蛋白激酶的活性也可用于高通量的筛选蛋白激酶抑制剂。但由于在测定实际样品时,偏振信号对溶液中的组分很敏感,许多内源性的细胞成分会结合到荧光修饰的肽底物上,可能出现假阳性,使得荧光偏振法应用受到限制。
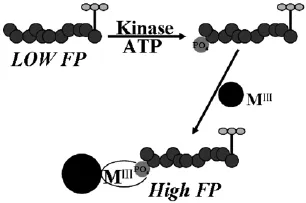
图7 荧光偏振法测定蛋白激酶活性示意图Fig.7 Schematic of Fluorescence Polarization detection of protein kinase activity
1.5.4 荧光成像
随着荧光标记技术和光学成像技术的发展,荧光成像由于标记能力强、信号强度大、成像速度快、实验成本低、可实现活体器官成像等优点吸引了大量的科研工作者的关注。之前报道的蛋白激酶活性测定方法往往会因为非特异性吸附而影响检测的灵敏度,为了减少非特异性吸附的影响,简便快捷的磁分离技术走进了人们的视野,TiO2与磷酸化的位点有特异性吸附作用,并具有很好的选择性富集能力[36]。因此李正平课题组设计了一种基于功能化磁性微球的蛋白激酶活性荧光分析法[34]。如图8,制备TiO2修饰的Fe3O4/SiO2磁性微球,荧光标记的肽底物被蛋白激酶磷酸化之后,用磁性微球选择性富集分离磷酸化肽,直接对富集的多肽进行荧光成像,或者将富集的多肽用0.5%的氨水洗脱下来,测上清液的荧光,最低检测限可以达到0.0001 U/μL。该方法实现了对蛋白激酶活性的高灵敏、快速检测,并可以对其抑制剂进行筛选。此外,还成功用于多种蛋白激酶同时检测,而且还可用于细胞中PKA活性的检测。
1.5.5 免蛋白磷酸化荧光法
据文献报道,大多数有关于蛋白激酶活性测定都包含了蛋白磷酸化过程,即将ATP上的γ磷酸基团转移到多肽底物上,酶促反应需要耗时较长。为了简化实验过程,本课题组开发了一种基于AgNCs免蛋白磷酸化荧光法测定蛋白激酶活性及抑制性[35]。如图9所示,以富含胞嘧啶的单链DNA(dC12,CCCCCCCCCCCC)作为模板,NaBH4化学还原AgNO3合成水溶性好、荧光性质稳定的AgNCs,加入ATP后荧光强度明显增加。如果让ATP与PKA反应,催化ATP转化为ADP,再加入AgNCs中则荧光强度只有部分增强。根据荧光增强程度能够快速、有效地检测出蛋白激酶的活性,检测限可以达到0.5 mU/μL。同时,H-89在该方法中体现出优良的抑制性,并且成功实现了HeLa细胞裂解液中PKA活性测定,这为高效筛选其它抑制剂和有关蛋白激酶靶药提供了新的思路。这种“混合-检测”的模式操作简单、成本低、避免了传统蛋白磷酸化过程,有望推广到其他蛋白激酶活性测定和抑制剂筛选。

图8 基于CdTe QDs自聚集荧光法测定蛋白激酶活性示意图Fig.8 Schematic of Fluorescence based on CdTe QDs self-aggressive detection of protein kinase activity
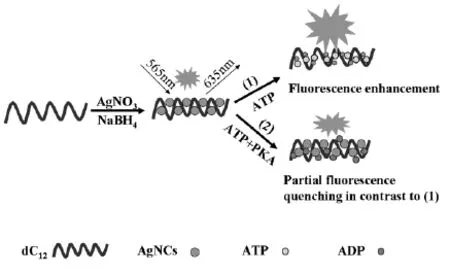
图9 基于AgNCs免磷酸化荧光法测定蛋白激酶活性示意图Fig.9 Schematic of Fluorescence based on AgNCs free phosphorylation detection of protein kinase activity
2 结语
随着人们对蛋白激酶在生物体内重要性的深入了解,对其活性测定及抑制剂筛选方法也在不断更新,该文分别从电化学法、比色法、共振光散射法、表面等离子体共振法和荧光检测法概括了近年来测定蛋白激酶活性及抑制剂筛选的常规方法。同时,由于荧光分析法具有信号读出简便、非放射性、操作简单、容易实现均相分析、样品用量少等优点,该文着重从机理方面阐述了荧光分析法在蛋白激酶活性检测方面的应用。尽管现已开发出许多比较简便、快捷、灵敏度高的检测方法,在蛋白激酶活性测定及抑制剂筛选方面也取得了突破性进展,但仍有很多问题亟待解决。第一,大多数的蛋白激酶检测方法可以测定细胞裂解液中蛋白激酶的活性,但很少可以直接在活细胞中进行检测。第二,由于蛋白激酶是在细胞内发挥作用,因此实现单细胞检测对活体细胞内信号传导系统的研究至关重要。第三,开发新型的探针材料,使其能够在近红外区域检测,这样有助于实现活体成像。此外,还有蛋白激酶靶药的开发等还需进一步研究和探索。
[1]Stevan R H,Jeffrey H T.Protein tyrosine kinase structure and function[J].Annu.Rev.Biochem.,2000,69:373-398.
[2]Binz S K,Sheehan A M,Wold M S.Replication protein Aphosphorylation and the cellular response to DNA damage[J].DNA Repair,2004,3:1015-1024.
[3]Kobor M S,Greenblatt J.Regulation of transcription elongation by phosphorylation[J].Biochim.Biophys.Acta.,2002,1577:261-275.
[4]Ruvolo P P,Deng X,May W S.Phosphorylation of Bcl2 and regulation of apoptosis[J].Leukemia,2001,15: 515-522.
[5]Manning G,Whyte D B,Martinez R,et al.The protein kinase complement of the human genome[J].Science, 2002,298:1912-1934.
[6]Brognard J,Hunter T.Protein kinase signalling networks in cancer[J].Curr.Opin.Genet.Dev.,2011,21:4-11.
[7]Zhao X,León I R,Bak S,et al.Phosphoproteome analysis of functional mitochondria isolated from resting human muscle reveals extensive phosphorylation of inner membrane protein complexes and enzymes[J].Mol.Cell. Proteomics.,2011,10:1-14.
[8]Salminen A,Kaarniranta K,Haapasalo A,et al.AMP-activated protein kinase:a potentialplayer in Alzheimer’s disease[J].J.Neurochem.,2011,118:460-474.
[9]Turk B E,Hutti J E,Cantley L C.Determining protein kinase substrate specificity by parallel solution-phase assay of large numbers of peptide substrates[J].Nat. Protoc.,2006,1:375-379.
[10]Hastie C J,Mclauchlan H J,Cohen P.Assay of protein kinases using radiolabeled ATP:a protocol[J].Nat.Protoc.,2006,1:968-971.
[11]Kerman K,Vestergaard M D,Tamiya E.Label-free electrical sensing of small-molecule inhibition on tyrosine phosphorylation[J].Anal.Chem.,2007,79:6881-6885.
[12]Song H,Kerman K,Kraatz H B.Electrochemical detection of kinase-catalyzed phosphorylation using ferrocene-conjugated ATP[J].Chem.Comm.,2008,4: 502-504.
[13]Viht K,Schweinsberg S,Lust M,et al.Surface-plasmonresonance-based biosensor with immobilized bisubstrate analog inhibitor for the determination of affinities of ATP-and protein-competitive ligands of cAMP-dependent protein kinase[J].Anal.Biochem.,2007,362:268-277.
[14]Mann M,Ong S,Grønborg M,et al.Analysis of protein phosphorylation using mass spectrometry:deciphering the phosphoproteome[J].Trends Biotechnol.,2002,20: 261-268.
[15]Watts J D,Affolter M,Krebs D L,et al.Identification by electrospray ionization mass spectrometry of the sites of tyrosine phosphorylation induced in activated Jurkat T cells on the protein tyrosine kinase ZAP-70[J].J.Biol. Chem.,1994,269:29520-29529.
[16]Gupta S,Andresen H,Ghadiali J E,et al.Kinase-actuated immunoaggregation ofpeptide-conjugated gold nanoparticles[J].Small.,2010,6:1509-1513.
[17]Vera J A.Probing the kinome in real time with fluorescent peptides[J].Chem.Soc.Rev.,2012,4:1652-1664.
[18]Olive D M.Quantitative methods for analysis of protein phosphorylation in drug development[J].Expert Rev. Proteomics.,2004,1:89-103.
[19]Martic S,Kraatz H B.Chemical biology toolkit for exploring protein kinase catalyzed phosphorylation reactions [J].Chem.Sci.,2013,4:42-59.
[20]Kerman K,Kraatz H B.Electrochemical detection of kinase-catalyzed thiophosphorylation using gold nanoparticles[J].Chem.Commun.,2007,47:5019-5021.
[21]Xu X H,Nie Z,Yao S Z,et al.A DNA-based electrochemical strategy for label-free monitoring the activity and inhibition of protein kinase[J].Chem.Commun., 2009,45:6946-6948.
[22]Xu X,Zhou J,Liu X,et al.Aptameric peptide for onestep detection of protein kinase[J].Anal.Chem.,2012, 84(11):4746-4753.
[23]Wang Z X,Levy R,Brust M,et al.Kinase-catalyzed modification of gold nanoparticles:a new approach to colorimetric kinase activity screening[J].J.Am.Chem. Soc.,2006,128:2214-2215.
[24]Oishi J,Asami Y,Mori T,et al.Measurement of homogeneous kinase activity for cell lysates based on the aggregation of gold nanoparticles[J].ChemBioChem,2007,8: 875-879.
[25]Kitazaki H,Moria T,Kang JH,et al.A colorimetric assay of protein kinase activity based on peptide-induced coagulation of gold nanorods[J].Colloids and Surfaces B:Biointerfaces,2012,99:7-11.
[26]Wang Z X,Lee J,Cossins A R,et al.Microarray-based detection of protein binding and functionality by gold nanoparticle probes[J].Anal.Chem.,2005,77:5770-5774.
[27]Inamori K,Kyo M,Nishiya Y,et al.Detection and quantification of on-chip phosphorylated peptides by surface plasmon resonance imaging techniques using a phosphate capture molecule[J].Anal.Chem.,2005,77: 3979-3985.
[28]Xu H X,Liu X,Nie Z,et al.Label-free fluorescent detection of protein kinase activity based on the aggregationbehavior of unmodifed quantum dots[J].Anal.Chem., 2011,83:52-59.
[29]Wang Y,Zhang L,Liang R P,et al.Using grapheme quantum dots as photoluminescent probes for protein kinase sensing[J].Anal.Chem.,2013,85:9148-9155.
[30]Bai J,Li Z P,Liu C H,et al.A versatile platform for highly sensitive detection of kinase activity based on metal ion-mediated FRET using an anionic conjugated polymer [J].Chem.Commun.,2013,49:3887-3889.
[31]Gupta S,Andresen H,Stevens M M.Single-step kinase inhibitor screening using a peptide-modified gold nanoparticle platform[J].Chem.Commun.,2011,47: 2249-2251.
[32]Freeman R,Finder T,Gill R.Probing protein kinase (CK2)and alkaline phosphatase with CdSe/ZnS quantum dots[J].Nano Lett.,2010,10:2192-2196.
[33]Gaudet E A,Huang K,Zhang Y,et al.A homogeneous fluorescence polarization assay adaptable for a range of protein serine/threonine and tyrosine kinases[J].J. Biomol.Screen.,2003,8:164-175.
[34]Bai J,Zhao Y J,Li Z P,et al.Dual-readout fluorescent assay of protein kinase activity by use of TiO2-coated magnetic microspheres[J].Anal.Chem.,2013,85: 4813-4821.
[35]Shen C C,Yang M H,Wang J X,et al.Silver nanoclusters-based fluorescence assay of protein kinase activity and its inhibitors[J].Anal.Chem.,2015,87:693-698.
[36]Ji J,Yang H,Liu Y,et al.TiO2-assisted silver enhanced biosensor for kinase activity profling[J].Chem.Comm., 2009,12:1508-1510.
Recent progress in monitoring the activity and inhibitor of protein kinase activity
Shen Cong-cong,Yang Ming-hui*(College of Chemistry and Chemical Engineering,Central South University,Changsha 410083,China)
Protein phosphorylation catalyzed by protein kinase is one of the most important post-translational modifications,which adjusts the function of most proteins in cells and plays a significant regulatory role in many vital biological processes.Aberrant protein-phosphorylation states and kinase activity are closely associated with many human diseases,including cancer,diabetes and Alzheimer's disease.Thus,detecting the kinase activity and inhibitor screening are essential for fundamental biochemical research and kinase-targeted drug discovery. Recently,utilizing electrochemical,colorimetric and fluorescence techniques,researchers have developed different methods for monitoring the activity and inhibition of protein kinase.This article reviews the recent advances in the development of assays for protein kinase activity and inhibition,mainly focused assays based on fluorescence methods,and then offers perspectives on future developments.
protein kinase;phosphorylation;inhibitor screening;fluorescence assay
*通信联系人,E-mail:yangminghui@csu.edu.cn;Tel:0731-88836356
