白藜芦醇对TGF-β1介导的肾小管上皮细胞表型转化和Hedgehog信号的影响
2015-01-18王斯璐吴存造潘晓东洪炜龙林成成陈必成白永恒
王斯璐 吴存造 潘晓东 洪炜龙 林成成 陈必成 白永恒
●论 著
白藜芦醇对TGF-β1介导的肾小管上皮细胞表型转化和Hedgehog信号的影响
王斯璐 吴存造 潘晓东 洪炜龙 林成成 陈必成 白永恒
目的 探讨白藜芦醇(Res)对转化生长因子-β1(TGF-β1)诱导的肾小管上皮细胞(NRK-52E)表型转化(EMT)的影响及其分子机制。方法 体外培养肾小管上皮细胞,分为对照组、诱导组(TGF-β1:5μg/L)、干预1组(TGF-β1+Res10μmol/ml)和干预2组(TGF-β1+Res100μmol/ml)。采用细胞免疫荧光和qRT-PCR技术检测EMT、细胞外基质和Hedgehog信号相关分子表达水平。结果 TGF-β1作用NRK-52E细胞后,不仅促进其受体TGF-β1R表达(P<0.05),且肌成纤维细胞标志物(α-SMA)和基质成分Ⅲ型胶原的表达增加,上皮细胞标志物(E-cadherin)表达下降。应用Res干预后,不仅抑制甚至逆转了上述结果,且抑制了TGF-β1介导的MMP-2/TIMP-2比值下降(P<0.05),促进基质成分降解。此外,Res也抑制TGF-β1诱导的PCNA表达上调(P<0.05),以及增殖相关的Hedgehog信号(Shh、Ptch1和Gli1)活化(P<0.05)。结论 Res可能通过拮抗Hedgehog信号来抑制TGF-β1所诱导的NRK-52E细胞增殖、EMT和细胞外基质累积。
白藜芦醇 转化生长因子-β1 表型转化 肾小管上皮细胞 Hedgehog信号
肾小管细胞上皮间质表型转化(EMT)是指在某些特殊的生理或病理条件下,肾小管上皮细胞异常增殖,失去自身的细胞特性而获得肌成纤维细胞的特性。活化的肌成纤维细胞可以过度分泌细胞外基质成分,如Ⅰ型和Ⅲ型胶原在肾间质间隙累积,从而导致肾间质纤维化的发生[1]。因此,抑制或逆转EMT的发生和发展以及改善肾间质成份的累积已成为控制肾间质纤维化的重要途径之一[2]。近年有研究显示,从葡萄皮中分离的一种成分白藜芦醇(Res)具有抑制多种组织纤维化的作用[3],然而其分子机制尚未明确。目前,转化生长因子-β1(TGF-β1)被证实可以调节EMT过程,且是最重要的诱导因子之一[4]。因此,本研究拟通过TGF-β1来诱导肾小管上皮细胞(NRK-52E)EMT和基质累积,探讨Res对NRK-52E的EMT和细胞增殖相关的Hedgehog信号的影响及其作用机制。
1 材料和方法
1.1 材料及仪器 大鼠肾小管上皮细胞系(NRK-52E)购于中国科学院上海细胞库。主要试剂:Res(上海源叶生物公司)、TGF-β1(美国PeproTech公司)、Ⅲ型胶原
和增殖细胞核抗原PCNA抗体(中国Bioworld公司);上皮细胞标志物钙黏蛋白(E-cadherin)(美国Abcam公司);α-平滑肌肌动蛋白(α-SMA)、patched-1(Ptch1)、Gli1和smoothened(Smo)抗体(美国Santa Cruz公司)、TRIzol reagent(美国 Invitrogen公司)、ReverTra Ace qPCR RT kit(日本Toyobo公司)、SYBR Green Realtime PCR Master Mix-Plus(日本Toyobo公司)、引物由美国Invitrogen公司合成,见表1。主要仪器:7500 Real-Time PCR System(美国LifeTechnologies公司)、MyCycler梯度PCR仪(美国BioRed公司)、DM4000B LED荧光正置显微镜(德国Leica公司)。
1.2 方法

表1 Hedgehog信号和纤维化相关基因的mRNA特异性引物
1.2.1 细胞培养及分组 NRK-52E细胞于DMEM(含5%胎牛血清、100U/ml penicillin和100mg/ml streptomycin)培养基中培养。培养条件:37℃,5%CO2恒温培养。当6孔板中细胞密度达到70%时将完全培养基替换成无血清培养基,同步24h后加入TGF-β1或Res。根据文献[5]将NRK-52E细胞分为4组:(1)对照组:未加入Res和TGF-β1;(2)诱导组:只加入TGF-β1(5μg/ L);(3)干预1组:TGF-β1+Res10μmol/ml,干预2组:TGF-β1+Res100μmol/ml。
1.2.2 细胞免疫荧光染色 NRK-52E细胞经细胞爬片,TGF-β1或Res处理24h后,加入4%多聚甲醛固定,之后加入0.1%Triton X-100破膜处理10min,并用10%FBS封闭来消除非特性的荧光显色。应用PCNA(细胞增殖的关键蛋白)、Ⅲ型胶原(基质成分)、α-SMA(肌成纤维细胞标志物)、E-cadherin(上皮标志物)、Ptch1、Smo和Gli1(Hedgehog信号通路成分)的一抗,以及DyLight 488/594标记的二抗处理后,用抗淬灭封片剂封片,最后置于荧光显微镜下观察并拍照。
1.2.3 qRT-PCR 用TRIzolreagent提取细胞总RNA,并于260/280nm测定吸光度值,分析样本纯度和浓度,再用ReverTra Ace qPCR RT kit将RNA逆转录成cDNA,最后用SYBR Green Realtime PCR Master Mix-Plus进行实时定量PCR,PCR程序为:95℃3min预变性,1个循环;95℃5s,60℃35s,40个循环。应用Primer 5.0软件设计引物,以β-actin作为内参对照。得到的结果用ΔΔCt法分析。相对表达量=2-ΔΔCt,ΔΔCt=[Ct目的基因(待测样品)-Ct内参(待测样品)]-[Ct目的基因(校正样品)-Ct内参(校正样品)]。同时采用熔解曲线分析以评价PCR结果的可靠性。
1.3 统计学处理 采用SPSS15.0统计软件,计量资料以表示,组间比较采用t检验。
2 结果
2.1 Res对TGF-β1处理的NRK-52E细胞的EMT和基质的影响 见插页图1和表2。
由图1可见,免疫荧光染色结果显示,TGF-β1处理NRK-52E细胞后,肌成纤维细胞标志物α-SMA和基质成分Ⅲ型胶原表达增加,上皮标志物E-cadherin表达下降。由表2可见,TGF-β1不仅诱导使其受体TGF-β1R mRNA的表达升高(P<0.05),而且也促进纤连蛋白、S100A4、Ⅰ型胶原和TIMP-2 mRNA表达水平显著上升和MMP-2 mRNA表达下降(P<0.05或0.01)。低浓度的Res(10μmol/ml)即可抑制甚至逆转以上结果,而高浓度的Res(100μmol/ml)对EMT和基质的影响更显著。

表2 EMT和细胞外基质相关分子表达
2.2 Res对TGF-β1处理的NRK-52E细胞的PCNA表达的影响 见插页图2。
免疫荧光染色检测PCNA表达显示:PCNA阳性/总细胞数分别为对照组0.68±0.13、诱导组0.77±0.15,干预1组0.35±0.06,干预2组0.30±0.05。诱导组PCNA的表达相对于对照组略微增加;干预1组、干预2组PCNA的表达低于诱导组,差异均有统计学意义(均P<0.05)。可见TGF-β1作用NRK-52E细胞后,PCNA的表达量增加。而Res可以抑制TGF-β1引起的NRK-52E细胞PCNA表达水平上调。
2.3 Res对TGF-β1处理的NRK-52E细胞的SHH信号相关分子表达 见插页图3及表3。
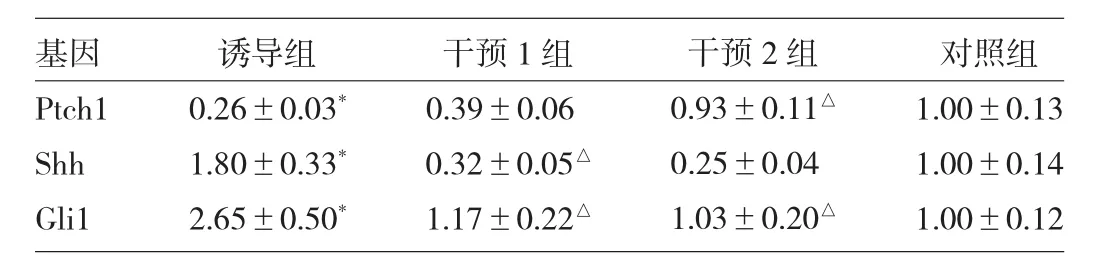
表3SHH信号相关分子表达
由图3可见,TGF-β1能上调受体Smo和转录因子Gli1的表达,同时下调细胞膜受体Ptch1的表达,而Res抑制甚至逆转以上结果。由表3可见,TGF-β1能上调分泌型蛋白配体Shh和Gli1的表达,同时下调Ptch1的表达(均P<0.05),而Res抑制了Shh和Gli1的表达,上调Ptch1的表达(均P<0.05)。
3 讨论
肾间质纤维化的病理学特征表现为基质成分的合成和降解的失衡,导致其在肾间质的广泛累积[1,6]。肌成纤维细胞是体内最主要的基质产生细胞,而肌成纤维细胞可能来源于EMT。因此,研究EMT对于肾纤维化防治具有十分重要的意义。本研究中,NRK-52E细胞经TGF-β1处理后,上皮细胞标志物表达下降,而肌成纤维细胞标志物和基质成分的表达明显增高,说明TGF-β1成功诱导了肾小管上皮细胞的EMT和基质累积。
Res是一种含有芪类结构的植物抗毒素,从葡萄或者其他水果的表皮上即可分离得到。Res不仅具有抗炎、抗氧化和抑制血小板凝集等生物学活性[7],而且也可抑制多种组织的纤维化[3]。然而,Res抗纤维化的分子机制尚未明确。本研究发现,在体外培养的肾小管上皮细胞中,TGF-β1引起的EMT和基质改变可以被低浓度的(10μmol/ml)Res所抑制甚至逆转,而100μmol/ml Res的影响更为显著,表明了Res对TGF-β1处理的NRK-52E细胞的EMT和基质的影响可能呈现为浓度依赖性。TIMP-2和MMP-2属于基质金属蛋白酶家族,在正常生理情况下如胚胎发育和组织重建中参与基质的降解[8]。Res可以抑制TGF-β1引起的MMP-2/TIMP-2比值的下降,提示Res抑制细胞外基质的累积是通过促使基质降解和抑制其合成,最终使基质成分减少,减轻肾纤维化[6]。Yang等[9]研究表明异常的细胞增殖可能是引起EMT的重要原因。我们研究发现,TGF-β1处理NRK-52E细胞后,增殖细胞核抗原PCNA表达上升,然而我们并未发现细胞数量的增多,这说明PCNA表达升高主要是细胞的异常增殖过程,即发生EMT,形成新的亚型。而Res则能使PCNA表达显著下降,我们推测Res抑制EMT进程可能和调控细胞增殖的Hedgehog信号通路相关。Hedgehog信号是一条与细胞增殖密切相关的信号通路,该通路主要由分泌型蛋白配体Shh、细胞膜受体Ptch和Smo以及转录因子Gli构成,在细胞分化、胚胎发育及组织修复等过程中发挥重要作用[10]。以前研究发现Res可以通过抑制胰腺癌细胞中的Hedgehog信号,进而抑制细胞增殖,诱导其凋亡从而发挥抗肿瘤作用[5]。Huang等[11]发现Res通过调控SHH信号来调节骨髓间充质细胞的分化。这些研究结果表明了Hedgehog信号与肿瘤等增殖性疾病的发生、发展关系密切。本研究结果显示,TGF-1能上调Shh、Smo和Gli1蛋白的表达,同时下调Ptch1表达,这说明TGF-β1能诱导Hedgehog信号的活化。而活化的Hedgehog信号可能是上皮细胞的异常增殖的关键。Res通过调控上皮细胞的异常增殖进而影响EMT进程,那么Res是否参与Hedgehog信号的调控?结果显示Res增加了Ptch1的表达,下调了Smo和Gli1的表达,说明Res可以抑制TGF-β1诱导的NRK-52E细胞的Hedgehog信号活化。然而,本研究对Res对Hedgehog信号的调控方式以及作用靶点没有深入研究。因此,需要进一步明确Res和Hedgehog信号的关系,并深入探讨其与TGF-β1和EMT等关系,为实现Res治疗肾纤维化研究提供依据。综上所述,Hedgehog信号通路可能参与Res抑制肾纤维化的过程,为Res对治疗肾纤维化的临床用药提供理论依据。
[1]Savagner P.The epithelial-mesenchymal transition (EMT)phenomenon[J].Ann Oncol,2010,21(Suppl7):89-92.
[2]郑法雷.肾小管上皮间充质细胞转化机制与治疗意义[J].J Med Res, 2007,36(4):4-7.
[3]Liang J,Tian S,Han J,et al.Resveratrolas a therapeutic agent for renal fibrosis induced by unilateral ureteral obstruction[J].Ren Fail,2014,36(2):285-291.
[4]王军,邵传森,程晓霞,等.平滑肌肌动蛋白和转化生长因子1在小管间质纤维化模型大鼠肾组织中的表达[J].浙江医学,2002,24(12): 726-727.
[5]Mo W,Xu X,Xu L,et al.Resveratrol inhibits proliferation and induces apoptosis through the hedgehog signaling pathway in pancreatic cancer cell[J].Pancreatology,2011,11(6):601-609.
[6]Martins VL,Caley M,O'Toole E A.Matrix metalloproteinases and epidermalwound repair[J].CellTissue Res,2013,351(2):255-268.
[7]Liang J,Tian S,Han J,et al.Resveratrolas a therapeutic agent for renal fibrosis induced by unilateral ureteral obstruction[J].Ren Fail,2014,36(2):285-291.
[8]Ban C R,Twigg S M.Fibrosis in diabetes complications:pathogenic mechanisms and circulating and urinary markers[J].Vasc Health Risk Manag,2008,4(3):575-596.
[9]Yang L,Besschetnova T Y,Brooks C R,et al.Epithelial cell cycle arrest in G2/M mediates kidney fibrosis after injury[J].Nat Med, 2010,16(5):535-543.
[10]Cain J E,Rosenblum N D.Control of mammalian kidney development by the Hedgehog signaling pathway[J].Pediatr Nephrol, 2011,26(9):1365-1371.
[11]Huang J G,Shen C B,Wu W B,et al.Primary cilia mediate sonic hedgehog signaling to regulate neuronal-like differentiation of bone mesenchymalstem cells for resveratrolinduction in vitro[J]. J NeurosciRes,2014,92(5):587-596.
Effectof resveratrol on TGF-β1-mediated epithelial-mesenchymal transition and hedgehog signaling in renal tubular epithelialcells
WANG Silu,WU Cunzao,PAN Xiaodong,et al.
Laboratory of Surgery,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China
Objective To investigate the effect of resveratrol(RES)on TGF-β1-mediated epithelial-mesenchymal transition(EMT)in renal tubular epithelial cells and its molecular mechanism. Methods Renal tubular epithelial NRK-52E cells were divided into control group,TGF-β1 group(EMT was induced by 5μg/L TGF-β1),treatment group 1 and 2(EMT-induced cells were treated with res 10 or 100μmol/ml).qRT-PCR and immunofluorescence staining were performed to evaluate the mRNA and protein expression of EMT,extracellular matrix,and Hedgehog signaling molecules. Results After treated with TGF-β1, NRK-52E cells were transited from epithelial phenotype to mesenchymal phenotype,accompanied with down-regulated expression of epithelial marker(E-cadherin)and up-regulated expression of TGF-β1R(P<0.05),mesenchymal markers(α-SMA)and matrix components(TypeⅢcollagen),which were inhibited or reversed by resveratrol treatment.In addition,resveratrol inhibited TGF-β1-mediated down-regulation of MMP-2/TIMP-2,resulting in the degradation of matrix components.Resveratrol also abolished up-regulated expression of PCNA (P<0.05),and activation of hedgehog signaling (Shh,Ptch1 and Gli1)induced by TGF-β1 in NRK-52E cells(P<0.05). Conclusion Resveratrol can inhibit TGF-β1-induced proliferation,EMT and matrix deposition in NRK-52E cells via the hedgehog pathway.
ResveratrolTransforminggrowth factor β1(TGF-β1) Epithelial mesenchymal transition(EMT) Renal tubular epithelial cells Hedgehog signaling
2014-12-10)
(本文编辑:杨丽)
浙江省自然科学基金(LQ12H05001,LY12H05004);温州市科技计划项目(Y20110028)
325000 温州医科大学附属第一医院外科实验室(王斯璐、洪炜龙、林成成、陈必成、白永恒),移植科(吴存造、潘晓东)
白永恒,E-mail:greatsailor@163.com
