中药三萜皂苷合成通路的生物信息学分析
2015-01-16张召宝崔清华马鲁豫
张召宝, 侯 林, 崔清华, 潘 晴, 马鲁豫
(1.山东中医药大学药学院,山东济南250300;2.山东省医学科学院,山东济南250062)
中药三萜皂苷合成通路的生物信息学分析
张召宝1, 侯 林1, 崔清华1, 潘 晴1, 马鲁豫2*
(1.山东中医药大学药学院,山东济南250300;2.山东省医学科学院,山东济南250062)
目的从系统进化学角度对中药三萜皂苷合成通路中关键酶进行生物信息学分析。方法从NCBI数据库下载已有17种中药中的鲨烯合成酶、鲨烯环氧酶、2,3-氧化鲨烯环化酶的蛋白质全长序列,通过生物信息学软件对其进行理化性质分析、保守域分析、蛋白质三维结构预测和系统进化树的构建。结果序列分析表明,鲨烯合成酶、鲨烯环氧酶、2,3-氧化鲨烯环化酶的蛋白质序列保守性均较高。其中鲨烯合成酶具有两个高度保守的区域——富含天冬氨酸的镁离子结合位点1和2——可作为认定鲨烯合成酶的依据;鲨烯环氧酶和2,3-氧化鲨烯环化酶的蛋白三维结构保守,无规则卷曲部分为高变区。结论上游合成在进化中趋于保守和稳定;三萜皂苷众多类型的形成可能与下游细胞色素P450、糖基转移酶、β-糖苷酶等的修饰有关。
三萜皂苷;鲨烯合成酶;鲨烯环氧酶;2,3-氧化鲨烯环化酶
三萜皂苷(triterpenoid saponins)是一类重要的植物次生代谢产物,广泛分布于人参[1]、灵芝[2]、三七[3]、墨旱莲[4]等中药中,并作为其主要的活性成分,具有抗癌、抗氧化、消炎解毒等功效。
目前,人们对三萜皂苷的合成通路已有较为明确的认识[5]。首先通过甲羟戊酸等途径合成异戊二烯焦磷酸,然后经过香叶基二磷酸合酶、法尼基焦磷酸合酶、鲨烯合成酶和鲨烯环氧酶的催化,形成2,3-氧化鲨烯,再通过2,3-氧化鲨烯环化酶环化形成三萜类骨架,最后通过细胞色素P450、糖基转移酶、β-糖苷酶的修饰作用,形成复杂的糖苷化合物——三萜皂苷。
三萜皂苷主要从栽培药材中提取,但存在种类少、产量低、受环境影响大、收获周期长等问题,难以满足市场需求[6]。本研究系统分析了三萜皂苷合成通路中的关键酶,可增加对其进化规律的认识,发掘更多的相关药用资源,为今后利用基因工程技术实现其大规模人工合成打下坚实基础。
1 资料来源
截止到2014年3月27日,从NCBI数据库下载鲨烯合成酶蛋白质全长序列,共31条,包括人参Panax ginseng C.A.Mey.、三七Panax notoginseng(Burk.)F.H.Chen等17种中药的24条序列;下载鲨烯环氧酶蛋白质全长序列,共19条,包含人参、蛇足石杉Huperzia serrata(Thunb.ex Murray)Trev.等5种中药材的7条序列;下载2,3-氧化鲨烯环化酶蛋白质全长序列,共8条,包括人参、蒲公英Taraxacum mongolicum Hand.-Mazz.、总状升麻Cimicifuga racemosa(Turcz.)Maxim.和百脉根Lotus corniculatus这4种中药材的4条序列。相关序列的NCBI号在系统进化树中列出。
2 方法
2.1 蛋白质理化性质分析 蛋白质全长序列的理化性质应用在线软件ExPASy(http://www.expasy.org/)分析。其中,利用ProtParam模块根据具体的氨基酸序列,进行氨基酸数目、相对分子质量、理论等电点和不稳定指数的测算,然后利用ProtScale模块进行亲水性/疏水性分析。
2.2 结构域分析 在NCBI的Conserved Domain Database[7]和SMART[8](http://smart.embl-heidelberg.de/)数据库中进行蛋白质的保守域和功能域预测,并通过WebLogo[9]对其做进一步分析。利用基于同源建模的分析工具SWISS-MODEL[10](http://swissmodel.expasy.org/)预测蛋白质的三维结构。
2.3 构建系统进化树 利用MEGA 5.0软件[11]中的ClustalW进行序列比对,然后利用Neighbor-Joining(NJ)法构建系统进化树(bootstrap= 1000)。
3 结果与分析
3.1 鲨烯合成酶 鲨烯合成酶(squalene synthase,EC 2.5.1.21)是一种定位于内质网上的膜结合蛋白[12]。在类异戊二烯代谢途径中,它以法尼二磷酸为底物,催化合成30C产物角鲨烯。由于处于甾醇与三萜合成通路的分支点,决定着法尼基焦磷酸的流向,因此鲨烯合成酶发挥着重要的调节作用。
已有研究表明,鲨烯合成酶的结构和反应机制在动植物中相当保守。见表1。

表1 药用植物鲨烯合成酶蛋白质序列的理化性质Tab.1 Physical and chem ical properties of medicinal plants squalene synthase protein sequences
在哺乳动物中,该成分大约包含416 aa,相对分子质量约为47 kDa;在模式植物拟南芥中,该成分有2个 (NP_195190.1和NP_195191.2),其外显子具有高度同源性[13]。本研究从NCBI数据库中共下载得到17种中药的24条蛋白质全长序列,长度在405~418 aa之间,相对分子质量在45.89~47.89 kDa之间,理论等电点在6.07~8.53之间,多数为不稳定蛋白质 (不稳定指数>40)。以人参中的三条鲨烯合成酶序列(BAD08242.1,ACV88718.1和ACZ71037.1)为例,利用ProtScale模块进行疏水性/亲水性分析,由于其序列高度保守,所展现出的亲水性/疏水性规律较为一致,见图1。另外由图可知,鲨烯合成酶的N端分布有亲水域 (分值<-0.5),而C端则分布有一段较短的强疏水域 (分值>0.5),这与之前有关鲨烯合成酶细胞定位的报道相一致。鲨烯合成酶通过短的C端跨膜区锚定于内质网上,而N端的催化域则伸向胞质溶胶中[14]。
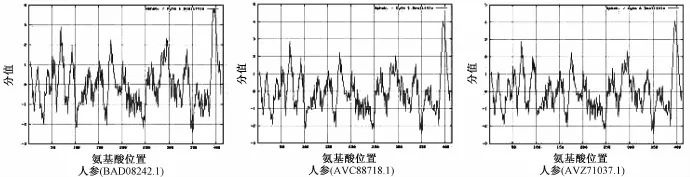
图1 鲨烯合成酶疏水性/亲水性分析Fig.1 Hydroponic/hydrophilic analysis of squalene synthases in P.ginseng
在对其序列进行理化性质分析的基础上,进一步研究其保守域。首先采用WebLogo对Lee[15]等报道的6个保守域进行分析,结果发现在17种中药中,Ⅲ、Ⅳ、Ⅴ三个保守域高度保守,而Ⅰ、Ⅱ、Ⅵ三个保守域保守性较差,见图2 A。由此可见,之前对这6个保守域的报道具有一定局限性。根据NCBI的Conserved Domain Database的预测结果比对发现,这17种中药中的鲨烯合成酶具有两个高度保守 (100%)的区域——富含天冬氨酸的镁离子结合位点1和2,见图2 B(结合位点1位于77~81 aa,结合位点2位于213~217 aa),该区域与15C法尼基和20C香叶基异戊二烯基二磷酸的1'-1'位缩合反应相关,其保守性保证了鲨烯合成酶与底物特异性结合,并可作为今后鉴定中药中该成分的重要依据。以人参中的三条鲨烯合成酶序列(BAD08242.1,ACV88718.1和ACZ71037.1)为例,SWISS-MODEL建模的结果显示,人参中鲨烯合成酶的三维结构相对保守,以α螺旋为主,而β折叠片较少,无规则卷曲等结构均很保守(图2 C)。

图2 鲨烯合成酶保守域分析Fig.2 Conserved domain analysis of squalene synthases
以模式物种拟南芥等植物中的鲨烯合成酶蛋白质全长构建进化树,见图3。由图可知,进化树首先分为两大支,其中上面一支主要包含较高等的植物类群,主要为双子叶植物;下面一支以紫杉Taxus chinensis(Pilger)Rehd.、马尾松Pinusmassoniana为代表,多为较低等的植物类群。整体而言,鲨烯合成酶具有较高的保守性和较为普遍的基因倍增现象,例如人参、丹参、北柴胡等6种中药具有两个及两个以上鲨烯合成酶。由于其具有较为重要的生理生化功能,故认为适应性进化可能导致了普遍的基因倍增,从而产生了不同的亚型,之间可能存在的功能上的互补和增强,又是酶功能进化的一种体现。

图3 鲨烯合成酶系统进化树 (NJ法)Fig.3 Phylogenetic tree of squalene synthases
3.2 鲨烯环氧酶 鲨烯环氧酶(squalene epoxidase,EC 1.14.13.132)是一种细胞膜结合蛋白,催化三萜合成的第一步氧化反应,是该合成通路的限速酶之一[16]。
从NCBI中共下载得到7条中药鲨烯环氧酶的蛋白质全长序列,其长度在537~561 aa之间,相对分子质量在59.13~62.79 kDa之间,理论等电点在8.63~9.19之间,全部为不稳定蛋白质 (不稳定指数>40)(见表2)。

表2 药用植物鲨烯环氧酶蛋白质序列的理化性质Tab.2 Physical and chem ical properties of medicinal p lants squalene epoxidase protein sequences
以三七和人参中的鲨烯环氧酶序列为例,利用ProtScale模块进行疏水性/亲水性分析,可以看出,三七和人参中的两条鲨烯环氧酶蛋白质全长序列出现了较为明显的分化;三七中的ABE73759.1与人参的BAA24448.1具有较为一致的亲水性/疏水性规律;三七中的 AFV92748.1与人参的ACJ24907.2具有较为一致的亲水性/疏水性规律;这说明这两种亚型之间的分化早于三七和人参之间的分化,并在随后的进化中形成了自己独特的亲水性/疏水性规律 (图4)。

图4 鲨烯环氧酶疏水性/亲水性分析Fig.4 Hydroponic/hydrophilic analysis of squalene epoxidases in P.notoginseng and P.ginseng
对其进行功能域分析,见图5 A。由图可知,鲨烯环氧酶的C端含有一个高度保守的跨膜结构域(5~27 aa),然后是1个重叠的FAD结合域(NADPH结合域,60~408 aa)和鲨烯环氧酶结构域 (pfam08491,211~484 aa)。药用植物中的鲨烯环氧酶蛋白质序列呈现出较高的同源性,以模式植物拟南芥和中药代表物种人参为例,通过SWISS-MODEL进行三维结构的预测,见图5 B。由图可知,鲨烯环氧酶的α螺旋和β折叠片等结构保守,无规则卷曲部分为可变区,其中连接β折叠片者较为高变。
以模式物种拟南芥等植物中的鲨烯环氧酶蛋白质全长构建进化树,见图6。由图可知,进化地位较为低等的蕨类植物——蛇足石杉作为外群,位于进化树的底部;五加科的人参、三七、刺五加等植物聚为一支,显示出较近的亲缘关系。该进化树较好地符合物种之间的进化规律,说明鲨烯环氧酶伴随物种的进化进程趋于保守,只在特定类群中出现了基因倍增的现象,如五加科,这可能与该科物种特定的生境与生理习性相关,例如,某种环境压力迫使其特定通路的完善或者特定代谢产物的富集。

图5 鲨烯环氧酶保守域及三维结构分析Fig.5 Conserved domains and 3D structure analysis of squalene epoxidases

图6 鲨烯环氧酶系统进化树 (NJ法)Fig.6 Phylogenetic tree of squalene epoxidases
3.3 2,3-氧化鲨烯环化酶 氧化鲨烯环化酶(oxidosqualene cyclases,EC 5.4.99.7)是一大类氧化鲨烯环化酶的统称,能催化一系列复杂的环化和重排反应。在植物中,由于它可催化三萜皂苷合成中的第一步环化反应,因而被认为是合成通路中的关键酶。

表3 药用植物氧化鲨烯环化酶蛋白质序列的理化性质Tab.3 Physical and chem ical properties of medicinal p lants oxidosqualene cyclase p rotein sequences
本研究对其中的2,3-氧化鲨烯环化酶进行深入的分析,发现它在真菌、动物和植物中均较为保守。从NCBI中共下载得到4条中药的2,3-氧化鲨烯环化酶全长蛋白序列,包括人参、百脉根、蒲公英、总状升麻,长度在757~780 aa之间,相对分子质量在86.18~88.83 kDa之间,理论等电点在5.89~8.07之间,全部为不稳定蛋白质 (不稳定指数>40),见表3。利用ProtScale模块对其进行疏水性/亲水性分析,可见4条中药的2,3-氧化鲨烯环化酶序列具有较为一致的亲水性/疏水性整体规律,但亲水区域和疏水区域的强弱程度略有不同,见图7。
图7 2,3-氧化鲨烯环化酶疏水性/亲水性分析Fig.7 Hydroponic/hydrophilic analysis of 2,3-oxidosqualene cyclases
通过SWISS-MODEL进行三维结构的预测,见图8。由图可知,2,3-氧化鲨烯环化酶结构稳定,与模式植物拟南芥相比,无规则卷曲部分存在一定程度变化,而且其多分布于蛋白质表层。但由于序列有限,构建的系统进化树并不能很好地反应该酶的系统进化规律,见图9。

图8 2,3-氧化鲨烯环化酶三维结构分析Fig.8 3D structure analysis of 2,3-oxidosqualene cyclases

图9 2,3-氧化鲨烯环化酶系统进化树 (NJ法)Fig.9 Phylogenetic tree of 2,3-oxidosqualene cyclases
4 讨论
中药中所含的三萜皂苷成分类型众多,而且结构复杂。通过对其合成通路中关键酶的系统分析发现,鲨烯合成酶、鲨烯环氧酶、2,3-氧化鲨烯环化酶均较为保守,说明虽然三萜皂苷的合成是一个高度复杂的动态过程,但其苷元碳环骨架构成等上游步骤在进化中趋于保守和稳定,而且该成分众多类型的形成可能与下游细胞色素P450、糖基转移酶、β-糖苷酶等的修饰有关。另外,不同类型细胞色素P450催化的羟化反应和糖基转移酶催化的糖基反应可能是物种特异性三萜皂苷形成的原因。但由于细胞色素P450和糖基转移酶均为超家族[17-19],序列的同源性低,专一性高,大多尚未验证在三萜皂苷通路中的酶活性,难以进行系统进化分析,是目前通路水平三萜皂苷研究的难点[20]。除了应用传统的基因克隆方法外,还可以采用高通量测序的手段,对三萜皂苷合成通路及关键酶进行全面阐释。例如在人参的转录组分析中,共发现了133个细胞色素P450和235个糖基转移酶,其中有6个UDP-糖基转移酶可能直接参与人参皂苷的合成[20];在西洋参的转录组中发现了150个细胞色素P450和235个糖基转移酶,其中有1个细胞色素P450和4个UDP-糖基转移酶可能直接参与皂苷的合成[21]。
虽然很多三萜苷元碳环骨架上复杂的修饰反应尚不清楚,但是通过对通路上游关键酶的分析,已经具备了人工合成三萜苷元碳环骨架的理论基础,增加了对三萜皂苷合成通路进化规律的认识。鲨烯合成酶所具有的2个高度保守区域可作为今后认定该类酶的重要依据,并发掘更多的三萜皂苷药用资源。下一步研究的重点将是考察通路中不同基因的表达模式[23],并且结合转录组和代谢组,高通量地筛选药用植物中的细胞色素P450和UDP-糖基转移酶,系统地比较不同修饰体的活性差异,探究其修饰规律,推进人工合成三萜皂苷的进程。
[1]明乾良,韩 婷,黄 芳,等.人参皂苷生物合成途径及其相关酶的研究进展[J].中草药,2010,41(11):1913-1917.
[2]邢增涛,郁琼花,张劲松,等.不同品种灵芝中三萜类化合物的比较研究[J].中药材,2004,27(8):575-576.
[3]吴耀生,朱 华,李 珅,等.三七鲨烯合酶基因在三七根,茎,芦头中的转录表达与三萜皂苷合成[J].中国生物化学与分子生物学报,2007,23(12):1000-1005.
[4]程 敏,胡正海.墨旱莲的生物学和化学成分研究进展[J].中草药,2010,41(12):2116-2118.
[5]Choi DW,Jung JD,Ha Y I,et al.Analysis of transcripts in methyl jasmonate-treated ginseng hairy roots to identify genes involved in the biosynthesis of ginsenosides and other secondary metabolites[J].Plant Cell Rep,2005,23(8):557-566.
[6]焦晓林,高微微.环境因子对药用植物三萜皂苷合成影响的研究进展[J].中草药,2011,42(2):398-402.
[7]Marchler-Bauer A,Lu S,Anderson JB,et al.CDD:a conserved domain database for the functional annotation of proteins[J].Nucleic Acids Res,2011,39:D225-229.
[8]Letunic I,Doerks T,Bork P.SMART 7:recent updates to the protein domain annotation resource[J].Nucleic Acids Res,2012,40:D302-305.
[9]Crooks GE,Hon G,Chandonia JM,et al.WebLogo:a sequencelogo generator[J].Genome Res,2004,14(6):1188-1190.
[10]Kiefer F,Arnold K,KünzliM,et al.The SWISS-MODEL Repository and associated resources[J].Nucleic Acids Res,2009,37:D387-392.
[11]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis usingmaximum likelihood,evolutionary distance,andmaximum parsimonymethods[J].Mol Biol Evol,2011,28(10):2731-2739.
[12]张风侠,梁新华,王 俊.植物三萜皂苷生物合成及关键酶鲨烯合酶的研究进展[J].农业科学研究,2009,30(3):64-68.
[13]Nakashima T,Inoue T,Oka A,et al.Cloning,expression,and characterization of cDNAs encoding Arabidopsis thaliana squalene synthase[J].Proc Natl Acad Sci U S A,1995,92(6):2328-2332.
[14]Tansey TR,Shechter I.Structure and regulation ofmammalian squalene synthase[J].Biochim Biophys Acta,2000,1529(1-3):49-62.
[15]Lee JH,Yoon Y H,Kim H Y,etal.Cloning and expression of squalene synthase cDNA from hot pepper(Capsicum annuum L.)[J].Mol Cells,2002,13(3):436-443.
[16]Phillips D R,Rasbery JM,Bartel B,et al.Biosynthetic diversity in plant triterpene cyclization[J].Curr Opin Plant Biol,2006,9(3):305-314.
[17]Werck-Reichhart D,Feyereisen R.Cytochromes P450:a success story[J].Genome Biol,2000,1(6):1-9.
[18]Ross J,LiY,Lim E K,et al.Higher plantglycosyltransferases[J].Genome Biol,2001,2(2):1-6.
[19]徐洁森,魏 建,陶韵文,等.植物细胞色素P450在三萜皂苷生物合成中的功能研究进展[J].中草药,2012,43(8):1635-1640.
[20]郑夏生,罗秀秀,徐 晖,等.岗梅转录组及其乌索烷型三萜皂苷生物合成相关酶基因的发掘[J].世界科学技术-中医药现代化,2014,16(7):1505-1512.
[21]Chen S,Luo H,Li Y,et al.454 EST analysis detects genes putatively involved in ginsenoside biosynthesis in Panax ginseng[J].Plant Cell Rep,2011,30(9):1593-1601.
[22]Sun C,Li Y,Wu Q,et al.De novo sequencing and analysis of the American ginseng root transcriptome using a GSFLX Titanium platform to discover putative genes involved in ginsenoside biosynthesis[J].BMCGenomics,2010,11:262-273.
[23]牛云云,朱孝轩,罗红梅,等.三萜皂苷合成生物学元件的初步开发:三七鲨烯环氧酶编码基因克隆及表达模式分析[J].药学学报,2013,48(2):211-218.
Bioinformatics analysis of triterpenoid saponins biosynthesis pathway in herbalmedicines
ZHANG Zhao-bao1, HOU Lin1, CUIQing-hua1, PAN Qing1, MA Lu-yu2*
(1.College of Pharmacy,Shandong University of Traditional ChineseMedicine,Jinan 250300,China;2.Shandong Academy ofMedical Sciences,Jinan 250062,China)
AIMTo conductan informative analysis of key enzyme in biosynthesis pathway of triterpenoid saponins from herbalmedicines in the perspective of phylogenetics.METHODSFull protein sequences of squalene synthase,squalene epoxidase and 2,3-oxidosqualene cyclase,belonging to seventeen kinds of herbs,were downloaded from NCBIdatabase.Afterwards,analysis of physicaland chemical propertieswas conducted,conserved domain analysis,3D structures and Neighbor-Joining(NJ)phylogenetic analysis were carried out by bioinformatic softwares.RESULTSIt is shown that all the three enzymes were highly conservative.For squalene synthases,there were two completely conserved domains,Mg2+binding site with substrates,which were aspartic-rich and could be used as sequence tags.For squalene epoxidases and 2,3-oxidosqualene cyclases,their3D structureswere also highly conservative with few flexible random coils.CONCLUSIONThe upstream syntheses are highly conserved in evolution,the formation ofmany types of triperpenoid saponins may be associated with modification of downstream cytochrome P450,glycosyltranferases and beta-glucosidases.
triterpenoid saponin;squalene synthase;squalene epoxidase;2,3-oxidosqualene cyclase
R284.1
:A
:1001-1528(2015)06-1255-07
10.3969/j.issn.1001-1528.2015.06.021
2014-08-16
国家自然科学基金项目 (81273394);“十二五”重大新药创制国家科技重大专项 (2013ZX09103002-005)
张召宝(1988—),男,硕士,研究方向为中药学。Tel:(0531)82919863,E-mail:zhangzhaobao2010@163.com
*通信作者:马鲁豫 (1972—),男,博士,副研究员,研究方向为中药新药开发。Tel:(0531)82919863,E-mail:maluyuyky@ 126.com
