水溶性蜂胶联合阿司匹林对大鼠炎性痛作用
2015-01-16王海华王海珍姜玉新周萍萍
王海华, 王海珍, 曾 瑾, 姜玉新, 王 静, 周萍萍
(皖南医学院生理教研室,安徽芜湖241002)
水溶性蜂胶联合阿司匹林对大鼠炎性痛作用
王海华, 王海珍, 曾 瑾, 姜玉新, 王 静, 周萍萍
(皖南医学院生理教研室,安徽芜湖241002)
目的探讨水溶性蜂胶联合阿司匹林对大鼠炎性痛作用效应及其可能机制。方法将弗氏完全佐剂造模成功的36只炎性痛大鼠随机均分成6组,炎性痛模型组 (模型组)和5个处理组 (水溶性蜂胶组,阿司匹林组,水溶性蜂胶+阿司匹林组,水溶性蜂胶+纳洛酮组,水溶性蜂胶+N-硝基-L-精氨酸甲酯 (L-NAME)组。随机选取6只大鼠为正常对照组 (对照组)。测定各组大鼠的热痛阈潜伏期和机械痛阈值,血清中IL-6、TNF-α及NO的水平,致炎足关节渗出液中PLA2和PGE2的水平。结果与对照组相比,模型组大鼠第1天开始热痛阈潜伏期和机械痛阈值明显降低,热痛觉和机械痛觉过敏持续14d。模型组大鼠血清中IL-6、TNF-α及NO和渗出液中PLA2和PGE2的水平明显增高。与模型组相比,水溶性蜂胶组、阿司匹林组和水溶性蜂胶+阿司匹林组大鼠热痛阈潜伏期和机械痛阈值均升高,血清中IL-6、TNF-α及NO和渗出液中PLA2和PGE2的水平明显下降。与水溶性蜂胶组相比,水溶性蜂胶+阿司匹林组和水溶性蜂胶+非选择性一氧化氮合酶抑制剂组升高大鼠热痛阈潜伏期和机械痛阈值,而水溶性蜂+纳洛酮组大鼠却明显降低,差异有显著性 (P<0.05,P<0.01)。结论水溶性蜂胶联合阿司匹林对炎性痛大鼠的抗炎镇痛机制可能是抑制细胞因子及炎性介质的产生而实现的,阿片受体途径可能也发挥一定的作用。
水溶性蜂胶;阿司匹林;大鼠;炎性痛;镇痛;IL-6;TNF-α;NO
疼痛是大多数疾病的重要症状,也是一切炎症的主要症状,慢性炎性疼痛的治疗是世界医学难题之一,对患者的工作和生活影响较大,现有临床各类抗炎药虽有一定疗效,但均因同时具有不同程度的副作用而限制了其对疼痛的有效治疗;因此,深入探讨炎性疼痛产生的机制,寻求更为有效的治疗方法,就显得尤其重要。
蜂胶(propolis)是蜜蜂采集植物幼芽中的树脂并混入其上颚腺分泌物及蜂蜡等混合加工而成的,是自然界中珍贵稀有的能改变生命状态的天然物质,无毒副作用[1],2005年就录入 《中华人民共和国药典》,有 “紫色黄金”的美誉[2],蜂胶的化学成分复杂,类黄酮和萜烯类化合物是蜂胶的主要活性成分。蜂胶具有多种药理作用,如抗炎镇痛、增强免疫及心血管药理作用等[3],对蜂胶的抗炎镇痛作用有诸多文献报道[4-6],在抗炎作用机制方面也取得了一定的进展,但对于蜂胶抗炎活性研究的药物开发却不尽人意,尤其是在蜂胶与抗炎药物的相互作用研究较少,对于蜂胶与非甾体抗炎药的相互作用尚未见报道[7-8]。本实验通过注射完全弗氏佐剂到大鼠左侧后肢足底皮下造成关节周围组织的炎症反应,复制炎性疼痛大鼠模型,通过水溶性蜂胶 (总黄酮量200 mg/kg)及水溶性蜂胶(总黄酮量 200 mg/kg)联合阿司匹林 (100 mg/kg)对大鼠灌胃 (1次/日),连续14 d,采用热痛法和机械压痛法,测定各组大鼠热痛阈潜伏期和机械压痛阈值变化;通过腹腔注射受体拮抗剂干预,观察对各组大鼠热痛阈潜伏期和机械压痛阈值的影响,检测大鼠血清中IL-6、TNF-α及NO的水平,致炎足关节渗出液中PLA2和PGE2的水平,同时观察大鼠致炎足及其肝脏的形态学变化,旨在探讨水溶性蜂胶及其联合阿司匹林对大鼠炎性痛的镇痛效应及其可能机制,为蜂胶在医药上的开发和利用提供实验依据。
1 材料与方法
1.2 主要仪器与试剂 PL-200热刺痛仪(成都泰盟科技有限公司);BW-YLS-3E电子压痛仪、YLS-7B足跖容积测量仪 (上海软隆科技发展有限公司);UV-3200PCS紫外可见分光光度计 (上海美谱达仪器有限公司);Model-680型酶标仪 (美国BIO-RAD公司);Beckman Coulter微量台式离心机(美国Beckman公司)。NO试剂盒(南京建成生物工程研究所);PLA2、PGE2、TNF-α、IL-6试剂盒(合肥博美生物科技有限公司);其余试剂均为分析纯 (国药集团化学试剂有限公司)。
1.3 实验动物 清洁级雄性SD大鼠48只,体质量 (200±20)g,由合肥蜀山实验动物中心提供,实验动物合格证号:SCXK(苏)2009-0001,笼养3~4 d后进行行为学测试和实验,12 h~12 h明暗周期,室温20~22℃。动物适应性喂养一周。
1.4 试验方法
1.4.1 实验分组 雄性SD大鼠42只,随机分为7组 (n=6):正常对照组 (NC组)、炎性痛模型组(CFA组)、炎性痛+水溶性蜂胶组(CFA+ WSP组)、炎性痛+阿司匹林组(CFA+ASP组)、炎性痛+水溶性蜂胶+阿司匹林组(CFA+WSP+ ASP组)、炎性痛 +水溶性蜂胶 +纳洛酮组(CFA+WSP+NAL组)和炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组(CFA+WSP+LNAME组)。
1.4.2 慢性炎性疼痛模型的建立 炎性痛模型组(CFA组),消毒大鼠左侧后肢,用1 mL注射器抽取150μL弗氏完全佐剂(Complete freund's adjuvant,CFA内含0.1%灭活结核杆菌;Sigma),于左侧后肢足底皮下注射,注射后按压数分钟,以促进药物扩散。正常对照组 (NC组)足底皮下注射150μL生理盐水,其余操作同炎性痛模型组。
1.4.3 水溶性蜂胶在炎性痛模型中的镇痛作用
43支MDT团队,从覆盖的疾病种类数量上已十分可观,如何推动这些团队有效运行呢?“医务部门的参与将MDT的管理运营正规化、有效化,多学科整合门诊和特需门诊应运而生。”孙湛介绍道,“为了提高MDT特需门诊的效率,我们设定了流程。”孙湛说,首先由MDT负责人递交书面申请,经过医务处和门诊部审核批准,再由特需医疗部安排出诊时间、地点及频次。
测定各组大鼠基础痛阈值,每日相同时间点分别给予炎性痛+水溶性蜂胶组、炎性痛+水溶性蜂胶+纳洛酮组及炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组大鼠灌胃WSP(蜂胶总黄酮量200 mg/kg),炎性痛+阿司匹林组 (大鼠灌胃1 mL阿司匹林(100 mg/kg),炎性痛+水溶性蜂胶+阿司匹林组大鼠灌胃WSP(蜂胶总黄酮量200 mg/kg)和阿司匹林水溶液(100 mg/kg)1 mL,NC组和炎性痛模型组大鼠灌胃等容积的生理盐水,连续用药14 d;大鼠于炎性痛模型第7天,每日相同时间点,腹腔注射(ip)纳洛酮(4 mg/kg)为炎性痛+水溶性蜂胶+纳洛酮组;腹腔注射 (ip)LNAME(100μg/kg)为炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组,NC组和炎性痛模型组大鼠腹腔注射等体积的生理盐水为对照,连续给药7 d;其他操作同炎性痛+水溶性蜂胶组,给药1.5 h后,分别用PL-200热刺痛仪和BW-YLS-3E电子压痛仪测定各组大鼠的热痛阈潜伏期和机械痛阈值。
1.5 行为学测定
1.5.1 一般情况测定 观察动物每天左后肢变化,如有无红肿,注射部位有无渗液感染等,进食有无影响;观察步态姿势,有无舔咬现象及肢体瘫痪功能障碍,每日测定大鼠体质量。
1.5.2 足跖容积测定 在每天相同时间点,用YLS-7B足跖容积测量仪分别测定正常对照组及炎性痛模型组大鼠的左侧足跖的容积。
1.5.3 热刺痛法 测试前让大鼠在较黑暗的环境中适应约5min,待大鼠安静后,移动热辐射光源,使其通过透明玻璃板聚焦于大鼠左后趾足底部皮肤,观察大鼠对热伤害性刺激的反应。当大鼠出现抬足、舔脚反应时的时间为热痛阈潜伏期 (Thermal withdrawal latency,TWL)。当时间达到30 s,而大鼠仍无反应时便停止照射,以免损伤皮肤,并以30 s作为最高痛阈。每日于给药后30 min测定痛阈,测定时每组循环测定3次,两次时间间隔大于5 min,取3次测定值的均数作为大鼠的热痛阈潜伏期。
1.5.4 机械压痛法 在室温、安静状态下,将大鼠左侧后肢足背部置于压痛仪硅板上,脚踩踏板增加压爪强度,当大鼠出现缩腿、挣扎、嘶叫时,踩下踏板,此时压强为机械压痛阈值(Mechanical withdrawal threshold,MWT)。当机械压痛质量达到250 g,而大鼠仍无反应时便停止压爪,以免损伤皮肤,并以250 g作为最高痛阈。痛阈测定时每组循环测定3次,2次时间间隔大于5 min,取3次测定值的均数作为大鼠的机械压痛阈值。
1.6 生化检测及形态学观察
1.6.1 大鼠血清中IL-6、TNF-α及NO水平的测定 于制备炎性痛模型第14天,大鼠颈总动脉取血3~5 mL,分离血清,测定其中IL-6、TNF-α及NO水平。
1.6.2 大鼠致炎足关节渗出液中PGE2和PLA2水平的测定 于制备炎性痛模型第14天,将大鼠处死,在致炎足踝关节上方0.5 cm处剪取后足肿胀足爪,纵向切开,放入5 m L生理盐水的试管中,4℃浸泡过夜,以3 000 r/min离心10 min,取上清液,严格按照试剂盒说明书采用酶联免疫吸附法检测其中PGE2和PLA2的量。
1.6.3 大鼠致炎足及肝脏的形态学观察 留取各组大鼠致炎足及肝脏于10%福尔马林溶液中浸泡,进行HE染色观察其形态学变化。
1.7 数据处理及分析 分别以引起机械痛阈的质量数值 (g)、热痛阈的照射时间 (s)来表示机械痛阈和热痛阈。采用SPSS 16.0软件进行统计分析,实验数据以均数±标准差 (x±s)表示,多组均数比较用单因素方差分析(One way ANOVA),两两比较用S-N-K法,以P<0.05表示差异具有统计学意义。采用Graph Pad Prism 5软件作图。
2 结果
2.1 足跖容积测定 炎性痛模型组大鼠左足跖皮下注射完全弗氏佐剂后开始肿胀,足跖容积与正常对照组相比显著升高 (P<0.01),直至造模后第14天足跖容积仍高于正常对照组 (P<0.01)。结果表明炎性痛模型构建成功。见图1。
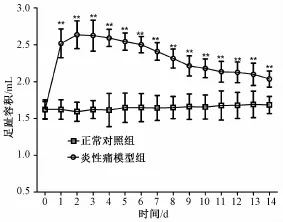
图1 炎性痛模型组大鼠与正常组大鼠足跖容积变化(n=6,x±s)Fig.1 Paw volume change between CFA group and NC group(n=6,x±s)
2.2 各组大鼠机械痛阈值 与正常对照组相比,炎性痛模型组大鼠注射完全弗氏佐剂后第1天开始机械痛阈值明显下降,持续14 d仍存在 (P<0.01),提示炎性痛模型大鼠存在机械痛觉过敏;同炎性痛模型组相比,炎性痛+水溶性蜂胶组、炎性痛+阿司匹林组和炎性痛+水溶性蜂胶+阿司匹林组大鼠在灌胃给药第2天后机械痛阈值出现增高,直到造模后第14天差异仍旧存在,差异有显著性 (P<0.05)(见图2)。
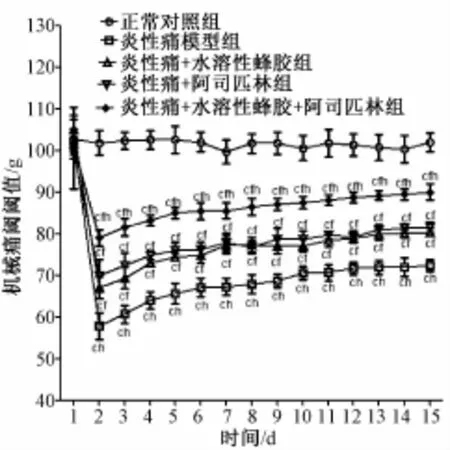
图2 各组大鼠机械痛阈值变化 (n=6,x±s)Fig.2 Change of MWT in different groups of rats(n=6,x±s)
如图3所见,给各组大鼠腹腔注射用药前,与正常对照组相比,炎性痛模型组、炎性痛+水溶性蜂胶组、炎性痛+水溶性蜂胶+纳洛酮组和炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组大鼠机械痛阈值明显低于正常对照组 (P<0.05),与炎性痛模型组相比,炎性痛+水溶性蜂胶组大鼠机械痛阈值明显增高 (P<0.01);腹腔注射阿片受体阻断剂纳络酮 (NAL)后,炎性痛+水溶性蜂胶+纳洛酮组大鼠机械痛阈值增高程度被部分阻断,同炎性痛+水溶性蜂胶组相比,差异有显著性,表明腹腔注射阿片受体阻断剂纳络酮能部分阻断WSP对炎性痛大鼠的镇痛作用;腹腔注射非选择性一氧化氮合酶抑制剂L-NAME后,炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组大鼠机械痛阈值明显高于炎性痛+水溶性蜂胶组,具有统计学意义 (P<0.01),表明腹腔注射非选择性一氧化氮合酶抑制剂L-NAME后,通过减少炎性痛大鼠外周组织NO的生成,从而增强了WSP的抗炎镇痛效应。见图3。
2.3 各组大鼠热痛阈值 与正常对照组相比,炎性痛模型组大鼠注射弗氏完全佐剂后第1天开始热痛阈值明显下降,持续14 d仍存在 (P<0.01),提示炎性痛模型大鼠存在热痛觉过敏;同炎性痛模型组相比,炎性痛+水溶性蜂胶组、炎性痛+阿司>匹林组和炎性痛+水溶性蜂胶+阿司匹林组大鼠在>灌胃给药第2 天后热痛阈值亦明显增高, 直到造模>后第14 天差异仍旧存在, 有显著性差异(P<0.05) (见图4)。
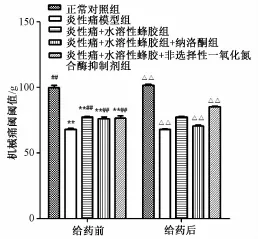
图3 不同阻断剂对水溶性蜂胶在炎性痛模型中的机械痛阈值的影响 (n=6,x±s)Fig.3 Effect of b lockers of w ater-soluble propolis on MWT in groups(n=6,x±s)

图4 各组大鼠热痛阈值变化 (n=6,x±s)Fig.4 Change of TW L in different groups of rats(n= 6,x±s)
给各组大鼠腹腔注射用药前,与正常对照组相比,炎性痛模型组、炎性痛+水溶性蜂组、炎性痛+水溶性蜂胶+纳洛酮组和炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组大鼠热痛阈值明显低于正常对照组 (P<0.05),与炎性痛模型组相比,炎性痛+水溶性蜂胶组大鼠热痛阈值明显明显增高 (P<0.01);腹腔注射阿片受体阻断剂纳络酮(NAL)后,炎性痛+水溶性蜂胶+纳洛酮组大鼠热痛阈值增高程度被部分阻断,同炎性痛+水溶性蜂胶组相比,差异有显著性,表明腹腔注射阿片受体阻断剂纳络酮能部分阻断WSP对炎性痛大鼠的镇痛作用;腹腔注射非选择性一氧化氮合酶抑制剂L-NAME后,炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组大鼠热痛阈值明显高于炎性痛+水溶性蜂胶组,具有统计学意义 (P<0.01),表明腹腔注射非选择性一氧化氮合酶抑制剂LNAME后,通过减少炎性痛大鼠外周组织NO的生成,从而增强了WSP的抗炎镇痛效应。见图5。
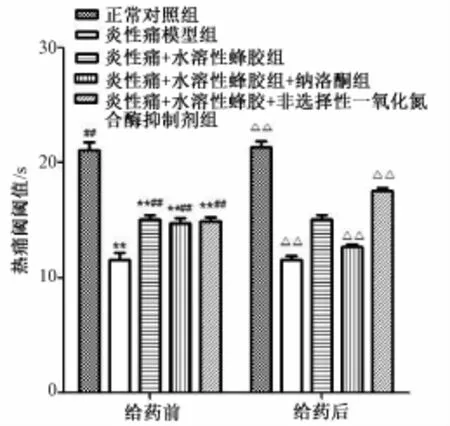
图5 不同阻断剂对水溶性蜂胶在炎性痛模型中的热痛阈值的影响 (n=6,x±s)Fig.5 Effect of b lockers of w ater-soluble propolis on TW L in groups(n=6,x±s)
2.4 水溶性蜂胶联合阿司匹林对炎性痛大鼠血清中IL-6、TNF-α及NO水平的影响 与正常对照组相比,炎性痛模型组大鼠血清中IL-6、TNF-α及NO水平明显增高 (P<0.01);同炎性痛模型组相比,炎性痛+水溶性蜂胶组,炎性痛+阿司匹林组和炎性痛+水溶性蜂胶+阿司匹林组大鼠血清中IL-6、TNF-α及NO水平均显著降低(P<0.05);同炎性痛+水溶性蜂胶组和炎性痛+阿司匹林组相比,炎性痛+水溶性蜂胶+阿司匹林组大鼠血清中IL-6、TNF-α及NO水平也有明显降低(P<0.05),说明WSP通过抑制炎性痛大鼠外周组织炎性因子的释放而发挥镇痛效应,与阿司匹林 (ASP)联合使用其作用增强,具有协同效应 (见表1)。

表1 水溶性蜂胶联合阿司匹林对炎性痛大鼠血清中促炎性因子IL-6、TNF-α和NO水平的影响(n=6,x±s)Tab.1 E ffects of water-soluble propolis in combination w ith aspirin on the contents of IL-6,TNF-αand NO in serum of inflammatory pain in rats(n=6,x±s)
2.5 水溶性蜂胶联合阿司匹林对大鼠致炎足关节渗出液中PLA2和PGE2水平的影响 与正常对照组相比,炎性痛模型组大鼠致炎足关节渗出液中PLA2和PGE2水平明显增高 (P<0.01);同炎性痛模型组相比,炎性痛+水溶性蜂胶组、炎性痛+阿司匹林组和炎性痛+水溶性蜂胶+阿司匹林组大鼠患足关节渗出液中PLA2和PGE2水平均降低(P<0.05);同炎性痛+水溶性蜂胶组和炎性痛+阿司匹林组相比,炎性痛+水溶性蜂胶+阿司匹林组大鼠致炎足关节渗出液中PLA2和PGE2含量明显降低 (P<0.05)。结果表明WSP具有抑制炎性痛大鼠炎性部位PLA2和PGE2的释放而发挥镇痛效应,与阿司匹林 (ASP)联合使用其作用增强,具有协同效应 (见表2)。

表2 水溶性蜂胶联合阿司匹林对炎性痛大鼠致炎足关节渗出液中PLA2和PGE2水平的影响 (n=6,x±s)Tab.2 Effects of water-soluble p ropolis in combination w ith aspirin on the contents of PLA2and PGE2in induced inflammatory foot joint exudate of inflamm atory pain in rats(n=6,x±s)
2.6 HE染色
2.6.1 大鼠足跖部病理变化的组间比较 正常对照组大鼠左侧足皮下组织结构清晰整齐,无炎性细胞浸润;炎性痛模型组大鼠致炎足皮下结缔组织排列紊乱,大量炎症细胞浸润,水肿明显;炎性痛+水溶性蜂胶组和炎性痛+阿司匹林组大鼠致炎足皮下组织轻微水肿,炎性细胞浸润减少;炎性痛+水溶性蜂胶+阿司匹林组大鼠致炎足皮下组织排列整齐,无明显水肿,炎性细胞浸润减少 (见图6)。
2.6.2 各组大鼠肝脏病理变化 正常对照组大鼠肝细胞为多边形,界限较清楚,细胞体积较大,核仁清楚,肝血窦内可见散在巨噬细胞;炎性痛模型组大鼠肝细胞水肿,肝血窦内大量炎性细胞浸润;炎性痛+水溶性蜂胶组和炎性痛+阿司匹林组大鼠肝血窦内一定量炎性细胞浸润;炎性痛+水溶性蜂胶+阿司匹林组大鼠肝血窦内少量炎性细胞浸润(见图7)。
3 讨论
炎症是机体在有害刺激作用下,多种因素导致局部组织细胞损伤的病理过程,也是机体对抗损伤的防御性保护反应。在致炎因素刺激下,细胞膜磷脂酶A2(PLA2)被激活,水解膜磷脂的酯键,释放出花生四烯酸,经环氧合酶作用产生前列腺素,前列腺素E2(PGE2)是其中主要组分,PGE2具有强烈的扩血管作用,从而引起炎症部位组织水肿,炎性渗出,同时还具有致敏痛觉神经末梢,造成痛觉过敏;多种炎症介质和细胞因子调控炎症反应过程,其中一氧化氮 (NO)在炎症反应的许多环节中发挥复杂的调节作用[10],如在细胞间信息传递过程中起信使作用,促炎作用包括舒血管作用,引起炎症部位组织水肿,增加炎性渗出等;TNF-α是一具有重要生物学功能的细胞因子[11],能激活血管内皮功能,增加白细胞黏附,激活凝血系统,抑制纤溶,激活单核-巨噬细胞释放IL-6和PGE2等炎症介质等多途径发挥其致炎作用。
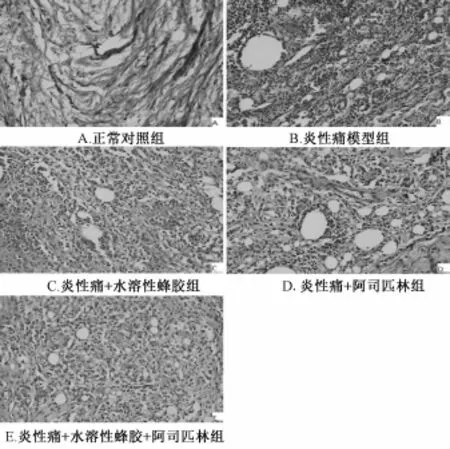
图6 各组大鼠足跖部HE染色镜下图片(HE×400)Fig.6 M icroscope images of rats paw HE staining in groups(HE×400)
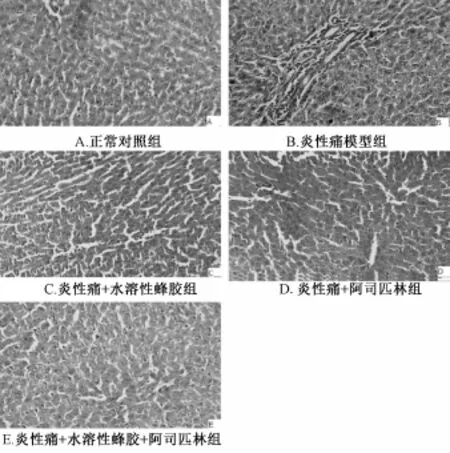
图7 各组大鼠肝脏HE染色镜下图片(HE×400)Fig.7 M icroscope images of rat liver HE staining in groups(HE×400)
疼痛是炎症的主要症状,国际上已经将疼痛列为第五生命体征。疼痛的评定主要有痛阈的测定、疼痛的主体评测和客体评测等[12]。慢性炎性疼痛对患者的工作和生活影响较大,现有临床各类抗炎药虽有一定疗效,但均因同时具有不同程度的副作用而限制了其对疼痛的有效治疗,深入探讨炎性疼痛产生的机制,寻求更为有效的治疗方法亟待解决。
阿司匹林 (ASP)又称乙酰水杨酸,属于非甾体抗炎药,其通过抑制环氧合酶的活性,使前列腺素等炎症介质生成减少,从而实现其抗炎镇痛作用,由于其本身具有酸性,造成胃肠道的不良反应,限制了其在临床上的广泛应用。蜂胶有 “紫色黄金”的美誉[2],具有多种药理作用,如抗炎镇痛和心血管药理作用等,对蜂胶的抗炎镇痛作用有诸多报道,对其抗炎机制研究也取得了一定的进展,但对于蜂胶抗炎活性研究的药物开发却不尽人意,尤其是在蜂胶与抗炎药物的相互作用研究较少[13-14],对于蜂胶与非甾体抗炎药的相互作用尚未见报道。
本实验通过建立炎性痛致炎性疼痛大鼠模型,通过蜂胶总黄酮 (200 mg/kg)及蜂胶总黄酮(200 mg/kg)联合阿司匹林 (100 mg/kg)[7]对大鼠灌胃 (1次/d),连续14 d,采用热痛法和机械压痛法,测定各组大鼠热痛阈潜伏期和机械压痛阈值变化;实验结果显示,与正常对照组相比,炎性痛模型组大鼠注射弗氏完全佐剂后第1天开始MWT和TWL均明显下降,持续14 d仍存在,提示炎性痛模型大鼠存在机械痛觉和热痛觉过敏,血清中IL-6、TNF-α及NO水平明显增高,患足关节渗出液中PLA2和PGE2水平明显增高;同炎性痛模型组相比,炎性痛+水溶性蜂胶组、炎性痛+阿司匹林组和炎性痛+水溶性蜂胶+阿司匹林组大鼠在灌胃给药第2天后MWT和TWL均出现增高,直到造模后第14天差异仍旧存在,血清中IL-6、TNF-α及NO水平明显降低,大鼠患足关节渗出液中PLA2和PGE2水平明显降低,差异有显著性;大鼠足跖部和肝脏形态学检测显示,同炎性痛模型组相比,炎性痛+水溶性蜂胶组、炎性痛+阿司匹林组和炎性痛+水溶性蜂胶+阿司匹林组大鼠足跖部皮下组织炎性细胞浸润明显减少,水肿减轻;大鼠肝血窦内炎性细胞浸润明显减少,肝细胞水肿明显减轻。给各组大鼠腹腔注射用药前,与正常对照组相比,炎性痛模型组、炎性痛+水溶性蜂胶组、炎性痛+水溶性蜂胶+纳洛酮组和炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组大鼠MWT和TWL均明显低于正常对照组,与炎性痛模型组相比,炎性痛+水溶性蜂胶组大鼠MWT和TWL均明显增高;腹腔注射阿片受体阻断剂纳络酮(NAL)后,炎性痛+水溶性蜂胶+纳洛酮组大鼠MWT和TWL增高程度均被部分阻断,同炎性痛+水溶性蜂胶组相比,差异有显著性,表明腹腔注射阿片受体阻断剂纳络酮能部分阻断WSP对炎性痛大鼠的镇痛作用;腹腔注射非选择性一氧化氮合酶抑制剂后,炎性痛+水溶性蜂胶+非选择性一氧化氮合酶抑制剂组大鼠MWT和TWL均明显高于炎性痛+水溶性蜂胶组,具有统计学意义 (P<0.05,P<0.01),表明腹腔注射非选择性一氧化氮合酶抑制剂L-NAME后,通过减少炎性痛大鼠外周组织NO的生成,从而增强了WSP的抗炎镇痛效应。
总而言之,实验结果同样证实WSP对炎性痛大鼠有明显的抗炎镇痛作用,联合阿司匹林后,其抗炎镇痛作用明显增强,其机制可能是抑制细胞因子及炎性介质的产生,降低炎症部位组织PLA2和PGE2的产生而实现的,阿片受体途径可能也发挥一定的作用。
[1]蒋春红,吕武清,胡棠洪.蜂胶的药理作用研究概况[J].中国医药指南,2011,9(17):42-43.
[2]姚树桐,桑 慧,商战平,等.蜂胶水提液对肠缺血再灌注大鼠肺损伤及NF-κB/ICAM-1表达的影响[J].营养学报,2011,33(1):75-79.
[3]王秀清,申树芳,张英锋,等.蜂胶的有效成分与功效[J].渤海大学学报:自然科学版,2010,31(3):219-224.
[4]胡福良,李英华,陈民利,等.蜂胶醇提液和水提液对急性炎症动物模型的作用[J].浙江大学学报:农业与生命科学版,2003,29(4):444-448.
[5]胡福良,李英华,朱 威,等.蜂胶醇提液对大鼠急性胸膜炎的作用及其机制的研究[J].营养学报,2007,29(2):189-191.
[6]胡福良,李英华,朱 威,等.蜂胶对大鼠佐剂性关节炎的作用及其机制的研究[J].中国药学杂志,2005,40(15):1146-1148.
[7]Castaldo S,Capasso F.Propolis,an old remedy used inmodern medicine[J].Fitoterapia,2002,73(suppl1):S1-6.
[8]李英华,朱 威,胡福良.蜂胶的抗炎作用及其机制研究进展[J].天然产物研究与开发,2012,24(6):856-859.
[9]韩淑燕,李海霞,屠鹏飞.三七总皂苷和红花总黄酮配伍对急性血瘀大鼠血液流变学的改善作用[J].中国药理学与毒理学杂志,2011,25(1):62-67.
[10]Cirino G,Distrutti E,Wallace JL.Nitric oxide and inflammation[J].Inflamm Allergy Drug Targets,2006,5(2):115-119.
[11]Junger H,Sorkin L S.Nociceptive and inflammatory effects of subcutaneous TNFalpha[J].Pain,2000,85(1-2):145-151.
[12]Merboth M K,Barnason S.Managing pain:the fifth vital sign[J].Nurs Clin North Am,2000,35(2):375-383.
[13]Oksuz H,Duran N,Tamer C,et al.Effect of propolis in the treatment of experimental Staphylococcus aureus keratitis in rabbits[J].Ophthalmic Res,2005,37(6):328-334.
[14]Duran N,Koc A,Oksuz H.et al.The protective role of topical propolis on experimental keratitis via nitric oxide levels in rabbits[J].Mol Cell Biochem,2006,281(1-2):153-161.
Effects of water soluble propolis combined with aspirin on inflammatory pain and itsmechanisms in rats
WANG Hai-hua, WANG Hai-zhen, ZENG Jin, JIANG Yu-xin, WANG Jing, ZHOU Ping-ping
(Departmentof Physiology,Wannan Medical College,Wuhu 241002,China)
AIMTo explore the effects of water soluble propolis(WSP)in combination with aspirin on inflammatory pain and its possiblemechanisms in rats.METHODSThirty-sixmale ratswith the inflammatory pain successfully induced by feeding freund's adjuvant(CFA)were randomly and equally divided into six groups,including inflammatory pain model group(CFA group);CFA+WSP group;CFA+aspirin group;CFA+WSP+aspirin group;CFA+WSP+Naloxone group(NAL group);CFA+WSP+L-NAME group,six rats were served as the normal control group(NC group).Each group of ratswasmeasured for the thermalwithdrawal latency(TWL)and mechanical withdrawal threshold(MWT).The expressions of IL-6,TNF-αand NO in serum,and PLA2and PGE2in induced inflammatory foot joint effusion of rats were detected.RESULTSThe TWL and MWT of rats in the CFA group were significantly lower than those of the NC group from the first day,their thermal and mechanical hyperalgia continued for fourteen days;The expressions of IL-6,TNF-αand NO in serum,and PLA2and PGE2in induced inflammatory foot joint effusion of rats significantly increased in the CFA group.The TWL and MWT of CFA+WSP,CFA+aspirin and CFA+WSP+aspirin groupswere significantly higher than those of the CFA group,while the positive expression levels of IL-6,TNF-αand NO in serum,and PLA2and PGE2in induced inflammatory foot joint effusion were significantly lower than those of the CFA group.The TWL and MWT of CFA+WSP+aspirin and CFA+WSP+L-NAME groups were higher than those of the CFA+WSP group,while the TWL and MWT of CFA+WSP+NAL group were lower than those of the CFA+WSP group,the differenceswere significant(P<0.05 or P<0.01).CONCLUSIONA good anti-inflammatory and analgesic effectofWSP combined with aspirin may be related to the inhibition of the production of cytokinesand inflammatorymediators.Opioid receptormay also play a key role.
water soluble propolis(WSP);aspirin;rat;inflammation pain;analgesic;IL-6;TNF-α;NO
R285.5
:A
:1001-1528(2015)06-1157-08
10.3969/j.issn.1001-1528.2015.06.002
2014-12-11
安徽省高校省级科学研究重点项目 (KJ2013A251);安徽省2012年省级教学研究重点项目 (2012jyxm313);国家自然科学基金资助项目(81172790);皖南医学院重点科研项目培育基金 (WK2012Z01)
王海华 (1967—),男,硕士,副教授,硕士生导师,研究方向为心血管病理生理。Tel:13675536187,E-mail:wanghaihua9972@sina.com
