2型糖尿病合并非酒精性脂肪性肝病相关影响因素分析
2015-01-11刘桂琴宋建奇
宋 炜 刘桂琴 宋建奇 李 杰
北京市大兴区红星医院,北京100076
2型糖尿病合并非酒精性脂肪性肝病相关影响因素分析
宋 炜 刘桂琴 宋建奇 李 杰
北京市大兴区红星医院,北京100076
目的探讨2型糖尿病(T2DM)合并非酒精性脂肪性肝病(NAFLD)的主要相关影响因素。方法选取2012年1月~2014年6月北京市大兴区红星医院内科住院的T2DM患者362例,其中单纯T2DM(T2DM组)165例,T2DM合并NAFLD(T2DM+NAFLD组)197例。收集两组患者的临床资料,检测血糖、糖化血红蛋白、血脂、肝功能、尿酸水平;采用Logistic回归分析筛选T2DM合并NAFLD的主要危险因素。结果与T2DM组比较,T2DM+NAFLD组的体重指数、腰围、臀围、腰臀比、血压、血糖、糖化血红蛋白、三酰甘油、谷丙转氨酶、谷草转氨酶、γ-谷氨酰转移酶及尿酸水平均升高,高密度脂蛋白胆固醇水平降低,差异有统计学意义(均P<0.05)。Logistic回归分析结果显示,体重指数、三酰甘油、血糖、糖化血红蛋白和血尿酸是T2DM合并NAFLD的独立危险因素(OR值分别为1.38、1.54、1.14、1.46和1.16,均P<0.05)。结论肥胖、高尿酸血症、高血糖水平与T2DM合并NAFLD的发病密切相关。
2型糖尿病;脂肪肝;非酒精性;危险因素
非酒精性脂肪性肝病(nonalcoholic fatty fiver disease,NAFLD)是一种无过量酒精摄入,以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征。近年来因NAFLD的发病率迅速增长而受到了广泛关注。随着人们生活水平的提高和生活方式的改变,2型糖尿病(type 2 diabetes mellitus,T2DM)合并NAFLD的患病率正逐年增加。NAFLD在西方国家十分常见,在糖尿病人群中患病率达21%~78%[1]。国内调查显示,NAFLD患病率为42.1%[2]。T2DM一旦合并NAFLD可以进一步恶化糖代谢,并且增加非酒精性脂肪性肝炎的发病风险,加速其向肝纤维化、肝硬化的进展。NAFLD和T2DM形成恶性循环,造成糖代谢紊乱和不良肝病结局。胰岛素抵抗是T2DM的核心机制,而肝脏是造成胰岛素抵抗的重要器官。目前,多认为胰岛素抵抗和脂质异位沉积是NAFLD的主要发病机制[1]。本研究通过对T2DM合并NAFLD患者代谢相关危险因素的分析,探讨T2DM合并NAFLD的独立危险因素,以期为其防治提出科学依据。
1 资料与方法
1.1 一般资料
选取2012年1月~2014年6月北京市大兴区红星医院内科住院的T2DM患者362例,T2DM诊断符合2010年《中国2型糖尿病防治指南》诊断标准[3]。NAFLD诊断符合2010年中华医学会肝病学分会脂肪肝和酒精性肝病学组关于非酒精性脂肪性肝病的诊断标准[4]。排除病毒性肝病、酒精性肝病、自身免疫性肝病、遗传性肝病、药物性肝病等,同时具备以下3项腹部超声异常中的2项及以上者即可做出NAFLD诊断:①肝脏近场回声弥漫性增强(明亮肝),且回声强于肾脏;②肝内管道结构显示不清;③肝脏远场回声逐渐衰减。根据NAFLD诊断标准分为单纯T2DM组(T2DM组)和T2DM合并NAFLD组(T2DM+NAFLD组)。
1.2 研究方法
1.2.1 一般检查测量人体学指标包括身高、体重、腰围、臀围、血压,计算腰臀比、体重指数(BMI)。
1.2.2 实验室指标测定所有患者禁食10 h,次晨抽静脉血,采用贝克曼AU680全自动生物化学分析仪检测肝功能、空腹血糖(FPG)、血脂、血尿酸(BUA);采用飞测FS-201检测糖化血红蛋白(HbA1c)水平。
1.2.3 相关疾病诊断标准冠心病的诊断标准为至少满足下述一条即可做出诊断:具有典型心绞痛症状及心肌缺血心电图改变;具有明确的心肌梗死病史;具有冠状动脉血运重建病史;经冠状动脉造影显示某一支或多支冠状动脉管腔狭窄≥70%。高血压的诊断标准参照2010版《中国高血压防治指南》[5]。血脂异常的诊断参照2007年《中国成人血脂异常防治指南》[6]。代谢综合征(MS)诊断参照2004年中华医学会糖尿病学分会关于代谢综合征的建议诊断标准[7]。
1.3 统计学方法
采用SPSS 11.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验;多因素分析采用Logistic回归分析;以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般情况比较
符合入选标准者362例,其中T2DM组165例,年龄37~65岁,平均(54.8±11.1)岁,病程(6.3±4.7)年;T2DM+NAFLD组197例,年龄41~68岁,平均(52.4± 9.7)岁,病程(6.9±5.7)年。两组患者年龄、病程比较差异无统计学意义(P>0.05)。
2.2 两组临床特征及生物化学指标比较
两组患者低密度脂蛋白胆固醇(LDL-C)水平比较,差异无统计学意义(P>0.05);与T2DM组比较,T2DM+NAFLD组收缩压(SBP)、舒张压(DBP)、腰围、臀围、腰臀比、BMI、FPG、HbA1c、三酰甘油(TG)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转移酶(γ-GGT)和BUA均升高,高密度脂蛋白胆固醇(HDLC)水平降低,差异均有统计学意义(均P<0.05)。见表1、2。
2.3 T2DM合并NAFLD的危险因素分析
以是否合并NAFLD为应变量(0=T2DM;1=T2DM+ NAFLD),以拟选定的血压、BMI等15个可疑影响因素作为自变量,先采用单因素分析(定量资料采用t检验),筛选出差异有统计学意义的14个可疑影响因素,然后用Logistic回归分析,结果采用逐步筛选变量法,以0.05的纳入标准进行分析。结果显示,BMI、TG、BUA、FPG和HbA1c进入回归方程,说明BMI、TG、BUA、FPG和HbA1c是T2DM合并NAFLD发生的主要危险因素,其与NAFLD发生呈独立正相关(P<0.05)。见表3。
表1 两组患者临床特征比较(s)
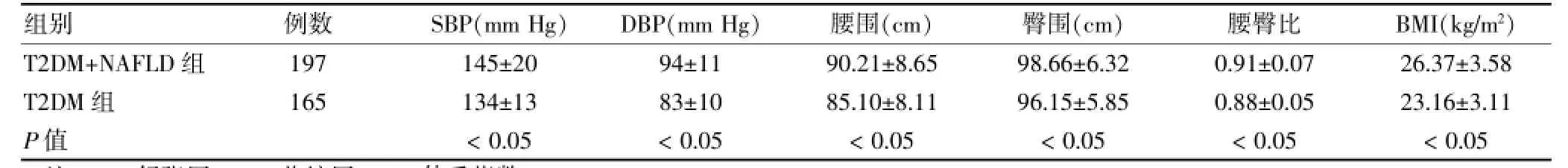
表1 两组患者临床特征比较(s)
注:SBP:舒张压;DBP:收缩压;BMI:体重指数;1 mm Hg=0.133 kPa
组别例数SBP(mm Hg)DBP(mm Hg)腰围(cm)臀围(cm)腰臀比BMI(kg/m2)T2DM+NAFLD组T2DM组P值197 165 145±20 134±13<0.05 94±11 83±10<0.05 90.21±8.65 85.10±8.11<0.05 98.66±6.32 96.15±5.85<0.05 0.91±0.07 0.88±0.05<0.05 26.37±3.58 23.16±3.11<0.05
表2 两组患者各生化指标比较s)
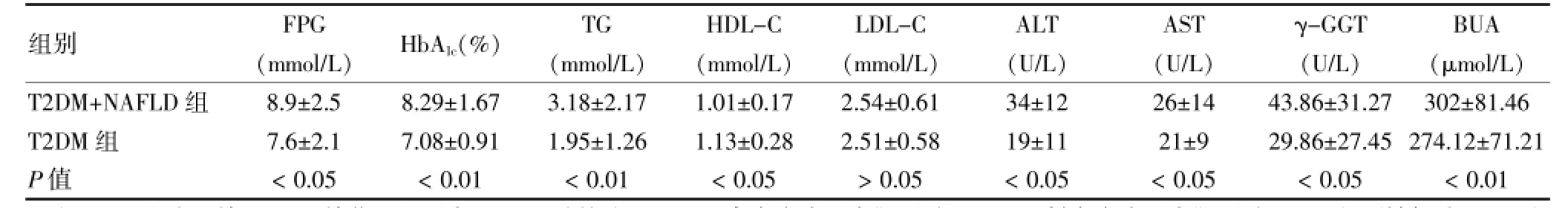
表2 两组患者各生化指标比较s)
注:FPG:空腹血糖;HbA1c:糖化血红蛋白;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;ALT:谷丙转氨酶;AST:谷草转氨酶;γ-GGT:γ-谷氨酰转移酶;BUA:血尿酸
组别FPG(mmol/L)HbA1c(%)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)ALT(U/L)AST(U/L)γ-GGT(U/L)BUA(μmol/L)T2DM+NAFLD组T2DM组P值8.9±2.5 7.6±2.1<0.05 8.29±1.67 7.08±0.91<0.01 3.18±2.17 1.95±1.26<0.01 1.01±0.17 1.13±0.28<0.05 2.54±0.61 2.51±0.58>0.05 34±12 19±11<0.05 26±14 21±9<0.05 43.86±31.27 29.86±27.45<0.05 302±81.46 274.12±71.21<0.01
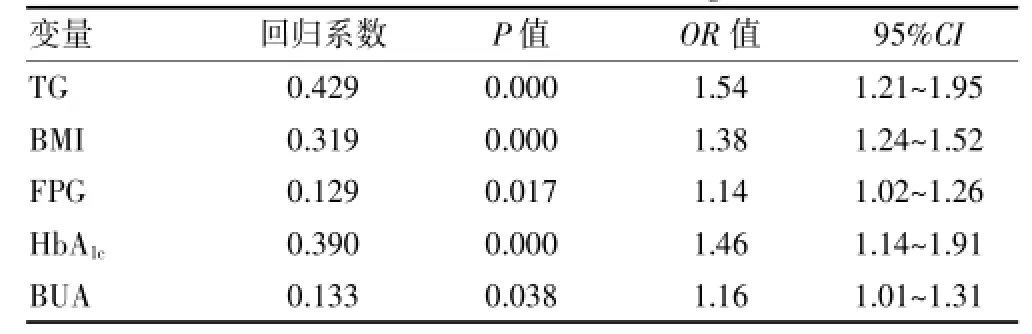
表3 T2DM合并NAFLD相关因素的Logistic回归分析
2.4 T2DM患者NAFLD与MS及冠心病的关系
T2DM+NAFLD组肥胖、血脂紊乱、高血压、冠心病以及MS的患病率均显著高于T2DM组(P<0.05或P<0.01)。见表4。

表4 两组患者MS及冠心病等疾病患病率比较[n(%)]
3 讨论
NAFLD是指除外过量饮酒和其他明确的损肝因素所致的肝细胞内脂肪沉积,包括从单纯的肝脂肪变性到非酒精性脂肪性肝炎(NASH),以致一部分最终发展为肝硬化,甚至演变为肝细胞癌[1]。当前,NAFLD患病率逐年上升,成为全球范围内常见的肝脏疾病。T2DM与NAFLD相互促进,其共同发病机制是胰岛素抵抗[8]。目前NAFLD发病机制普遍认同“二次打击”学说,胰岛素抵抗和脂肪组织脂解增高是其发病的中心事件[2]。第一次打击为肝脏脂肪堆积,胰岛素抵抗起关键作用,引起的单纯肝脂肪变性,肝脏脂肪变性又会加重胰岛素抵抗,并借助氧化应激、脂质过氧化反应、炎性反应等启动第二次打击,造成肝细胞损伤、炎症和纤维化。第二次“打击”增加了肝细胞对凋亡和坏死的易感性,进一步促进肝纤维化和肝硬化的发生、发展。
本研究结果显示,与T2DM组相比,T2DM+NAFLD组HbA1c、FPG水平明显升高,差异有统计学意义。Logistic回归分析进一步证实,HbA1c、FPG是T2DM合并NAFLD的独立危险因素。在糖尿病患者中,慢性高血糖症的“糖毒性”一方面可通过氧化应激对β细胞功能造成慢性、进行性的不可逆的损伤,另一方面降低胰岛β细胞葡萄糖刺激的胰岛素分泌并引起胰岛素抵抗。胰岛素抵抗使周围组织对胰岛素敏感性下降时,为了维持正常的糖代谢,胰岛β细胞数量代偿性分泌增多,功能进行性衰减,进一步加重糖代谢异常。由于胰岛素抵抗可减弱胰岛素对脂肪代谢的调节作用,产生大量游离脂肪酸并蓄积在肝细胞内。肝脏由首先利用糖氧化向利用脂质氧化转变,从而产生大量的肝脂质过氧化物,导致线粒体氧化超载,造成正常的脂肪合成及氧化途径减弱,形成脂肪肝[9]。
本研究中,T2DM合并NAFLD患者存在以TG升高、HDL-C降低为主要表现的脂质代谢紊乱,其原因可能是糖尿病患者存在的胰岛素抵抗,使游离脂肪酸过多流入肝脏,致使TG合成增多,以及使TG的水解酶脂蛋白脂酶和肝酯酶活性下降,TG水解减少,导致TG在肝脏过多蓄积,促成脂肪肝形成。胰岛素抵抗使脂蛋白脂酶活性降低,造成极低密度脂蛋白残粒清除减少和集聚增多,使血液中小而密的LDL-C比例增加。因此,T2DM往往伴有以高TG和低HDL-C为标志的脂质代谢紊乱,合并NAFLD的T2DM患者由于胰岛素抵抗的存在及胰岛β细胞功能的受损,存在更为严重的糖脂代谢紊乱。这是由于血脂代谢紊乱与T2DM及NAFLD相互促进。“脂毒性”可损害胰岛β细胞的分泌功能,并可抑制骨骼肌对葡萄糖的摄取,使肝脏糖异生增强,进而加重胰岛素抵抗和高血糖状态。胰岛素抵抗通过脂解作用和高胰岛素血症使脂质从脂肪细胞向非脂肪细胞特别是肝细胞内转移,导致肝细胞内脂肪堆积[10]。脂肪肝患者显著增多的游离脂肪酸可促进胰岛分泌胰岛素,长期高游离脂肪酸血症致使周围组织对胰岛素的敏感性降低,并使胰岛β细胞功能受损,导致胰岛素抵抗和胰岛素分泌障碍,加重糖代谢异常,形成胰岛素抵抗-糖毒性-脂肪肝-脂毒性之间的恶性循环。本研究显示,T2DM+NAFLD组的脂代谢紊乱更为严重,表现为TG的升高和HDL-C降低。Logistic逐步回归分析进一步证实,TG是T2DM合并NAFLD的独立危险因素。由于HDL-C对动脉血管壁有直接的保护作用,能促进动脉粥样斑块的消退;TG会促进动脉粥样硬化的发生,并影响HDL-C的代谢。脂代谢紊乱会增加心血管事件的发生,应尽早干预。
NAFLD与肥胖尤其是中心性肥胖关系密切。BMI和腰围是目前被公认的非常实用的评估肥胖程度和脂肪量的重要指标。本研究中BMI、腰围在两组间的差异有高度统计学意义(P<0.01);Logistic逐步回归分析亦显示,BMI是T2DM合并NAFLD的主要危险因素之一。由于肥胖患者脂肪细胞肥大,胰岛素受体稀疏,与胰岛素亲和力下降,可诱发胰岛素抵抗,导致周围组织摄取和利用葡萄糖能力下降,肝摄取游离脂肪酸增加,肝细胞将脂肪转运出肝脏的能力受损。另外本研究提示,T2DM腹型肥胖患者更容易发生脂肪肝。肥胖患者存在胰岛素抵抗,胰岛素抵抗的严重程度与脂肪沉积部位有关,以内脏性肥胖最为重要。内脏脂肪组织具有高脂解活性,能促进游离脂肪酸进入肝脏系统,改变胰岛素信号转导和肝糖原合成,同时还表达多种炎症细胞因子,损害胰岛素敏感性[11]。腹型肥胖患者腹内脂肪分解形成的游离脂肪酸更容易通过门静脉系统进入肝脏,作为底物合成TG,促进了脂肪肝的形成。故T2DM患者更需要积极干预肥胖,尤其是中心性肥胖的发生。
本研究结果显示,NAFLD组的患者血压、BMI、TG、BUA升高,HDL-C降低;Logistic回归分析显示BMI、TG、BUA水平与NAFLD发生明显相关,是T2DM合并NAFLD的独立危险因素。肥胖尤其是腹型肥胖、高甘油三酯血症、高尿酸血症等均与胰岛素抵抗有关,故胰岛素抵抗参与了NAFLD的发生和发展。另外这些代谢紊乱表现与2004年中华医学会糖尿病学分会关于MS的建议诊断标准[7]所提出的特征吻合,即肥胖、高甘油三酯血症、HDL-C降低和高血压等。MS的众多组分均在NAFLD组中出现,说明脂肪性肝病具有MS危险因素聚集的特点。大多数学者已经将NAFLD作为MS的组分之一,或MS在肝脏的表现,胰岛素抵抗是其主要的危险因素[1]。胰岛素抵抗贯穿在T2DM发生发展全程,而肝脏是造成胰岛素抵抗的重要器官。胰岛素抵抗通过脂解作用和高胰岛素血症导致肝细胞内脂肪堆积。MS的组分向心性肥胖与胰岛素抵抗相关,而游离脂肪酸代谢与胰岛素抵抗之间相关性更强。内脏脂肪分解释放大量的游离脂肪酸,首先通过门静脉直接进入肝脏,是导致脂肪肝和肝内胰岛素抵抗的重要原因[10]。故NAFLD能较好预测代谢紊乱危险因素聚集,可作为MS的特征之一。
本研究发现,与T2DM组相比,T2DM+NAFLD组冠心病检出率更高,差异有统计学意义。但本研究由于受患者检查不完善的限制,尚缺乏对患者发生脑血管事件的数据分析,受样本数量的限制也未通过校正传统的心血管疾病危险因素,进一步研究NAFLD与心血管事件的关系。大血管并发症是T2DM的主要并发症,美国糖尿病学会和心脏病学会均认为糖尿病是冠心病的等危症,即与冠心病具有同等的危险。实际上,MS的每一种成分都是发生心血管病变的危险因素,MS患者发生心血管疾病的风险高于正常人群。NAFLD作为潜在的MS组分之一,与MS的各个组分密切伴随,显然NAFLD患者发生心血管病的危险性更大。国外一项大样本T2DM患者NAFLD与心血管事件关系的前瞻性研究[12]显示,经校正传统心血管疾病风险因素后,NAFLD对发生心血管疾病的HR为 1.96(95%CI:1.4~2.7),故NAFLD可以预测心血管疾病的发生,是T2DM患者发生心血管疾病的独立危险因素。NAFLD会增加T2DM患者心血管并发症的发生和发展。
本研究中,T2DM+NAFLD组患者ALT、AST、γ-GGT显著高于单纯T2DM组。在排除了酒精性肝病、病毒性肝炎以及其他肝脏疾病之后,脂肪肝患者的肝功能异常主要表现为转氨酶和转肽酶的升高。ALT和AST是反映肝细胞损害的常用的酶学检查指标,血清转氨酶活性可以反映肝细胞损害程度。ALT主要由肝脏产生,肝脏特异性强。在确诊的NAFLD患者中,ALT一定程度上反映肝组织的炎症程度。GGT广泛存在于人体内,是谷胱甘肽在细胞外分解代谢的活性酶,调节组织的抗氧化能力。谷胱甘肽在机体的氧化应激中起着重要的抗氧化保护作用。NAFLD患者氧化应激增强是单纯性脂肪肝进展为非酒精性脂肪性肝炎,导致肝细胞损伤和纤维化的重要原因。谷胱甘肽-GGT复合物具有高度的氧化能力,对组织器官包括肝脏产生一系列病理生理效应,GGT升高反映了肝细胞损伤,可作为肝纤维化的简易评判指标[13]。有学者研究认为,ALT和γ-GGT的轻度升高提示了脂肪肝与高代谢综合征的存在,而进行性的γ-GGT升高则可能预示着脂肪肝的加重和发生纤维化[14]。有前瞻性研究发现,NAFLD继发的肝酶(ALT和谷氨酰转肽酶)升高是T2DM的独立危险因素[15]。另有国外研究显示,GGT与胰岛素抵抗相关,GGT增高者MS及心脑血管发生风险增加[16]。故早期关注转氨酶的变化情况并采取积极的干预措施有可能会降低代谢相关疾病发生的风险。
综上所述,T2DM和NAFLD之间形成恶性循环,T2DM会增加NAFLD的发生并加快其病情进展;合并NAFLD的T2DM代谢紊乱更为严重,NAFLD会增加T2DM并发症的发生和发展。但目前存在着对于T2DM患者的肝脏病变重视不足的问题,医师们更多关注T2DM患者血糖、血脂的控制情况,或更多关注预防心脑血管、肾脏等并发症,常常忽略对T2DM患者肝脏病变的常规筛查,有时即使筛查出NAFLD,也多疏于管理和干预。但是大量研究表明,T2DM患者伴发NAFLD、NASH情况明显增加,且易于向进展期肝病恶化,发生不良肝病结局及病死风险增加[17]。故应重视T2DM患者伴发NAFLD的早期筛查,并像关注T2DM血糖管理一样关注NAFLD的管理,以减少肝硬化、肝功能衰竭等不良肝病的结局。由于合并NAFLD的T2DM患者存在更为严重的糖代谢和脂代谢紊乱,NAFLD与MS各组分之间存在密切联系,有着更多的心脑血管危险因素集聚现象并导致心脑血管事件发生。因此,T2DM合并NAFLD患者应强化体重、血糖以及血脂等的控制达标,积极改善胰岛素抵抗,从而防止心脑血管终点事件的发生。
[1]中华医学会内分泌学分会肝病与代谢学组.中华医学会内分泌学分会“非酒精性脂肪性肝病与相关代谢紊乱诊疗共识”[J].中华内分泌代谢杂志,2010,26(7):531-534.
[2]周健,贾伟平,包玉倩,等.2型糖尿病患者脂肪肝患病率调查及危险因素分析[J].中华医学杂志,2007,87(32):2249-2252.
[3]中华医学会内分泌学分会.中国2型糖尿病防治指南2010[J].中国糖尿病杂志,2012,20(1):S1-S37.
[4]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[5]中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华心血管病杂志,2011,39(7):579-616.
[6]中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390-419.
[7]中华医学会糖尿病学分会代谢综合征研究协作组.中华医学会糖尿病学分会关于代谢综合征的建议[J].中华糖尿病杂志,2004,12(3):156-161.
[8]Gmnbaek H,Thomsen KL,Rungby J,et al.Role of nonalcoholicfatty liver disease in the development of insulin resistance and diabetes[J].Expert Rev Gastroenterol Hepatol,2008,2(5):705-711.
[9]郭敏,郗光霞,杨娜,等.2型糖尿病合并非酒精性脂肪性肝病的代谢相关危险因素分析[J].中华肝脏病杂志,2014,22(8):631-635.
[10]王玉,梁军,李洪,等.非酒精性脂肪肝纤维化评分与代谢综合征及其各组分的相关性研究[J].中华内分泌代谢杂志,2013,29(5):406-409.
[11]邹大进,宋丹丹.代谢正常肥胖亚群研究的重要性[J].中华糖尿病杂志,2013,5(3):129-131.
[12]Targber G,Bertolini L,Rodella S,et al.Nonalcoholic fatty liverdiseaseisindependentlyassociatedwithanincreased incidence of cardiovascular events in type 2 diabetic patients[J].Diabetes Care,2007,30(8):2119-2121.
[13]闫焱,卞华,夏明峰,等.住院2型糖尿病患者肝脏疾病谱调查及非酒精性脂肪性肝病相关危险因素分析[J].中华医学杂志,2013,93(4):270-274.
[14]Williams CD,Stengel J,Asike MI,et al.Prevalence of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis among a largely middle-aged population utilizing ultrasound and liver biopsy:a prospective study[J].Gastroenterology,2011,140(1):124-131.
[15]Fraser A,Harris R,Sattar N,et al.Alanine aminotransforase,gammnglutamyltransferase,and incident diabetes:the British Women's Heart and Health Study and metaanalysis[J].Diabetes Care,2009,32(4):741-750.
[16]Banderas DZ,Escobedo J,Gonzalez E,et a1.γ-Glutamyltransferase:a marker of nonalcoholic fatty liver disease in patients with the metabolic syndrome[J].Eur J Gastroenterol Hepatol,2012,24(7):805-810.
[17]高鑫,王杉杉.重视非酒精性脂肪肝和2型糖尿病的关系研究[J].中华肝脏病杂志,2014,22(3):161-164.
Investigation of related factors of type 2 diabetes mellitus combined with nonalcoholic fatty liver
SONG WeiLIU GuiqinSONG JianqiLI Jie
Hongxing Hospital,Daxing District,Beijing100076,China
Objective To discuss the main related factors of type 2 diabetes mellitus(T2DM)combined with nonalcoholic fatty liver(NAFLD).Methods 362 cases of T2DM patients hospitalized in Internal Medicine Department of Beijing Daxing District Hongxing Hospital from January 2012 to June 2014 were selected.165 cases had T2DM(T2DM group), while 197 cases had T2DM combined with NAFLD(T2DM+NAFLD group).Clinical data of patients were collected. Blood sugar,glycosylated hemoglobin,blood fat,liver function,uric acid levels were detected.Logistic regression was used to analyze the major risk factors of T2DM combined with NAFLD.Results Compared with the T2DM group,the body mass index(BMI),waist circumference,hip circumference,waist-to-hip ratio,blood pressure,blood sugar, glycosylated hemoglobin,triacylglycerol,ALT,AST,GGT and uric acid levels all increased,HDL-C level decreased in the T2DM+NAFLD group,the differences were statistically significant(P<0.05).Results of Logistic regression analysis showed that BMI,triacylglycerol,blood sugar,glycosylated hemoglobin and uric acid were the independent risk factors of T2DM combined with NAFLD(OR=1.38,1.54,1.14,1.46,1.16,all P<0.05).Conclusion Obesity,high uric acid hematic disease,high blood sugar levels are closely related with T2DM combined with NAFLD.
Type 2 diabetes mellitus;Fatty liver;Nonalcoholic;Risk factor
R575.5
A
1673-7210(2015)06(b)-0096-05
2015-01-06本文编辑:程铭)
