云南野生杨梅快繁体系的建立
2015-01-06蓝增全
孔 梅,蓝增全*,吴 田
(西南林业大学a环境科学与工程学院,b园林学院,云南昆明 650224)
云南野生杨梅快繁体系的建立
孔 梅a,蓝增全a*,吴 田b*
(西南林业大学a环境科学与工程学院,b园林学院,云南昆明 650224)
以云南野生杨梅种子为材料,在MS培养基中添加不同浓度及配比的激素,研究杨梅无菌快繁的技术体系。试验结果表明,用20%的次氯酸钠处理种子,污染率较低,为11.11%;MS+0.5 mg·L-16-BA+ 0.1 mg·L-1NAA+6 mg·L-1PVP的培养基有利于芽的增殖,丛生芽最多;MS+2.0 mg·L-16-BA+0.2 mg· L-1NAA+6 mg·L-1PVP的培养基有利于茎节的生长;1.5 g·L-1的活性炭对杨梅无菌苗的防褐化效果最好,褐化率仅为32%;MS+2.0 mg·L-1IBA的培养基有利于诱导生根,生根率达66.67%。
杨梅;种子;褐化;快速繁殖
杨梅可用实生、压条和嫁接方式进行繁殖,目前主要采取嫁接方式进行繁殖[5],但是嫁接存活率低,周期长,效率低,难以满足大规模的生产化需求[6-7],因此,建立杨梅快速繁殖技术体系具有较高的经济价值和现实意义。云南野生杨梅即矮杨梅,其Vc含量高于栽培种,含酸量也高于栽培种,具有很高的开发价值。本研究以云南野生杨梅为材料,研究其无菌快繁技术体系,希望为杨梅的大规模育苗提供科学依据和切实可行的方法。
1 材料与方法
1.1 供试材料
杨梅种子采自云南省曲靖市会泽县矿山镇水子树村大包山,地理坐标103°18′E,26°25′N,挑选成熟饱满种子为材料。
1.2 处理设计
1.2.1 种子的发芽处理
用冷水浸种48 h后,去壳放入有滤纸的培养皿中待用。在无菌条件下,将浓硫酸预处理的种子用不同浓度的次氯酸钠(0%,10%,20%,25%)浸泡4 min,再用75%的酒精浸泡30 s,最后用无菌水清洗3次,接种于MS培养基上。30 d后统计其污染率,污染率/%=污染种子数/接种种子总数×100。同一处理共3瓶,设3次重复试验。
1.2.2 杨梅无菌苗增殖培养基筛选
孔子说:“知之者不如好之者,好之者不如乐之者。”爱因斯坦又说:“兴趣是最好的老师。”这要求老师在导入新课时,精心设计问题情景,激发学生的学习兴趣和欲望。让学生在轻松愉快的学习氛围中积极主动学习,教师引导学生在精心设计的问题情景中积极探索,体验每一步求和过程,感受成功喜悦,进一步激发思维创新。
待幼苗长至3~4 cm时,在无菌条件下,切下幼苗带腋芽的茎段,分别接种于添加不同浓度的6-BA和NAA的培养基上进行培养,共设计16个组合,每瓶接种4~5个外植体,每组5瓶,60 d后统计并记录无菌苗增殖情况以及长势。
1.2.3 活性炭处理
向筛选出的最佳培养基中添加活性炭,使培养基中活性炭的浓度分别为0,0.5,1.0,1.5,2.0 g·L-1,培养45 d以后,观察植株褐化及生长情况,并统计褐化率,褐化率/%=褐化苗数/接种苗数×100。共设计5个组合,每个组合3次重复试验。
1.2.4 根的诱导
向MS培养基中分别添加不同浓度的IBA,NAA和IAA,诱导无菌苗生根。共设计14个组合,每组5瓶,每瓶5~6株外植体,30 d后统计生根率,生根率/%=(生根株数/接种株数)×100。
2 结果与分析
2.1 不同浓度次氯酸钠处理对杨梅种子发芽的影响
不同浓度次氯酸钠处理对杨梅种子污染率的影响不同,由表1可知,次氯酸钠浓度为20%时,污染率最低,为11.11%。因此,杨梅种子发芽中,次氯酸钠最佳消毒浓度为20%。
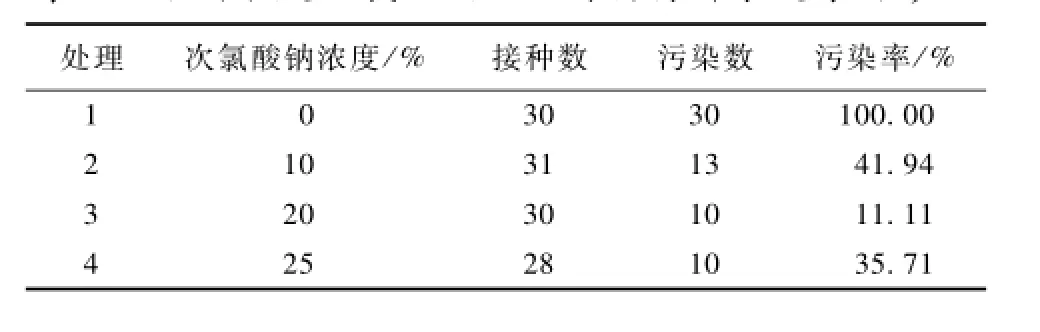
表1 不同浓度次氯酸钠处理对杨梅种子发芽的影响
2.2 不同激素配比对杨梅无菌苗增殖的影响
不同激素配比对杨梅无菌苗增殖的影响不同,详见表2。当6-BA浓度为0.5 mg·L-1、NAA浓度为0.1 mg·L-1时,植株茎节较细,无菌苗长势良好,丛生芽较多,为20个,芽长为3 cm,株高为5 cm(图1中A)。当6-BA浓度为2.0 mg· L-1、NAA的浓度为0.2 mg·L-1时,丛生芽较少,仅有10个,芽长为2 cm,株高为8 cm,叶片较小,节间较长,茎节粗,无菌苗长势良好(图1中B)。因此,综合考虑,诱导杨梅无菌苗芽增殖的最优培养基为MS+0.5 mg·L-16-BA+0.1 mg· L-1NAA+6 mg·L-1PVP;诱导杨梅无菌苗茎节增高增长的最优培养基为MS+2.0 mg·L-16-BA +0.2 mg·L-1NAA+6 mg·L-1PVP。

表2 不同激素配比对杨梅无菌苗增殖的影响

图1 不同激素配比对杨梅无菌苗增殖的影响
2.3 不同浓度活性炭对无菌苗褐化与生长的影响
不同浓度活性炭对无菌苗褐化以及生长的影响不同(表3)。当活性炭浓度为1.5 g·L-1时,无菌苗褐化率最低,为32%;当浓度为2 g·L-1时,褐化率又升高至40%。说明活性炭浓度为1.5 g· L-1时,抑制杨梅无菌苗褐化效果最好。
不同浓度的活性炭对外植体生长的影响也不同,活性炭浓度为0.5 g·L-1时,植株丛生芽少,仅有3个,株高为8 cm,茎节长,叶片较小且偏黄,植株较纤细,长势较差;活性炭浓度为1,1.5,2.0 g·L-1时,植株丛生芽多,植株较矮小,叶片较大,长势较好,其中活性炭浓度为1.5 g· L-1时,叶片最浓郁茂盛,植株高,前20 d植株长势较好,但后期枯叶较多。
由此可见,浓度为1.5 g·L-1的活性炭不仅可以有效抑制杨梅无菌苗褐化,还能促进植株生长。
2.4 不同激素配比对无菌苗生根诱导的影响
杨梅无菌苗植株纤细,生根较难,不同激素配比对根诱导的影响各不相同。杨梅无菌苗生根较慢,20 d才开始生根,30 d后统计生根率。结果(表4)表明,MS+2.0 mg·L-1IBA培养基中的无菌苗生根率较高,达66.67%,根长且粗壮,长势较好;MS+1.5 mg·L-1NAA培养基中的无菌苗生根率相对较高,为21.82%,根粗,无菌苗长势好;MS+1.5 mg·L-1IAA培养基中无菌苗生根率较低,为8.93%;培养基中同时添加IBA,NAA和IAA时,无菌苗生根率为47.83%,根粗,无菌苗长势弱。
综上所述,IBA对云南野生杨梅无菌苗诱导生根效果比IAA和NAA好,且单激素比激素组合生根率更高。
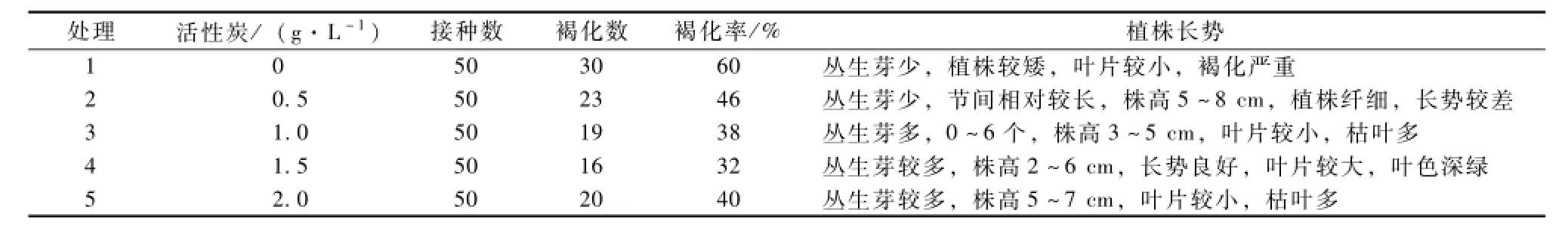
表3 不同浓度活性炭对无菌苗褐化以及无菌苗生长的影响
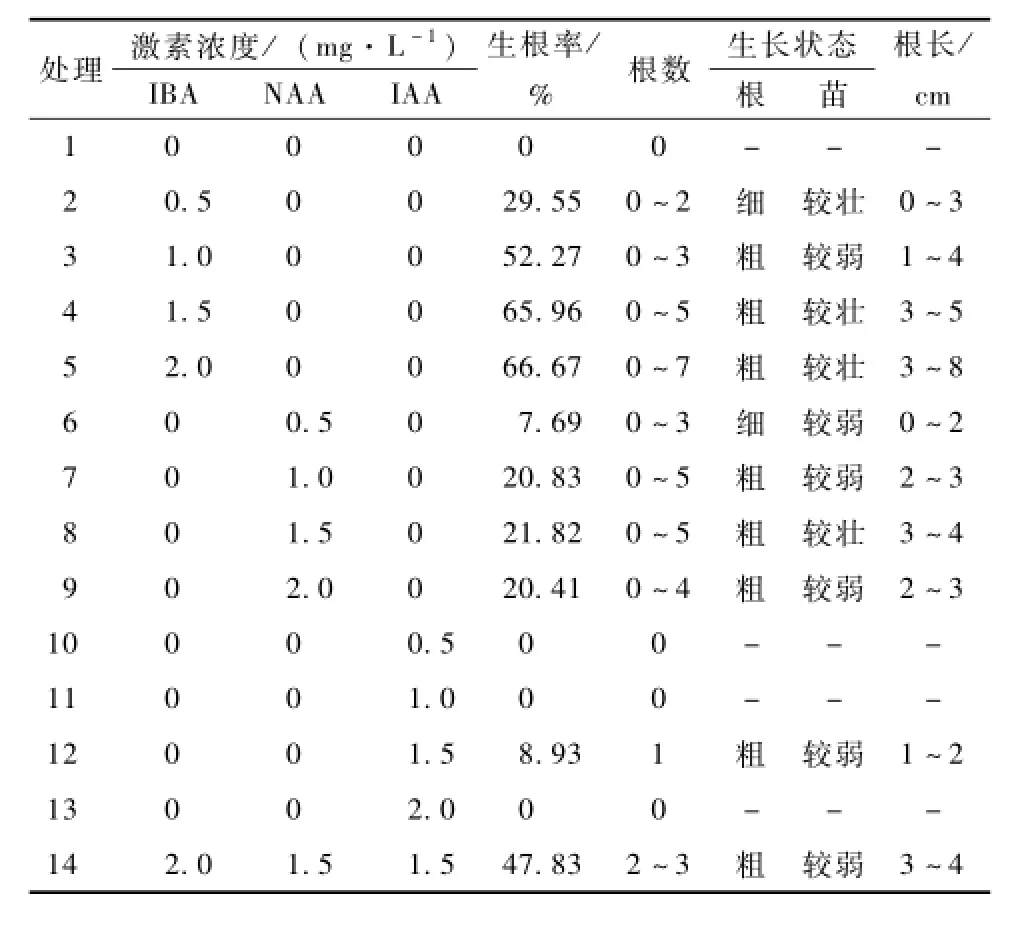
表4 不同激素配比对无菌苗生根诱导的影响
3 小结与讨论
利用组织培养进行杨梅种苗繁殖,能够在较短时间内获得大量优质健康种苗,为工厂化繁育种苗、降低生产成本以及保存品种优良特性等提供了技术支持。本研究建立了杨梅高效组培再生体系,繁殖系数高。本研究表明,野生杨梅种子发芽的最佳次氯酸钠消毒浓度是20%,污染率为11.11%;诱导杨梅无菌苗芽增殖的最优培养基为MS+ 0.5 mg·L-16-BA+0.1 mg·L-1NAA+6 mg·L-1PVP,诱导杨梅无菌苗茎节生长的最优培养基为MS+2.0 mg·L-16-BA+0.2 mg·L-1NAA+6 mg· L-1PVP;能有效抑制无菌苗褐化的活性炭浓度为1.5 g·L-1,褐化率可降至32%;无菌苗最适生根培养基为MS+2.0 mg·L-1IBA,生根后植株生长正常,叶片舒展。
目前,关于杨梅组织培养的研究报道还比较少,杨梅属于木本植物,许多木本植物组织培养过程中存在着难以解决的外植体褐变[8]、试管苗玻璃化[9]和生根难[10]等问题。褐化与菌类污染和玻璃化现象并称为植物组织培养的三大难题[11-13]。木本植物含酚类物质,当外植体被切割后,切口附近细胞受到伤害,酚类化合物和多酚氧化物向外流出,酚类化合物被氧化成褐色的醌类物质和水,醌类物质又在酪氨酸酶的作用下,使外植体的蛋白质聚合,导致培养基褐变,影响外植体的正常生长[14]。李师翁等[15]在沙棘嫩茎的愈伤组织培养中发现,及时给试验材料转瓶、更换新鲜培养基(周期不超过4周),可有效降低愈伤组织的褐变,但转瓶次数不宜太多,一般2~3次为宜。在本研究中,杨梅外植体褐化情况比较严重,培养基中添加了PVP和不同浓度的活性炭,褐化情况得到缓解,但是仍有部分外植体褐化,要完全消除褐化的影响,还需进一步试验研究。此外,试验中还发现,不同浓度的活性炭对无菌苗的增殖以及生长也有一定的影响,但是之前未见报道,有待进一步研究证实。
本试验中,诱导杨梅无菌苗芽增殖的最优培养基和诱导杨梅无菌苗茎节增高增长的最优培养基分别是MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA+ 6 mg·L-1PVP和MS+2.0 mg·L-16-BA+0.2 mg· L-1NAA+6 mg·L-1PVP,所用激素的浓度与前人研究结果有所差异[16],这可能是因为所用的起始材料品种不同、基因不同、生理状态不同等所致,有待进一步研究证实。此外,在根系诱导过程中,由于培养基成分、培养环境、激素和激素浓度等各种因素,会引起的组培苗失活,叶片顶端或整株黄化[17],本试验中根系诱导50 d左右,组培苗出现黄化及枯死现象,此时需要及时转瓶,将无菌幼苗转接到新鲜的培养基上,才能保证植株的营养吸收及正常生长。
在木本植物器官发生过程中,细胞分裂素和生长素对芽的诱导和生长发育均起着重要作用,诱导不定芽的形成时,细胞分裂素用量一般高于生长素的用量或只用细胞分裂素[18-20];而诱导不定根时,只用生长素或配合使用较低浓度的细胞分裂素[21-22]。试验中对比了不同浓度不同激素对外植体增殖及生长的影响,筛选出了促芽增殖和促茎节生长以及诱导生根的最佳培养基,这为后续的杨梅植株离体再生以及遗传转化试验奠定了一定的基础,在生产上也可按条件所需添加不同的激素浓度。
[1] 俞德俊.中国果树分类学[M].北京:农业出版社,1979.
[2] 中国科学院中国植物志编委会.中国植物志[M].北京:科学出版社,1974:411-415.
[3] 缪松林,王定祥.杨梅[M].杭州:浙江科学技术出版社,1987:9-14.
[4] 杨宗金,何冬梅.大理州野生矮杨梅造林技术应用研究[J].林业建设,2003,23(3):37-40.
[5] 郑光华.我国种子生理研究的概况[J].植物学通报,1983,19(1):14-19.
[6] 康志雄,骆文坚,吕爱华,等.杨梅栽培气候区划与应用研究[J].果树学,2002,19(2):118-122.
[7] 孙钧.浙江省杨梅产业现状与发展对策[J].浙江柑橘,2005,22(4):34-36.
[8] 曹孜义,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,1999:33-37.
[9] 徐妙珍,张雅君,李伟,等.林木组织培养的障碍因素及其对策(二)[J].林业科技,1992,17(3):10-12.
[10] 王丽娟,田京伟.植物组织培养的研究进展[J].运城高等专科学校学报,1999(3):8-11.
[11] 孙周平,褚丽敏.刺五加腋芽培养中抗褐化初探[J].植物生理学报,2008,44(6):1137-1139.
[12] 陈亚鸿,洪磊,陈雄庭,等.减少秋石斛在组织培养中的褐化研究[J].现代农业科学,2009,16(3):44-48.
[13] 王立娅,方正,李英丽,等.蝴蝶兰组织培养中防褐化技术研究[J].河北农业大学学报,2008,3 l(5):33-44.
[14] 崔堂兵,郭勇,张长远.植物组织培养中褐变现象的产生机理及克服方法[J].广东农业科学,2001(3):16-18.
[15] 李师翁,范小峰,卢东平.大果良种沙棘愈伤组织诱导及植株再生的研究[J].西北植物学报,2001,21(2):262-266.
[16] 李晓强.杨梅组织培养技术研究[D].南宁:广西大学,2010.
[17] 吴秋峰,毛军平,吴月燕.鸢尾组织培养过程中根系的诱导与移栽试验[J].浙江农业科学,2010(4):762-765.
[18] 谢耀坚.桉树组织培养研究进展[J].世界林业研究,2000,13(6):14-19.
[19] 郑均宝,王进茂,杜克久,等.油松体细胞无性系的建立[J].遗传学报,1996,23(4):314-317.
[20] 范国强,蒋建平,贺窑青,等.悬铃木叶片植株再生系统的建立[J].园艺学报,2003,30(2):236-238.
[21] 孙清荣,石荫坪,孙洪雁,等.肥城桃幼子叶不定植株再生[J].山东农业大学学报:自然科学版,1999,30(4):395-397.
[22] 郑晴霞.绒毛皂荚离体茎段培养及再生植株的细胞组织学研究[J].湖南农业大学学报,1994,20(3):244-248.
(责任编辑:侯春晓)
S 667.6
:A
:0528-9017(2015)10-1557-04
文献著录格式:孔梅,蓝增全,吴田.云南野生杨梅快繁体系的建立[J].浙江农业科学,2015,56(10):1557-1560.
10.16178/j.issn.0528-9017.20151008
2015-04-30
国家星火计划诺丽良种的示范与推广(2014GA830017);国家星火计划金花茶种苗繁育与茶膏加工技术的示范推广(2014GA830016)
孔 梅(1990-),女,云南曲靖人,硕士研究生,研究方向为森林生态学。E-mail:1229313040@qq.com。
蓝增全,教授,研究方向为植物生态学。E-mail:km lanzengquan@gmail.com;吴 田,副教授,研究方向为植物生物技术。E-mail:2351417655@qq.com。
