Caveolae在CGRP保护人脐静脉内皮细胞中的作用及机制
2015-01-03周孝钱肖云彬全海燕骆竟妃彭虹艳秦旭平
朱 怡,周孝钱,肖云彬,全海燕,骆竟妃,彭虹艳,秦旭平*
(1.南华大学附属第二医院骨外科,湖南衡阳421001;2.南华大学药物药理研究所;3.湖南省儿童医院心血管内科)
Caveolae在CGRP保护人脐静脉内皮细胞中的作用及机制
朱 怡1,周孝钱2,肖云彬3,全海燕2,骆竟妃2,彭虹艳2,秦旭平2*
(1.南华大学附属第二医院骨外科,湖南衡阳421001;2.南华大学药物药理研究所;3.湖南省儿童医院心血管内科)
目的 探讨Caveolae对降钙素基因相关肽(CGRP)抑制过氧化氢(H2O2)诱导的人脐静脉内皮细胞(HUVECs)损伤作用的影响及其机制。 方法 体外培养HUVECs,分别用CGRP和/或H2O2处理细胞,光学显微镜观察细胞形态学和密度的变化;流式细胞术观察细胞的增殖和周期分布;β-环糊精(β-CD)用于破坏caveolae结构;Western-blot检测caveolin-1表达。 结果 与正常组比较,CGRP组细胞密度增加,S期细胞数明显增多,H2O2组细胞密度降低,S期细胞数明显减少;CGRP预孵育细胞能抵抗H2O2引起的细胞数目减少;β-CD剥夺胆固醇,破坏caveolae结构,HUVECs形态学发生改变,但CGRP诱导的细胞密度和细胞增殖进一步提升,恢复胆固醇后,该作用被取消。与对照组比较,CGRP组细胞caveolin-1表达水平降低(P<0.05);H2O2组细胞caveolin-1水平上升(P<0.05),给予CGRP预孵育后,能显著逆转H2O2诱导的caveolin-1表达(P<0.05);β-CD破坏caveolae结构后,增强CGRP下调HUVECs caveolin-1表达的作用(P<0.05),增加胆固醇Caveolae结构有所恢复且该作用被削弱。结论 Caveolae结构完整性对CGRP保护H2O2损伤HUVECs有一定影响,破坏caveolae结构能增强CGRP对H2O2损伤的HUVECs的增殖作用,其机制可能与增强CGRP下调氧化应激导致的caveolin-1的表达有关。
过氧化氢; 降钙素基因相关肽; caveolae; caveolin-1; 内皮细胞
降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是由辣椒素敏感性感觉神经末梢释放的神经肽,是目前发现的内源性最强的舒血管活性物质之一,有舒张血管和收缩心肌的作用,抑制血管平滑肌细胞增殖和内皮细胞凋亡[1]。Caveolae是细胞膜表面特异性内陷结构,是细胞内多数信号分子和转导通路的整合器。caveolin-1是caveolae表面标记蛋白和结构蛋白,并通过其脚手架区域在caveolae区结合其他信号分子发挥负性调节的作用[2]。前期研究工作表明,CGRP能对抗H2O2引起的血管内皮细胞损伤,并上调caveolin-1的表达[3]。本研究以体外培养人脐静脉内皮细胞株(HUVECs)为研究对象,采用H2O2诱导损伤建立血管内皮细胞氧化损伤模型,通过观察HUVECs生长、细胞周期分布及caveolin-1蛋白的表达,研究CGRP对氧化损伤内皮细胞的保护作用,探讨caveolae结构完整性对CGRP保护内皮细胞作用的影响。
1 材料与方法
1.1 主要材料与试剂
人脐静脉内皮细胞细胞株(HUVECs,型号:C-003-5C)由本实验室保存。 CGRP,β-cyclodextrin(β-CD)为Sigma公司产品,Cholesterol(USA Amresco,Inc.),胎牛血清购自杭州四季青公司。RPMI-1640的培养基购自美国Gibco公司,抗体及显色试剂购自武汉博士德生物有限公司。蛋白印迹所用试剂均为USA Amresco,Inc.公司产品。
1.2 人脐静脉内皮细胞培养
取冻存的HUVECs,解冻后置于50 mL无菌培养瓶中,加入适量含10%胎牛血清RPMI-1640培养基,在37℃、5%CO2、95%空气饱和湿度的培养箱中培养。待长至80%左右时,用0.25%胰酶消化传代。取长势良好的3~10代细胞用于实验。
1.3 实验分组及处理因素
在前期实验的基础上[3],通过量效关系确定H2O2及CGRP作用于HUVECs的浓度。对照组为0.1%FBS培养的静止期细胞;实验组细胞分别用H2O2(0.5 mmol/L),CGRP(100 nmol/L),β-CD(5 mmol/L)胆固醇(Cholesterol 25μmol/L)按实验目的和程序处理细胞(见结果)。采取细胞计数板和光镜下肉眼观察的方法分析细胞密度的变化。
1.4 Western Blot
各组细胞弃去细胞培养液,用冰PBS洗涤3次,加入预冷的RIPA裂解液临用前加入0.1 mg/mL PMSF裂解细胞,置冰上10 min,用细胞刮匙刮取蛋白,再以超声波粉碎细胞,4℃ 10 000 g离心15 min,取上清分装后于-85℃超低温冰箱冻存。BCA法测蛋白质含量后,每泳道上30μg总蛋白量进行SDSPAGE电泳分离,然后转移到PVDF膜上,5%脱脂奶粉的TBST封闭1 h,加入一抗(兔抗caveolin-1,1∶400;鼠抗β-actin,1∶300)4℃孵育过夜TBST洗膜8 min/次,洗3次,加入辣根过氧化物酶标记的山羊抗兔二抗(1∶1 000)或兔抗小鼠二抗(1∶1 000),室温下摇床孵育2 h,常规洗膜,化学发光剂显色,胶片显影,扫描胶片用凝胶系统分析系统测光密度值。结果以各目的蛋白和β-actin的灰度比值表示。
1.5 PI单染流式细胞术观察HUVECs细胞周期分布情况
取3~10代对数生长期的 HUVECs,以2×105个/mL接种于50 mL培养瓶中,置于37℃、5%CO2、95%空气饱和湿度的培养箱中培养,0.1%FBS培养基同步化细胞24 h,按分组加入不同的处理因素继续孵育后收集细胞。PBS液清洗3次,0.25%胰蛋白酶消化细胞,10%FBS的细胞培养液终止消化,吹打成细胞悬液后,4℃、75 g离心5 min,PBS液清洗3次,弃上清,用体积分数为75%的冰乙醇吹打成单细胞悬液,吸入到1.5 mL大的EP管,4℃固定过夜。检测前,75 g离心10 min,弃上清,PBS液清洗3次,调整细胞浓度为1×106/L。加PI荧光染料,350目尼龙网滤膜过滤除去细胞团块,于4℃避光染色30 min后,上流式细胞仪(FCM)检测各期细胞DNA的含量。计算30 000个细胞,观察细胞的增殖以及细胞周期情况。
一般情况下,细胞无增殖活动时皆停留于G0G1期,在某些因素激活下,启动DNA合成进入S期(DNA合成期)及M期(DNA分裂期),使细胞增殖分化。可根据细胞周期各时相比例,计算增殖指数(proliferation index,PI),以衡量细胞的分裂增殖活动。PI的计算公式为:PI=(S+G2M/(G0G1+S+G2M),PI值越大表示细胞增殖越明显。
1.6 统计学处理
所有数据均采用均数±标准差()表示。均采用SPSS14.0 for windows软件进行分析,组间差异比较用单因素方差分析(One-Way ANOVA)及t检验,用P<0.05判断统计差异有无显著性。
2 结 果
2.1 Caveolae对CGRP保护HUVECs生长作用的影响
HUVECs分别给予CGRP(100 nmol/L)或H2O2(0.5 mmol/L)处理24 h后,光学显微镜下观察发现:与对照组相比,CGRP能增加HUVECs的密度,形态与排列与对照组无差别(图1B),而H2O2组形态变小变圆,排列不规则(图1C)。CGRP预孵育细胞30 min能显著改善H2O2对细胞的损伤作用(图1D),胞浆变得饱满。用 β-环糊精(β-CD)破坏caveolae结构后,光学显微镜下观察,细胞密度增加,但形状不规则(图1F);预先加入胆固醇保护Caveolae结构,细胞多角形状更不规则,与CGRP+H2O2组相比,细胞密度基本恢复,各组细胞数的变化如图2所示。
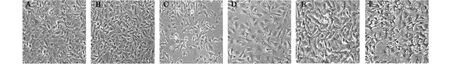
图1 HUVECs形态学图( ×100). A:Control,B:CGRP,C:H2O2;D:CGRP+H2O2;E:β-CD+CGRP+H2O2;F:Cholesterol+β-CD+CGRP+H2O2

图2 各组细胞数的变化
2.2 Caveolae对HUVECs周期分布的影响
对细胞周期图统计分析发现,与对照组比较,单用CGRP能使S期细胞增多(图3B);H2O2组S期细胞较正常组减少(图3C);CGRP预孵育细胞30 min使H2O2组S期细胞明显增多(图3D),PI值较H2O2增大(P<0.05)。说明CGRP能够对抗H2O2引起的S期细胞的减少,促进正常和受损HUVECs的增殖。给予 β-CD,细胞 PI值增大,与CGRP+H2O2组相比,S期细胞数目增加;预先加入胆固醇,该作用被削弱(见表1,P<0.05)。由此可见,caveolae在CGRP促进氧化损伤HUVECs S增殖过程中可能起负性调节的作用。
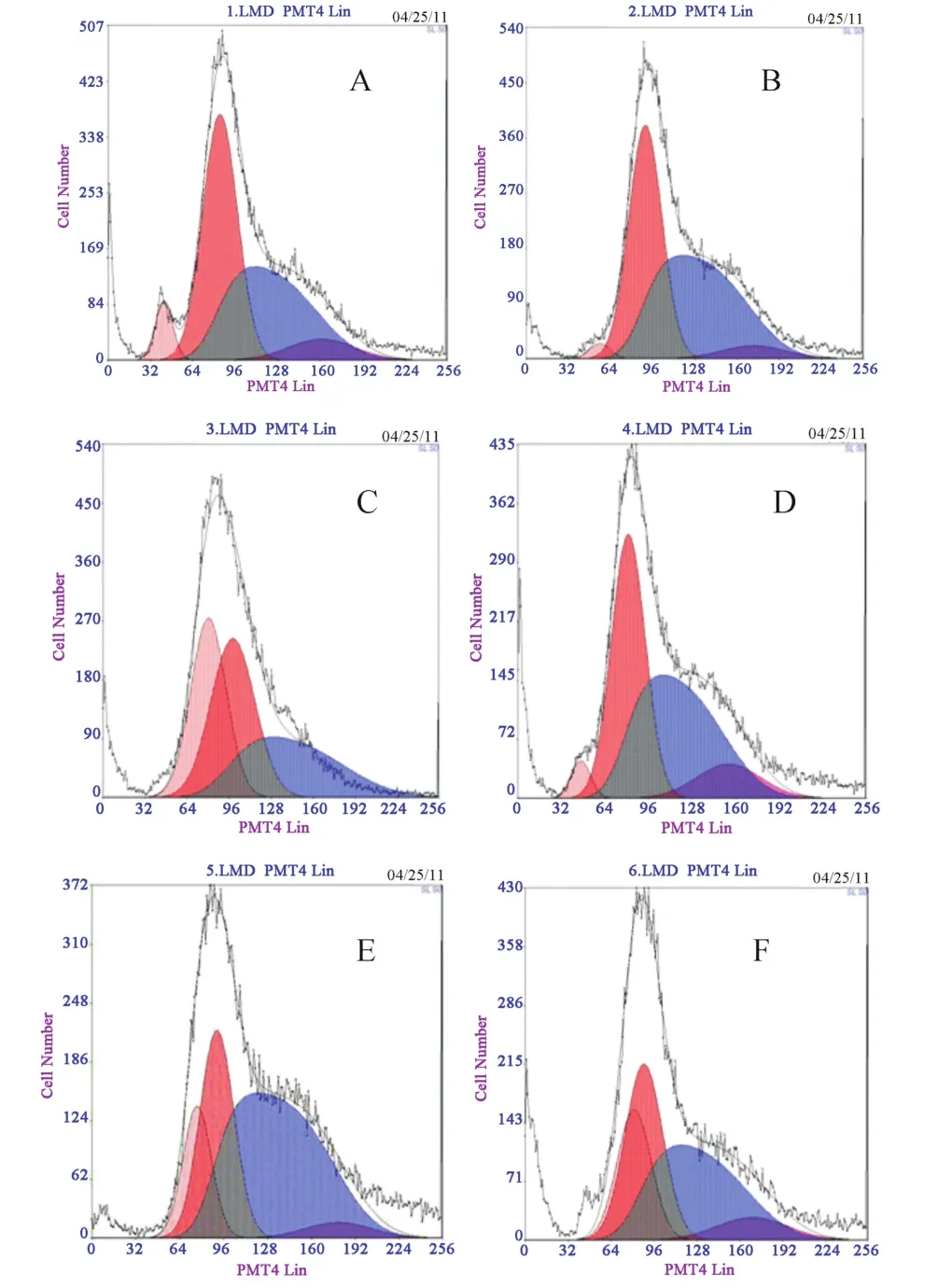
图3 细胞周期分布的流式细胞仪代表图
表1 Caveolae对HUVECs周期分布影响情况(n=3)_
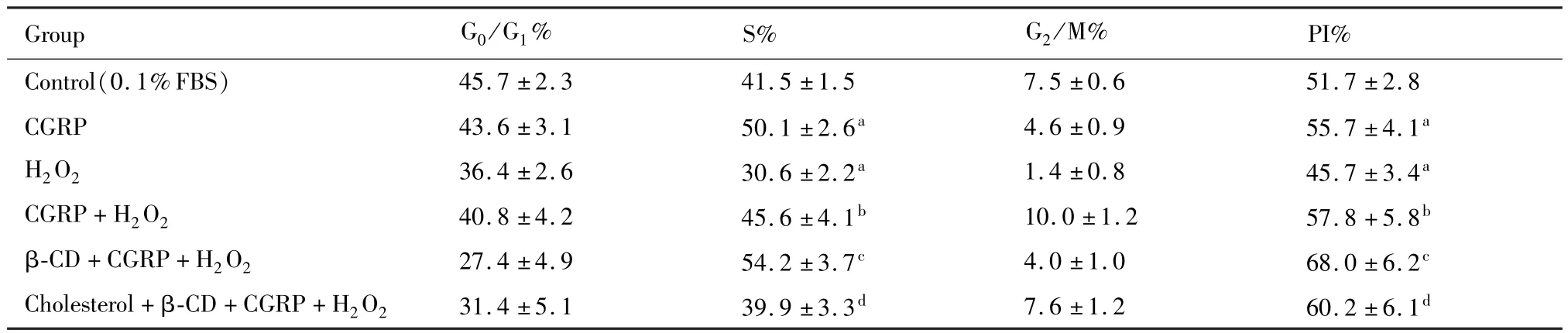
表1 Caveolae对HUVECs周期分布影响情况(n=3)_
PI=(S+G2M/(G0G1+S+G2M),PI值越大表示细胞增殖越明显;G0/G1:停留于G1/G0期(无增殖活动期)细胞;S:DNA合成期细胞;G2/M:DNA合成后期细胞;a:P<0.05 vs Control(0.1%FBS);b:P<0.05 vs H2O2;c:P<0.05 vs CGRP+H2O2;d:P<0.05 vsβ-CD+CGRP+H2O2
_Group G0/G1% S% G2/M%PI%________________Control(0.1%FBS)45.7±2.3 41.5±1.5 7.5±0.6 51.7±2.8 CGRP 43.6±3.1 50.1±2.6a 4.6±0.9 55.7±4.1a H2 O2 36.4±2.6 30.6±2.2a 1.4±0.8 45.7±3.4a CGRP+H2 O2 40.8±4.2 45.6±4.1b 10.0±1.2 57.8+5.8b β-CD+CGRP+H2 O2 27.4±4.9 54.2±3.7c 4.0±1.0 68.0±6.2c_Cholesterol+β-CD+CGRP+H2 O2_______________31.4±5.1_________________________39.9±3.3d 7.6±1.2 60.2±6.1d_______________
2.3 CGRP抑制H2O2处理的HUVECs caveolin-1的表达
单用CGRP能够降低HUVECs caveolin-1的表达,而用0.5 mmol/L H2O2处理细胞4 h后,caveolin-1的表达增加,说明H2O2通过增加caveolin-1的表达得到抑制细胞增殖的作用。100 nmol/LCGRP预孵育30 min后,再给H2O2能够降低caveolin-1的表达(P<0.05)(图4)。
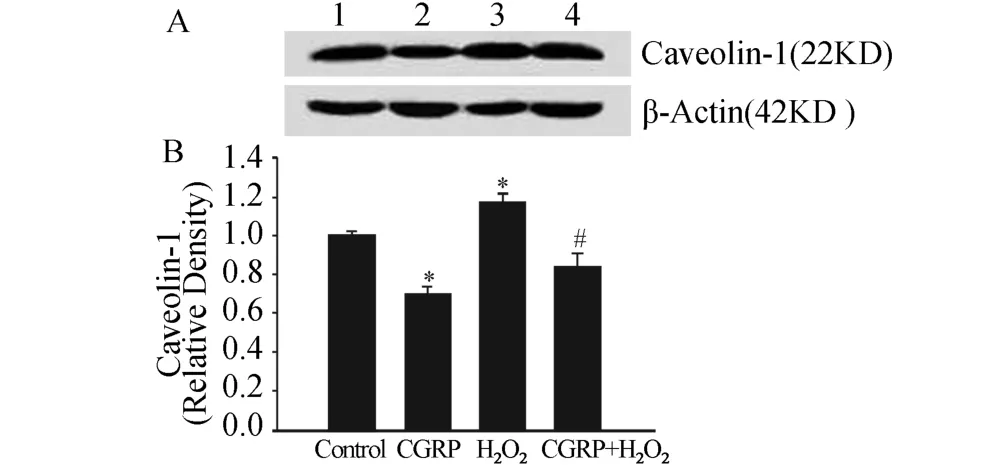
图4 CGRP对H 2 O2处理HUVECs caveolin-1表达的影响
2.4 Caveolae结构对CGRP抗氧化损伤作用的影响
如图5所示,用0.1%FBS同步化细胞24 h,换含5 mmol/Lβ-CD的细胞培养液孵育细胞0、0.17、0.5、1、4、8、16 h 提取细胞总蛋白。 Western-blot结果显示,β-CD孵育细胞0.5 h后能够下调HUVECs caveolin-1的表达,并且降低幅度最大。由此选定5 mmol/Lβ-CD孵育细胞0.5 h作为破坏caveolae结构的条件。
如图6所示,同步化细胞按照处理因素分组,0.5 mmol/L H2O2处理细胞4 h后提取细胞总蛋白。Western-blot结果显示:Caveolae结构破坏后,CGRP抑制H2O2引起HUVECs caveolin-1表达上调的作用更明显(P<0.05);预先加入胆固醇后,该抑制作用被削弱(P<0.05)。

图5 β-环糊精对人脐静脉内皮细胞caveolin-1表达的影响

图6 各处理因素下caveolin-1的表达情况 1:Control(0.1%
3 讨 论
本研究显示,caveolae结构完整性对CGRP保护内皮细胞有一定的影响,主要表现在,完整的caveolae结构可以通过促进caveolin-1的表达降低CGRP对内皮细胞的促增殖作用,破坏caveolae结构后,这种作用降低。有研究表明,CGRP还能刺激血管内皮细胞增殖,保护内皮祖细胞,修复和改善受损内皮的功能,沙坦类药物的降压和保护心血管作用与升高高血压患者体内的CGRP水平有关[4]。
Caveolae是富含胆固醇和蛋白质,其胆固醇含量占细胞内游离胆固醇的90%以上,胆固醇在维持caveolae结构完整性扮演重要角色[5]。β-环糊精能够结合胆固醇,导致caveolae在细胞膜上的形态发生变化,变得扁平,数目减少,从而影响其多数激酶活性抑制剂的生物学功能。本实验用5 mmol/Lβ-CD孵育细胞30 min后,发现在该时间点左右caveolin-1表达下降幅度最大,可能与小凹结构的破坏以及小凹数目急剧减少有关。流失细胞仪也发现,给予β-CD,细胞PI值增大,与CGRP+H2O2组相比,S期细胞数目增加;预先加入胆固醇,该作用被削弱,说明caveolae在CGRP促进氧化损伤HUVECs S增殖过程中可能起负性调节的作用。值得注意的是有文献[6]指出一定剂量的β-CD能够使内皮细胞的活力下降,流式细胞术结果显示,加用β-CD处理细胞,细胞凋亡率较其他处理因素组有所增加。因此,应用β-环糊精破坏小凹结构引起实验结果的偏差,可能与β-CD处理细胞的时间和剂量是否有关,这还需进一步阐明。本实验光镜下显示,β-CD处理细胞后,虽然细胞密度有所增加,但形态也发生变化。恢复胆固醇细胞形态也与正常细胞有所不同,推测破坏小凹结构对细胞的功能可能有影响。
Caveolin-1是组成caveolae结构和维持其完整性的所必需膜蛋白,并且前期工作证明caveolin-1参与负性调控细胞增殖的作用[7]。Caveolin-1已作为研究caveolae结构和功能以及caveolae/caveolin-1复杂的生物学功能的标志蛋白和工具。本实验用5 mmol/Lβ-CD处理细胞30 min,caveolin-1表达显著下降;能增强并放大CGRP对受损细胞的增殖作用;流式结果也表明CGRP预孵育细胞30 min使H2O2组S期细胞明显增多,这一增强效应在caveolae结构被破坏后得到放大,可被胆固醇削弱。由此可见,CGRP可能是通过推进HUVECs的G1→S期进程,促进细胞分裂增殖。Western-Blot结果显示同样的效应:破坏caveolae后,CGRP下调氧化损伤HUVECs caveolin-1作用更明显。说明内皮细胞膜表面caveolae结构或者数量表达的差异可能是调节CGRP受体信号转导的影响因素。实验对拟破坏小凹结构的内皮细胞加以胆固醇的供给,发现胆固醇逆转了β-CD上述的放大效应,外源性胆固醇结合了β-CD,通过阻止β-CD结合细胞膜胆固醇破坏小凹结构,间接促进细胞膜胆固醇与caveolin-1相连形成caveolae,恢复其与各种受体结合的能力,而发挥caveolin-1对增殖信号通路的负性调节作用。值得提出的是虽然剥夺胆固醇破坏小凹结构可以增强内皮细胞的数目,但就内皮细胞的功能影响来说是否受到影响还需进一步研究。
[1]邓水秀,秦旭平.降钙素基因相关肽的血管生物学功能多样性[J].国际病理科学与临床杂志,2006,26(3):246-249.
[2]Santibanez JF,Blanco FJ,Garrido-Martin EM,et al.Caveolin-1 interacts and cooperates with the transforming growth factor-βtype 1 receptor ALK-1 in endothelial caveolae[J].Cardiovasc Res,2008,77(3):791-799.
[3]周孝钱,许俊,唐江琼,等.CGRP对氧化损伤人脐静脉内皮细胞的保护作用及Caveolin-1表达的影响[J].中南医学科学杂志,2011,39(2):131-134.
[4]CalòLA1,Dal Maso L,Pagnin E,et al.Effect of olmesartan medoxomil on number and survival of circulating endothelial progenitor cells and calcitonin gene related peptide in hypertensive patients[J].J Hypertens,2014,32(1):193-199.
[5]Suetsugu S,Kurisu S,Takenawa T.Dynamic shaping of cellular membranes by phospholipids and membrane-deforming proteins[J].Physiol Rev,2014,94(4):1219-1248.
[6]Kline MA,O'Connor Butler ES,Hinzey A,et al.A simple method for effective and safe removal of membrane cholesterol from lipid rafts in vascular endothelial cells:implications in oxidant-mediated lipid signaling.Methods Mol Biol.2010;610:201-211.
[7]Chen Y,Dai Z,Liu YM,et al.Inhibitory effects of CGRPon vascular smooth muscle cell proliferation:Role of caveolae/caveolin-1/ERK1/2 signal pathway[J].Progress in Biochemistry and Biophysics,2013,40(5):445-453
Role of Caveolae in the Protection of CGRP on the HUVECs Injury Induced by Oxidative
ZHU Yi,ZHOU Xiaoqiang,XIAO Yunbin,et al
(Department of Orthopaedic Surgery,the Second Affiliating Hospital,University of South China,Hengyang,Hunan 421001,China)
Objective To study the role of caveolae on the protective effect of cacitonin gene-related peptide(CGRP)on human umbilical vein endothelial cells(HUVECs)injury induced by oxidative stress. Methods HUVECs were cultured in vitro,and treated with CGRPor/and hydrogen peroxide(H2O2),the distribution of cell cycles and proliferation of cells were observed by flow cytometry.The density and morphology of cells were observed by optical microscope,β-cyclodextrin(β-CD)was used to injured the structure of caveolae,expression of caveolin-1 was measured by Western blot. Rethods Compared with control group,treatment of CGRPincreased proliferation index(PI)and the number of S phase cells which were inhibited by H2O2;Destruction of caveolae structure could increase the density of cells and change the cells shape;The expression of caveolin-1 was down-regulated by CGRPbut up-regulated by H2O2,respectively.Pretreatment with CGRP,the up-regulation of caveolin-1 induced by H2O2was significantly reverted(P<0.05).Pretreatment ofβcyclodextrin with cells,the expression of caveolin-1 induced by CGRP was furtherly decressed. Conclusions the destruction of caveolae could increased the proliferative effect of CGRPon HUVECs induced by H2O2,the mechanism involvein change of the expression of caveolin-1.
H2O2; CGRP; caveolin-1; caveolae; endothelial cells
R331.36
A
10.15972/j.cnki.43-1509/r.2015.02.003
2014-11-02;
2014-12-25
国家自然科学基金(30572192),湖南省青年科学基金课题(13JJ4121).
*通讯作者,E-mail:qinxp333@hotmail.com.
(此文编辑:秦旭平)
