利用整体染色与透明技术观察棉花胚囊方法
2014-12-25李建欣代西梅张佳佳张永山
李建欣,代西梅,张佳佳,张永山
(1.郑州大学 离子束生物工程省重点实验室,湖南 郑州 450052;2.中国农业科学院棉花研究所,河南 郑州 455000)
棉花是我国一种重要的经济作物,由于杂交育种的需要,对它的胚胎学曾进行过许多的研究工作。有关胚囊方面,国内外都有过一些报道[1-4]。从60年代初开始,对棉花受精作用的形态学,曾进行一系列的研究,推进了对受精过程的微观现象的了解,其中以光学显微结构观察为主,也有部分超微结构的研究报道,采用石蜡切片的扫描电镜观察技术虽然可以观察到胚囊的形态解剖结构,但是这种方法操作繁琐,对实验操作要求较高[5]。
激光扫描共聚焦显微镜(LSCM)可以对活的或固定的细胞及组织进行无损伤的系列光学切片,得到其各层面的信息。这种功能也被形象地称为“显微CT”。此外,利用激光扫描共聚焦显微镜还可以对样品材料进行连续扫描,通过电脑处理从而获得其三维立体结构,对其样品内各细胞的空间分布有更清晰的认识[6-8]。利用激光扫描共聚焦显微镜观察水稻等植物的胚囊结构、形成及发育过程等方面的研究已有一些报道[9-12]。
但目前尚未见到利用激光共聚焦扫描显微镜观察棉花胚囊结构的报道。因为棉花的胚珠较大,荧光染色观察比较困难。本研究利用激光扫描共聚焦显微镜对棉花胚囊结构进行观察,把非同一焦平面的图像用连续扫描技术合成到一张图像中。该方法制片简单,方便操作,获得了清晰的图片及大量资料,为棉花胚囊结构的研究提供资料。
1 材料和方法
1.1 材料
供试材料是普通棉花品种,在开花前和授粉后分别取棉花的胚珠于FAA溶液中固定48h。
1.2 方法
(1)取胚囊:将已在FAA溶液中固定的棉花胚珠放入70%酒精与浓盐酸的比例为3∶1的溶液中清洗3~5min,然后放在解剖镜下将内外珠被剥掉,取出胚囊(这一步非常关键,需要一个熟练的过程,否则很容易在剥离内外珠被时弄破胚囊)在42℃水浴锅中处理2.5h。
(2)复水:棉花胚囊经50%、30%、15%梯度酒精再到蒸馏水中,每级20min。
(3)水解:棉花胚囊在1mol/L NaOH 下水解8 h,蒸馏水彻底洗净。
(4)衬染:加入1%的曙红Y染色8h,吸去染色液,用蒸馏水清洗,换液数次至水中无浮色。
(5)缓冲液:加入pH=5的柠檬酸-磷酸缓冲液处理8h。
(6)荧光染色:用5mg/L的荧光染料DAPI水溶液,在25℃暗室中染色24h。
(7)脱水:棉花胚囊从15%酒精中依次转入30%、50%、70%、80%、95%、100%浓度梯度的酒精中各脱水20min,在100%酒精中再脱水3次,每次2h,最后1次12h。
(8)透明处理:棉花胚囊从100%酒精转入水杨酸甲酯和无水酒精的等量混合液中约1h后,转入水杨酸甲酯中,2次,每次3h,最后1次15h以上,经过透明处理的材料仍可保存于水杨酸甲酯中。
(9)制片观察:将透明棉花胚囊置于滴有丁香油的凹形载玻片上,盖上盖玻片,在Leica SP2激光扫描共聚焦显微镜上用488nm激光激发观察并摄像。
2 结果分析
2.1 成熟的胚囊、极核和卵细胞
激光扫描共聚焦显微镜观察到的棉花胚囊内的细胞形态见图1。棉花成熟胚囊内珠孔端由2个助细胞、1个卵细胞和1个中央细胞共同构成雌性生殖单位(见图中1)。在受精前,其中的1个助细胞退化,在成熟胚囊珠孔端,能见到1个助细胞、1个卵细胞和1个中央细胞(见图中2)。中央细胞为1个高度液泡化的细胞,2个极核紧靠在一起,各有1个较大的核仁(见图中3)。
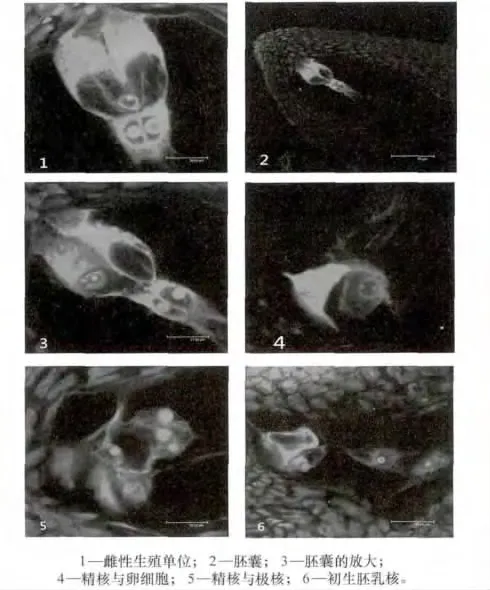
图1 激光共聚焦观察棉花胚囊内的细胞形态
2.2 精核与卵核的融合
开花后花粉粒在柱头上萌发,形成花粉管。花粉管形成后,进入胚囊,花粉管在退化助细胞的位置释放出2个精子以及其他一些内含物。2个精核分别进入极核与卵细胞(见图1中4)。进入卵细胞的精核慢慢移动到卵核的位置,然后精核的内容物慢慢进入卵细胞核,随后在卵核内出现1个雄性核仁,然后雌性核仁与雄性核仁融合。至此,卵细胞与精子的融合完成而形成1个合子。
2.3 精核与极核的融合
精核与极核的融合过程类似于精核与卵核的融后过程。在观察过程中发现,大部分精核是与1个极核融合后再与另1个极核发生融合的,偶尔可见到精核与次生核的融合。在开花后,可观察到精核首先与1个极核的核膜接触,进行核膜的融合(见图1中5));随后精核的染色质向极核内分散;再后在极核内出现1个小的雄性核仁,雄性核仁会慢慢变大;最后增大至与极核的核仁差不多大小。1个精核与极核完成融合,形成初生胚乳核。精子与极核融合后很快进行分裂,行成初生胚乳核(见图1中6)。
3 讨论
棉花胚囊的观察有很重要的实际价值,例如棉花中一些不育的胚珠称为“籽屑”。籽屑对于纺织工业是个不利的因素。如果棉花中籽屑比例过高,便严重地影响纺纱质量。籽屑大致可以分为三类:(1)胚珠中不形成胚囊;(2)胚珠中有正常的胚囊,但没有受精;(3)胚珠中受精了,但是胚胎发育受到了抑制。因此,从胚囊的观察图片上可区别出受精的和不受精的籽屑。棉花的胚胎发育还有很多畸形的现象,其影响了棉纤维的正常发育。有时,由于某种原因,导致一部分正在发育的胚胎败育,致使棉纤维发育不良,降低纤维的质量,即所谓不成熟籽(或瘪籽)的劣纤维。研究籽屑的成因和引起胚胎败育的原因,采取人为措施,减少籽屑的产生及克服胚胎败育,对于提高棉纤维的质量具有重要的意义[13]。
棉花胚囊经荧光染色及透明处理后,通过LSCM可清晰地观察到胚囊内各细胞结构。细胞核及核仁经激光激发后可以显示较强的荧光,通过LSCM的激光扫描系统可以清晰地观察到胚囊内各细胞的结构及空间分布情况。由于棉花胚囊在成熟期较大,在观察时发现胚囊内各细胞不一定在同一个光学切面上,此时可利用LSCM系列扫描功能进行逐层扫描。LSCM的这种功能可以使我们更准确地观察组织内不同层面的结构,并免去石蜡切片、超薄切片等繁琐的制片工作。系列扫描图像经计算机三维重建后,可得到样品的三维重建结构,三维重建后的图像可沿X、Y、Z轴进行任意角度的旋转,可从不同的角度观察样品内的结构及空间关系[14]。利用LSCM的这种连续扫描及重建功能同样也可以清晰地观察到棉花成熟胚囊内及双受精过程中各细胞结构及其空间分布关系。
研究棉花成熟胚囊的结构,对胚囊结构各部分的超微结构,如细胞核的核膜、核仁中的核仁丝、液泡膜、液泡中的内含物以及胚囊壁内突等的观察,几乎全部用石蜡切片扫描电镜的技术,但是材料的立体感不强,制片方法复杂,限制了研究者快速制片观察以及更大范围的应用。
利用LSCM观察胚囊的关键问题是胚囊的剥离以及之后的水解和荧光染色的时间。由于棉花胚珠相对较大,所以在进行染色之前要在解剖镜下把胚珠的内外珠被剥掉,只剩胚囊,对一个胚囊进行整体染色就比较容易,而在之后的水解阶段由于棉花的细胞壁会阻碍荧光染料的进入,所以用NaOH处理的时间要合适,时间既不能太久否则会使细胞变形,时间也不能太短否则荧光染料不容易进入胚囊。荧光染料DAPI作用时间也需要合适,否则会看不清或者胚囊全部染色而导致无法清晰地观察到细胞[15]。虽然此法不能像在透射电镜下分辨细胞中的一些小细胞器,而且胚囊的超微结构观察与前人的结果相似,但它的整体感强,制片方法简便。而这种快捷的方法有着更深远的价值。不仅可以应用在观察棉花不育过程中染色体等的变化和棉纤维的发育,还可以用来观察棉花胚囊内细胞骨架和Ca2+ 的变化和分布[16]。所以接下来的研究工作是利用此种技术在棉花细胞学的层面上对棉花进行更深入的研究。
(
)
[1]焦改丽,孟钊红,杨晓黎,等.光学显微及扫描电镜冷台观察陆地棉胚胎发育[J].山西农业科学,2013,41(11):1180-1182,1196
[2]张宝红,刘方,姚长兵,等.棉花组织培养体细胞胚胎发生的扫描电镜观察[J].作物学报,2000,26(1):125-130.
[4]李正里,胡绍安.棉花胚胎学基础知识(一)[J].中国棉花,1978,2(3):40-44.
[5]李正里,胡绍安.棉花胚胎学基础知识(二)[J].中国棉花,1978,2(4):32-34.
[6]田克斌,韩丽林,江银华,等.激光共聚焦显微重建鲜红斑痣三维结构的初步研究[J].温州医学院学报,2011,41(5):491-493.
[7]Smithies D J,van Gemert M J,Hansen M K,et al.Three-dimensional reconstruction of port wine stain vascular anatomy from serial histological sections[J].Phys Med Biol,1997,42(9):1843-1847.
[8]Zhang W H,Zhu S N,Lu S L,et al.Three-dimensional image of hepatocellular carcinoma under confocal laser scanning microscope[J].World J Gastroenterol,2000,6(3):344-347.
[9]代西梅,黄群策,秦广雍.水稻双受精过程的共聚焦显微镜观察[J].广西植物,2008,28(1):15-19.
[10]张佳佳,代西梅,赵帅鹏,等.激光扫描共聚焦显微技术对水稻不育系花粉减数分裂的特性研究[J].光谱学与光谱分析,2013,33(9):2483-2487.
[11]Terada S.Embryological studies in Oryza sativa L[J].J Coll Agrie Hokkaido Imp Univ,1928,19:245-260.
[12]Cho J.Double fertilization in Oryza sativa L and devolopment of the endosperm with special reference to the aleuron layer[J].Bull Nat Inst Sei Ser D,1956(6):61-101.
[13]万涛,卢洁,平美广.植物胚胎败育原因的解剖学研究进展[J].景德镇高专学报,2007,22(4):11-12,17.
[14]杨子贤,王洪星,易小平.激光扫描共聚焦显微镜在生物科学研究中的应用[J].热带生物学报,2013,4(1):99-104.
[15]代西梅,黄群策,李国平,等.激光扫描共聚焦显微镜观察水稻双受精过程[J].河南农业科学,2007(6):25-30.
[16]肖光辉,梅文倩,朱玉贤.棉纤维细胞发育过程中钙离子内流和钙依赖蛋白激酶活性的动态变化[J].中国科学,2013,43(10):886-896.
