聚丙烯膜固定化转谷氨酰胺酶的条件优化
2014-12-25任德财韩春然马永强
钱 镭 , 任德财 , 韩春然 , 张 娜 , 刘 颖 , 马永强 *
(1.黑龙江东方学院 食品与环境工程学部,黑龙江哈尔滨150086;2.哈尔滨商业大学 食品工程学院,黑龙江哈尔滨 150076)
转谷氨酰胺酶(TGase;EC2.3.2.13;全称为蛋白质-谷氨酰胺γ-谷氨酰胺基转移酶)是一种能催化多肽或蛋白质的谷氨酰胺残基的γ-羟胺基团(酰基的供体)与许多伯胺化合物(酰基受体)之间的酰基转移反应的酶[1-2]。蛋白质经TG改性后其凝胶特性、粘性、持水性、水溶性和热稳定性等功能特性都会得到一定程度的改善[3-4],另外还可保护食品中的赖氨酸免受各种加工过程的破坏。同时由于反应过程中有谷氨酸的生成,在一定程度上还可改善食品的风味。但是游离酶因稳定性差、难以回收、易混入产品和不易循环利用等缺点,使其应用受到限制。通过物理或化学的方法将酶固载于载体后可以克服游离酶的弱点。固定化酶不仅保留了游离酶原有的活性及高度选择性,而且克服了游离酶催化反应不便于连续化和自动化的缺点,因而具有更加广阔的应用前景。
聚丙烯膜由于具有良好的物理和化学稳定性,易于控制的微孔结构以及制备方便等特点,得到了广泛的应用。然而,其化学惰性的表面也为酶固定化带来了困难。通过接枝聚合,进而共价结合酶分子,是聚丙烯膜固定化酶的一种有效手段。
通过紫外光引发甲基丙烯酸甲酯的接枝聚合,在聚丙烯微孔膜表面引入反应性官能团,实现转谷氨酰胺酶在化学惰性聚丙烯膜上的共价固定化,优化了接枝反应和固定化条件,得到一种比较理想的酶晶体膜固定化方法。
1 材料与方法
1.1 材料与试剂
转谷氨酰胺酶晶体:实验室自制;聚丙烯微孔膜:北京升河诚信膜科技发展中心产品;甲基丙烯酸甲酯(化学纯):上海化学试剂采购供应五联化工厂产品;1,6-己二胺(化学纯):上海化学试剂采购供应五联化工厂产品;三羟甲基氨基甲烷(tris):北京北实纵横科技发展有限公司产品;还原型谷胱甘肽:sigma 公司产品;N-α-CBZ-Gln-Gly:sigma 公司产 品 ;L-Glutamic acid γ -monohydroxamic acid:sigma公司产品;盐酸羟胺(分析纯):天津市光复精细化工研究所产品。
1.2 仪器与设备
紫外光引发装置(500W):实验室自制;空气振荡器(HEQ-C):哈尔滨市东联电子技术开发有限公司产品;真空干燥箱(ZK-82B):上海实验仪器总厂产品;紫外可见分光光度计(Spectrum722E型):上海光谱仪器有限公司产品。
1.3 实验方法
1.3.1 甲基丙烯酸甲酯在膜表面的紫外接枝方法
1)聚丙烯微孔膜的预处理 将聚丙烯膜(孔径10 μm)置于丙酮中浸泡24 h,于真空干燥箱中30℃干燥24 h,储存于干燥器中备用。
2)预照射 先配制0.2 mol/L光敏剂二苯甲酮的丙酮溶液,将已称重(W0)的处理过的膜浸入溶液中,在氮气保护下用紫外光照射一段时间,取出膜于空气中自然晾干,备用。
3)第二步光照 再将上述膜浸入到含有甲基丙烯酸甲酯的乙醇溶液中,在氮气保护下用紫外光照射一段时间后,将膜取出,用大量乙醇冲洗。再将膜浸入丙酮中,于30℃水浴振荡器中振荡24 h,期间每4h更换一次丙酮溶剂,将膜表面残留的单体及均聚物彻底洗脱。清洗过的膜于真空干燥箱中30℃干燥24 h,称重(W)。甲基丙烯酸甲酯在膜表面的接枝率(GD)按下式计算:
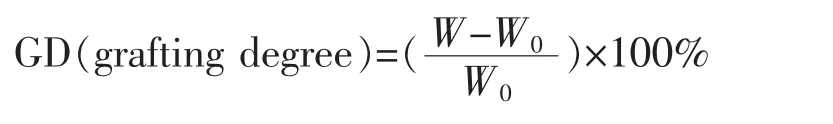
1.3.2 紫外接枝反应条件优化 采用预照射时间为12 min,研究照射距离、单体浓度和二次照射时间对接枝率的影响。
1)单因素试验 第一组控制照射距离为4,6,8,10,12,16 cm 进行单因素试验, 研究照射距离对接枝率的影响;第二组将甲基丙烯酸甲酯的质量分数分别配制成 5%,10%,15%,20%,25%,30%,研究单体质量分数对接枝率的影响;第三组设定二次照射时间为 5,10,15,20,25,30 min,研究二次照射时间对接枝率的影响。
2)响应面试验设计 根据单因素的结果,采用响应面Box-Benhken中心组合设计,以接枝率为响应值,以照射距离(A)、单体浓度(B)、二次照射时间(C)为自变量,设计了3因素3水平的响应面分析实验。因素水品编码见表1。
1.3.3 转谷氨酰胺酶的固定化方法
1)己二胺间隔臂的引入 将己二胺溶解于去离子水中配成一定浓度的溶液,甲基丙烯酸甲酯接枝膜浸入己二胺溶液中,于空气振荡器上在一定温度下振荡一定时间。取出膜,用大量去离子水冲洗以除去吸附于膜上的己二胺。考察了己二胺浓度,己二胺活化温度,己二胺活化时间对固定化酶晶体活力的影响。
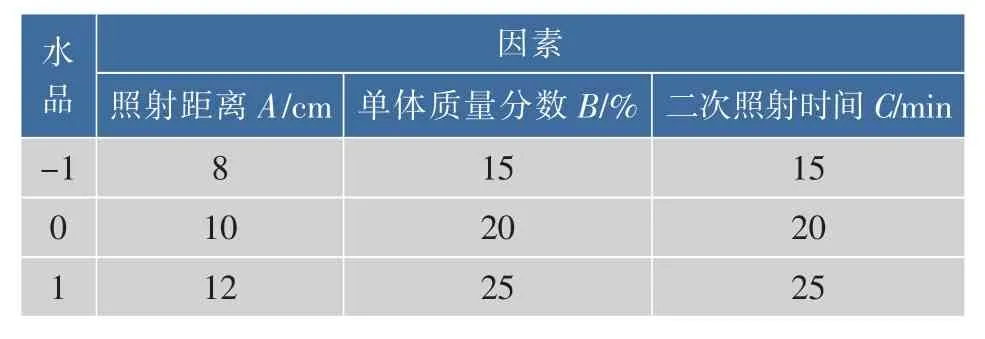
表1 响应面试验因素水平表Table 1 Factors and levels in response surface design
2)戊二醛交联 将己二胺处理过的膜浸入戊二醛水溶液中,于空气振荡器上在30℃下振荡一定时间。取出膜,用大量去离子水冲洗活化后的膜即可。考察了戊二醛浓度、交联时间对固定化酶晶体活力的影响。
3)酶的固定化 试验所用的酶为转谷氨酰胺酶的交联酶晶体,酶活力为102.8 U/mg。将表面活化的平板膜剪成3 cm×3 cm的小片,取一定数量的接枝膜浸入10 mL预处理过的酶晶体溶液中,于4℃下反应若干小时。将膜取出,用大量醋酸盐缓冲液(0.03 mol/L,pH 6.0)冲洗,以除去表面黏附的酶液。将固定化酶晶体膜浸入醋酸盐缓冲液 (0.03 mol/L,pH 6.0)中,于4℃下储存备用。
在此过程中,主要考察指标:酶晶体溶液浓度分别在 5,10,15,20,25 mg/mL 时对固定化酶晶体活力的影响情况。不同的固定化酶晶体反应时间(6,12,18,24,30,36 min)时对固定化酶晶体活力的影响情况。
1.3.4 转谷氨酰胺酶活性的测定 转谷氨酰胺酶活性采用Folk和Cole报导的分光Hydroxamate分析法测定[8-9]。试剂A:含0.2 mol/L tris-HCl缓冲液(pH=6.0),0.1 mol羟胺,0.01 mol还原型谷胱甘肽及0.03 mol/L N-α-CBZ-Gln-Gly的混合液;试剂B:3 mol/L HCl, 三氯乙酸及质量分数 5%FeCl3·6H2O(溶解于0.1 mol/L HCl中)等体积混合。试剂A在37℃与酶液反应10 min后,添加B终止酶反应并形成红色铁化合物,8 000 r/min离心5 min除去沉淀,上清液于525 nm测定吸光度,用L-谷氨酸γ-单羟肟酸 (L-Glutamic acid γ-monohydroxamic acid)做标准曲线。1单位TGase酶活力单位定义为:37 ℃每分钟催化 1 μmol N-α-CBZ-Gln-Gly生成单羟肟酸所需酶量。
2 结果与分析
2.1 紫外接枝反应条件对接枝率的影响
2.1.1 单因素试验结果 单因素试验结果显示,随着光照距离的增加,接枝率也随之增加,当光照距离增加到10 cm时,接枝率基本上达到了最大,而继续增加光照距离之后,接枝率有所下降,故试验中光照距离定为10 cm。甲基丙烯酸甲酯的浓度对于膜的接枝率具有较大的影响,当甲基丙烯酸甲酯质量分数为20%时,单体接枝率最大,而随着单体浓度的持续增加,接枝率没有太大明显的变化,所以,在试验中将甲基丙烯酸甲酯质量分数定为20%。第二步接枝反应时间会明显地影响接枝率,随着时间的增加,单体接枝率逐渐升高,在5~15 min内,接枝率的增幅较大。直至20 min左右达到接枝率最大值。同时,光照时间不可太长,时间过长会使单体溶液烤干,不利于单体的接枝,因此,二次光照的时间选择20 min为宜。
2.1.2 响应面实验安排及实验结果 响应面分析实验设计与结果见表2。

表2 试验设计与试验结果Table2 Response surface design arrangement and experimental results
利用Design Expert对表2的数据进行二次多项式拟合,获得接枝率对照射距离、单体浓度以及二次照射时间的二次回归方程:
GD=34.50-0.030A-0.99B+0.53C-0.47AB+0.24AC-0.60BC-1.52BD-1.32A2-2.58B2-1.19C2
2.1.3 多元回归模型分析 对拟合的二次多次多项式中3个自变量进行方差分析,结果见表3。由表3方差分析可知,模型P值(0.000 2)远远小于0.05,此时回归方差模型是高度显著的,因此这种实验方法是可靠的。决定系数R2=0.967 0,说明回归方程的拟合程度较好。
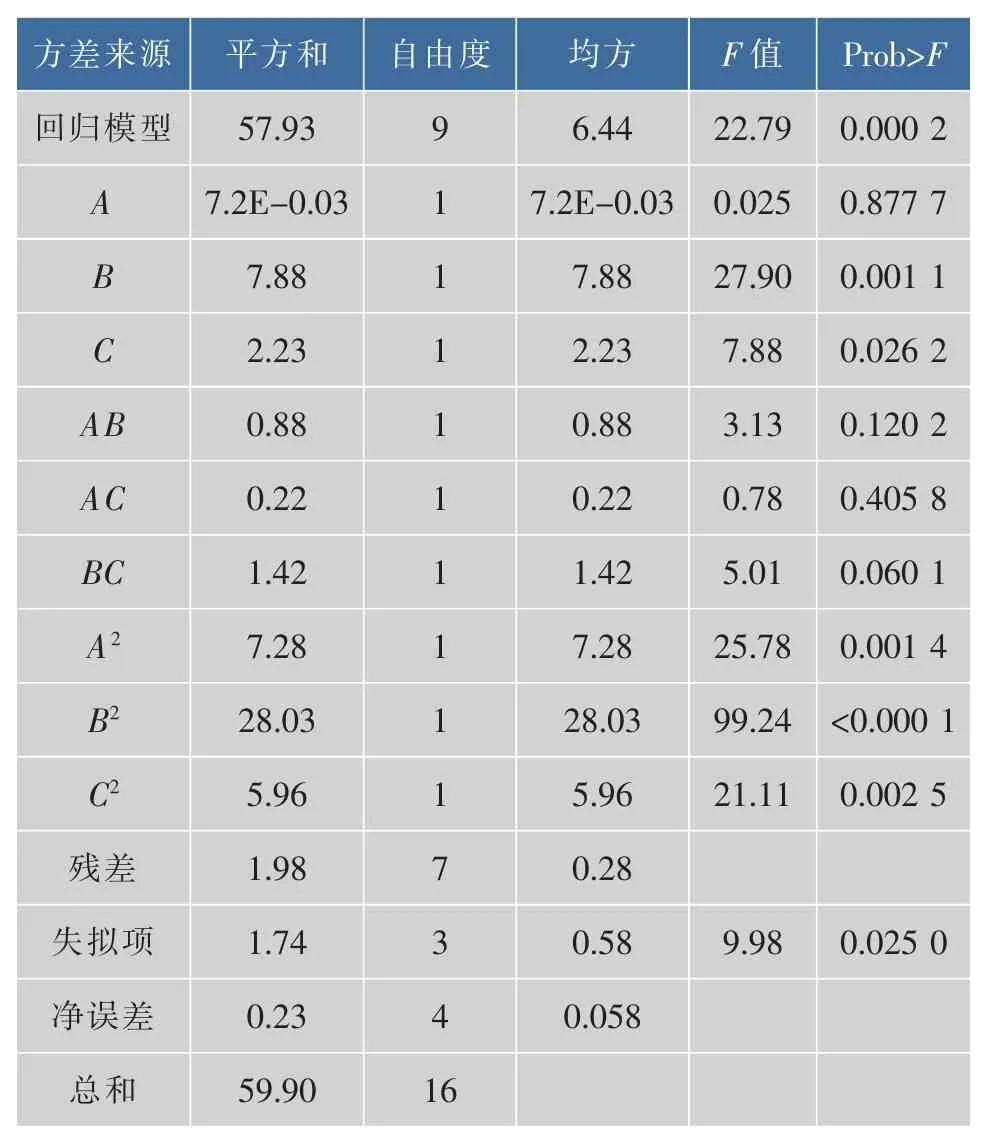
表3 实验结果方差分析表Table 3 Variance analysis of fiited regression model
三因素之间的交互作用见图1~3所示。当二次照射时间为20 min时,单体质量分数和照射距离对接枝率的影响见图1,当单体质量分数不变时,接枝率随着照射距离的增加而先增大后减小。当照射距离不变时,随着甲基丙烯酸甲酯质量分数的增加,接枝率也逐渐增大,当单体质量分数达到20%时,接枝率开始下降。
当单体质量分数为20%时,照射距离和二次照射时间对接枝率的交互影响见图2。当照射距离不变时,接枝率随着照射时间的延长而先增加后减少,照射时间达到20 min时,接枝率为最大。当照射时间不变时,随着照射距离的增加,接枝率也增大,当照射距离为10 cm时,接枝率开始下降。
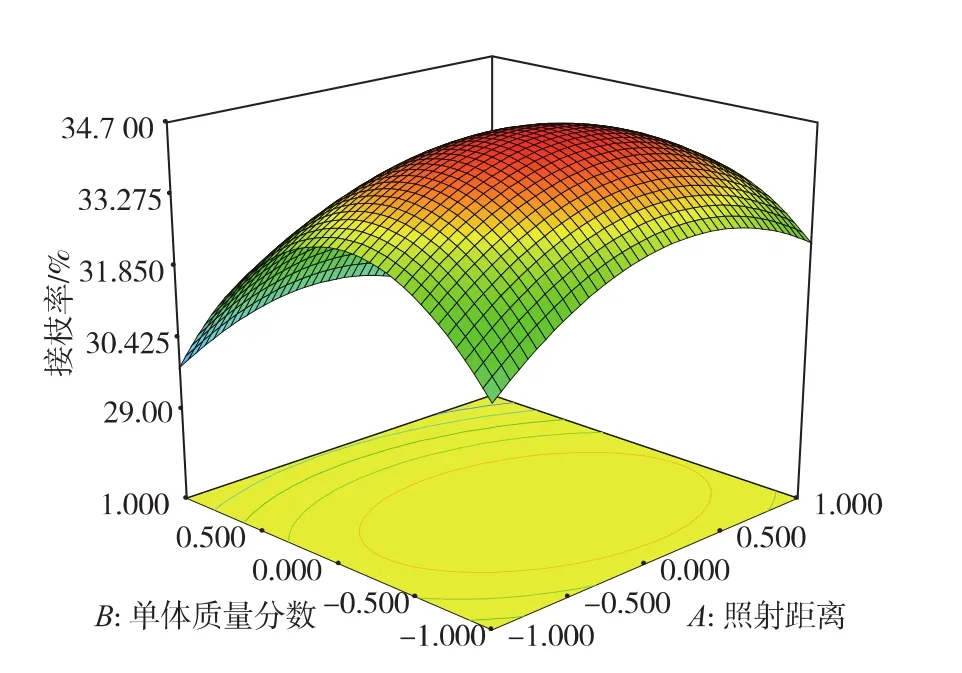
图1 单体质量分数和照射距离对接枝率的影响Fig.1 Effect of cross-interaction between distance of ultraviolet and consistency of methyl -methacrylate
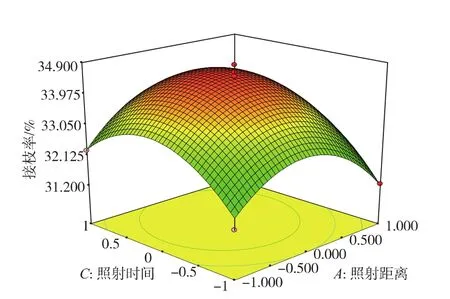
图2 照射距离和二次照射时间对接枝率的影响Fig.2 Effect of cross-interaction between distance of ultraviolet and time of ultraviolet
当照射距离为10 cm时,单体质量分数和二次照射时间对接枝率的交互影响见图3。由图3可见,当单体质量分数不变时,接枝率随着照射时间的增加而增大,照射时间为25 min时,接枝率达到最大。当照射时间不变时,随着单体质量分数的增加,接枝率也逐渐增大,当单体质量分数达到20%时,接枝率达到最大,随着浓度继续增大,接枝率逐渐下降。
2.1.4 验证实验 软件提供的最佳接枝反应条件如下:照射距离为10.1 cm、单体质量分数为18.85%、二次照射时间为21.4 min。进行验证实验,3次实验的平均接枝率为34.62%,这与理论预测值34.688 5比较接近,说明采用响应面优化得到的紫外接枝反应条件参数准确可靠,按照建立的模型进行预测在实践中是可行的。
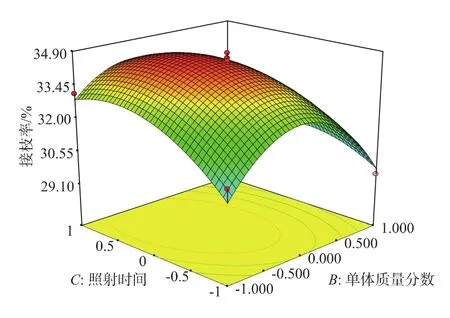
图3 单体质量分数和二次照射时间对接枝率的影响Fig.3 Effect of cross-interaction between consistency of methyl-methacrylate and time of ultraviolet
2.2 固定化条件对酶活性的影响
2.2.1 己二胺质量分数对固定化酶活性的影响如图4所示,随着己二胺质量分数的增加,酶的活性也在增加,但当己二胺的质量分数超过20%之后时,酶活性趋势没有了太大的变化,说明这一质量分数已足够使胺烷基化反应进行完全。因此,己二胺质量分数一般控制在20%。

图4 己二胺质量分数对酶活性的影响Fig.4 Effect of consistency of hexamethylendiamine on the relative activity of transglutaminase
2.2.2 胺烷基化温度对固定化酶活性的影响 如图5所示,随着胺烷基化温度的升高,酶的活性也有所增加,当温度大于50℃时,酶活性受到了影响并有明显的下降。因此,50℃为胺烷基化的最佳温度。
2.2.3 胺烷基化时间对固定化酶活性的影响 如图6所示,随着胺烷基化反应时间的延长,酶活性在持续增加,当反应到90 min时,酶活性最高,并且随着反应时间继续增加,酶活性受到了影响,但下降的趋势不明显。因此,在试验中,胺烷基化反应时间控制在90 min。

图5 胺烷基化温度对酶活性的影响Fig.5 Effect of amine alkylation temperature on the relative activity of transglutaminase

图6 胺烷基化反应时间对酶活性的影响Fig.6 Effect of amine alkylation time on the relative activity of transglutaminase
2.2.4 戊二醛体积分数对固定化酶活性的影响选择了体积分数1%~3%的戊二醛溶液进行研究,如图7可知,戊二醛的体积分数对酶活力影响程度不大,而且当戊二醛的体积分数达到3%时,酶活有所减少,而当酶活在2%时,相对酶活较高,综合各方面因素考虑,将戊二醛体积分数确定在2%。
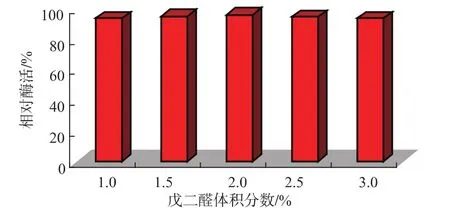
图7 戊二醛体积分数对酶活性的影响Fig.7 Effect of consistency of glutaraldehyde on the relative activity of transglutaminase
2.2.5 戊二醛作用时间对固定化酶活性的影响如图8所示,戊二醛活化时间对固定化酶活性影响不大,在40 min时,酶活相对较高,而在40 min之后酶活性也受到一些影响而下降,可能是由于戊二醛与酶分子上的氨基化学键合后,使得酶的构象发生变化从而降低了活性[10]。故将戊二醛活化时间确定在40 min。

图8 戊二醛作用时间对酶活性的影响Fig.8 Effect of reaction time of glutaraldehyde on the relative activity of transglutaminase
2.2.6 酶质量浓度对酶活性的影响 酶溶液浓度对酶活性的影响如图9所示。随着酶溶液浓度的增加,酶活力也增强,当酶溶液质量浓度为15 mg/mL时,酶活力达到最大,当酶溶液浓度继续增加,酶活力没有太大的变化,这说明,在15 mg/mL的酶溶液中,酶分子把戊二醛所暴露出的可偶联的位点全部占有,使酶活性达到最大;而当酶质量浓度超过15 mg/mL的酶晶体溶液中的酶分子没有完全占有戊二醛的偶联位点,剩余的酶无法与戊二醛进一步结合,故酶活力没有明显的变化。因此,在实验中将酶晶体溶液的质量浓度确定在15 mg/mL。
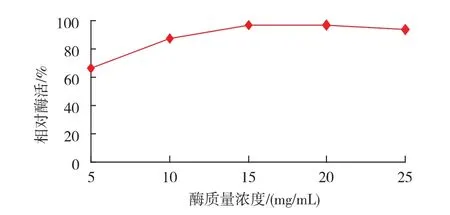
图9 酶质量浓度对酶活性的影响Fig.9 Effect of consistency of enzyme on the relative activity of transglutaminase
2.2.7 酶固定化反应时间对酶活性的影响 由于酶晶体在4℃的低温下保存,酶活力几乎没有影响,所以为防止酶晶体在固定化过程中失活,酶晶体固定化反应均在4℃的低温下进行,因此固定化的速度较慢,需要较长时间反应。固定化时间对酶活性的影响如图10所示,随着反应时间的延长,聚丙烯微孔膜上固定酶晶体数量增多,酶活性变大。当固定24 h之后,反应接近完全,酶活性没有太大的变化。因此,在试验中酶固定化反应时间控制在24 h。

图10 固定化时间对酶活性的影响Fig.10 Effect of immobilized time on the relative activity of transglutaminase
3 结 语
采用紫外光照射接枝的方法在聚丙烯膜表面接枝甲基丙烯酸甲酯单体,通过响应面分析得到最佳接枝条件为:照射距离为10.1 cm、单体质量分数为18.85%、二次照射时间为21.4 min。转谷氨酰胺酶固定化的条件为:己二胺质量分数为20%,胺烷基化时间90 min,胺烷基化温度50℃;戊二醛体积分数2%,戊二醛作用时间40 min;酶质量浓度15 mg/mL,4℃条件下固定化时间24 h,可以得到较高的酶活。
[1]Motoki M,Seguro K.Tranglutaminase and its use for food processing[J].Trend Food Sci Technol,1998(9):204-210.
[2]宫俊,崔莉,范雪荣,等.基于转谷氨酰胺酶催化交联的羊毛角蛋白成膜性能的研究[J].食品与生物技术学报,2012,31(6):615-620.GONG Jun,CUI Li,FAN Xuerong.Study on filming performance of wool keratin with the catalvsis of transglutaminase[J].Journal of Food Science and Biotechnology,2012,31(6):615-620.(in Chinese)
[3]Chiya Kuraishi,Katsutoshi Yamazak,i and Yasuyuki Susa.Transglutaminase:its utilization in the food Industry[J].Food Reviews International,2001,17(2):221-246.
[4]丁克毅.转谷氨酰胺酶改性明胶强度薄膜的制备[J].食品与生物技术学报,2007,26(1):25-28.DING Keyi.Enhanced films prepared from microbial transglutaminase modified gelatin[J].Journal of Food Science and Biotechnology,2007,26(1):25-28.
