黄嘌呤氧化酶酶学性质及共价交联固定化
2014-12-25张玉然杨海麟
张玉然, 辛 瑜, 杨海麟, 张 玲, 王 武
(江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
黄嘌呤氧化酶(xanthine oxidase,XOD),属黄素蛋白酶类,可将次黄嘌呤氧化为黄嘌呤,继续氧化黄嘌呤为尿酸,并产生过氧化氢及超氧化物[1],是嘌呤代谢的关建酶。可用于检测血清无机磷、血清超氧化物岐化酶活力及胞外黄嘌呤、次黄嘌呤水平[2-4]。在核苷类药物的合成中起到促进转化的作用,可用于提高5-甲基尿苷、胸腺嘧啶核苷的合成产量[5-6]。
不同生物来源的黄嘌呤氧化酶酶学性质具有差异性。来源于细菌的黄嘌呤氧化酶国内外研究较少,已报道黄嘌呤氧化酶的相对分子质量及亚基组成差异较大[7-9],蛋白结构组成的差异将导致酶催化性能及稳定性的不同。
黄嘌呤氧化酶作为一种重要的氧化酶,其在医学诊断及工业催化中有应用前景,酶较差的稳定性影响其直接应用。已报道的提高酶稳定性的方法主要有添加保护剂、蛋白质工程、固定化方法等。其中,固定化方法因具有可连续反应性、可重复利用性等优点,备受关注。可使用的固定化载体主要有聚丙烯酰胺[10]、壳聚糖[11-12]、醋酸纤维素薄膜[13]、树脂[14]等。国内外关于黄嘌呤氧化酶稳定性研究,主要集中于改进溶液环境提高酶热稳定性[15-16],对其固定化研究相对较少。
前期经SDS-PAGE电泳分析知,节杆菌Arthrobacter M3黄嘌呤氧化酶含两个亚基,相对分子质量约为100 000及35 000[17],与已报道的黄嘌呤氧化酶均不相同。在此基础上,作者对此黄嘌呤氧化酶的酶学性质进一步分析,并利用修饰的琼脂糖介质及大孔阴离子交换树脂固定化黄嘌呤氧化酶。提供有效增强黄嘌呤氧化酶稳定性的固定化方法,也为其它酶类的稳定性研究提供参考。
1 材料与方法
1.1 菌种来源
Arthrobacter M3:作者所在实验室保藏菌种。
1.2 主要材料
黄嘌呤氧化酶标准品(相对分子质量160 000):近岸蛋白质科技有限公司提供;大孔阴离子交换树脂 (D201、201×4), 浙江争光实业股份有限公司提供;Sepharose 4B:通用电气医疗中国有限公司提供;乙基二甲基胺丙基碳化二亚胺(EDC):梯希爱(上海)化成工业发展有限公司提供。
1.3 主要仪器
V1100D可见分光光度计:美谱达仪器有限公司产品;电热恒温水浴锅:科辉仪器厂产品;蛋白电泳仪:美国BIO-RAD公司产品;pH计(PB-10型):德国赛多利斯股份有限公司产品。
1.4 培养及纯化方法
从固体平板挑取单菌落,接入种子培养液,30℃恒温振荡培养12 h。后将种子培养液按体积分数3%接种量接入60 mL (500 mL锥形瓶)发酵培养基,30℃、220 r/min培养20 h。菌液破壁离心后,取上清酶液进行纯化,参考文献[17]。纯化后酶液经0.22 μm滤膜过滤,置于4℃保存备用。
1.5 XOD酶活测定方法
黄嘌呤氧化酶酶活测定方法详见参考文献[18]。酶活力单位定义:在37℃下,每分钟形成1 μmol过氧化氢所需的酶量定义为1个酶活单位(U)。
1.6 XOD酶学性质分析
1.6.1 凝胶过滤确定XOD相对分子质量 以商业化的黄嘌呤氧化酶(相对分子质量160 000)标准品为对照,利用安捷伦 SEC-5(7.5 mm×300 mm,5 μm)凝胶过滤柱测定XOD相对分子质量。测定条件:流动相 0.1 mol/L Tris-HCl缓冲液(pH 7.0),流量 0.5 mL/min,进样量 40 μL,检测波长 280 nm。
1.6.2 酶的最适反应温度及最适反应pH 取一定浓度的稀释酶液,于25~52℃水浴条件下进行酶活力测定,以活力最高者为100%,计算不同温度下相对酶活。另取一定浓度的稀释酶液,于37℃、不同pH条件下(5.5~9.0)进行酶活力测定,以活力最高者为100%,计算不同pH条件下相对酶活。
1.6.3 金属离子对酶活的影响 在pH 7.5酶液中加入不同金属离子 (Ca2+、Mg2+、Fe3+、Co2+、Mn2+、Zn2+、Cu2+、Ag+、Hg2+),至终浓度为 2 mmol/L,混匀,测定各组酶活,以未加金属离子的酶液酶活为100%,计算各组相对酶活。
1.7 XOD固定化方法比较
1.7.1 大孔阴离子交换树脂固定化 分别称取已预处理的201×4阴离子交换树脂及D201大孔阴离子交换树脂各1.0 g于10 mL离心管中,加入pH 7.5的酶液6 mL,4℃、100 r/min下振荡固定化2 h。混合物8 000 g离心5 min,测定上清酶活。后用20 mmol/L磷酸盐缓冲液洗涤至无酶析出,测定洗涤液酶活性及固定化酶活力,计算固定化酶载量及酶活回收率。

将固定化的黄嘌呤氧化酶,置于50℃恒温水浴,2 h后测定酶活力,各组以未加热处理的固定化酶酶活为100%,计算各组固定化酶的相对酶活。
1.7.2 琼脂糖介质的修饰及其固定化 参考文献方法[19],分别先将间隔臂甘氨酸、谷氨酸、天冬氨酸交联于预处理的琼脂糖介质上,3种修饰后的介质分别命名为琼脂糖-甘氨酸介质 (Sepharose-Gly)、琼脂糖-谷氨酸介质(Sepharose-Glu)、琼脂糖-天冬氨酸介质(Sepharose-Asp)。称取不同的羧基载体各1.0 g于10 mL离心管中,添加酶液,调节pH至6.5,加入EDC共价交联固定化黄嘌呤氧化酶,4℃振荡固定15 h,混合物8 000 g离心5 min,测定上清酶活。后用0.6 mol/L氯化钠洗脱非共价交联的酶,至洗脱液无酶析出,再用20 mmol/L磷酸盐缓冲液洗涤,测定洗脱液、洗涤液酶活性及固定化酶活力,计算固定化酶载量及酶活回收率。
将各修饰的琼脂糖固定化酶置于50℃恒温水浴,2 h后测定酶活力,各组以未加热处理的固定化酶酶活为100%,计算各组固定化酶的相对酶活。
1.8 固定化化酶与游离酶热稳定性的比较
1.8.1 不同温度下固定化酶与游离酶热稳定性比较 将游离酶与固定化酶置于20 mmol/L磷酸盐缓冲液(pH 7.5)中,不同温度下(25、35、45、55、65、75℃)保温1 h,冷却至4℃,测定各组酶活。以各组未做处理酶的酶活为100%,计算相对酶活。
1.8.2 固定化酶与游离酶最适稳定pH的比较 将酶液于不同 pH 条件下(5.5~8.5),50 ℃保温 1 h,冷却至4℃,测定各组酶活,各组以0 h时酶活为100%,计算相对酶活。
1.8.3 固定化酶与游离酶存储稳定性的比较 将固定化酶与游离酶置于20 mmol/L Tris-HCl缓冲液(pH 7.5)中,置于50℃恒温水浴,定时取样,冷却至4℃,测定固定化酶与游离酶酶活力,各组以0 h时酶酶活为100%,计算各组不同时间处相对酶活。
2 结果与讨论
2.1 XOD酶学性质分析
2.1.1 XOD相对分子量的确定 由前期研究SDSPAGE电泳测得,菌种Arthrobacter M3产的黄嘌呤氧化酶含两个亚基,相对分子质量分别约为100 000及35 000[17]。由图1凝胶过滤图谱知,黄嘌呤氧化酶标准品(相对分子质量160 000)凝胶过滤出峰时间为11.64 min,Arthrobacter M3黄嘌呤氧化酶出峰时间则为11.98 min,即比黄嘌呤氧化酶标准品相对分子质量略小。综合判定,节杆菌Arthrobacter M3黄嘌呤氧化酶为相对分子质量约135 000的异质二聚体蛋白。

图1 XOD标准品与来自Arthrobacter M3的XOD凝胶过滤图谱Fig.1 Elution profile of standards and the XOD from Arthrobacter M3 by size -exclusion chromatography
2.1.2 XOD的最适反应温度及最适反应 pH温度是影响酶反应效率的重要因素之一,一定范围内提高反应温度可加快反应速率。在25~52℃范围内进行酶活力测定,结果见图2。由图2可知,37℃时测得XOD酶活力最高。
在不同pH值下进行酶酶活力测定,结果见图3。该酶最适反应pH为7.5,溶液pH<5.5或pH>9.0时对酶活力测定影响较大。
2.1.3 金属离子对酶活的影响 如表1所示,不同金属离子对XOD酶活影响具有差异性。Mn2+对XOD活性具有激活作用,相对酶活提高35.6%,Co2+及Zn2+对XOD酶活具有一定抑制作用,相对酶活分别降低 21.1%和 67.8%,Cu2+、Ag+、Hg2+对 XOD 酶活具有致死作用,这可能是由于3种金属离子作用于蛋白巯基,导致XOD变性失活。

图2 温度对XOD酶活力测定的影响Fig.2 Effect of temperature on the activity of XOD

图3 pH对XOD酶活力测定的影响Fig.3 Effect of pH on the activity of XOD

表1 不同金属离子对XOD活性的影响Table 1 Effect of various metal ions on the activity of XOD
2.2 XOD固定化方法比较
由表2可知,黄嘌呤氧化酶经不同方法固定化后,其热稳定性均不同程度的提高。
大孔阴离子交换树脂固定化,D201树脂的固定化效率优于201×4树脂,这可能是由于D201树脂为大孔阴离子交换树脂,相比于普通201×4树脂,其颗粒内缝隙孔径较大,有利于蛋白及底物的进出。
修饰的琼脂糖介质固定化,3种固定化酶中,琼脂糖-谷氨酸介质固定化酶,酶活回收率及热稳定性最佳,固定化酶载量稍低于琼脂糖-甘氨酸介质固定化的酶。这可能是由于,谷氨酸含有两个游离羧基,琼脂糖-谷氨酸介质可多点交联XOD,使固定化酶更加牢固,稳定性增加,这同时也可能引起底物进入酶催化中心受阻,使得固定化酶表观酶活力(载量)下降。
综合比较,修饰的琼脂糖介质固定效果化优于大孔阴离子交换树脂,D201及201×4为含苯乙烯-二乙烯苯骨架的离子交换树脂,对XOD的固定化作用主要靠离子键及疏水相互作用。而修饰的琼脂糖介质靠共价交联的方法固定XOD,结合作用力强于D201及201×4树脂,这可能致使其固定化效果优于D201及201×4树脂。

表2 不同载体对XOD固定化的影响Table 2 Effect of different supports on immobilization of XOD
2.3 固定化酶与游离酶热稳定性的比较
2.3.1 固定化酶与游离酶不同温度下热稳定性比较 由上述固定化结果可知,琼脂糖-谷氨酸介质固定化效率最佳,因此对其与游离酶的热稳定性性能进行比较。由图4可知,不同温度下保温1 h,固定化的黄嘌呤氧化酶热稳定均优于游离酶。75℃保温1 h,游离酶已几乎无酶活,琼脂糖-谷氨酸固定化酶仍剩余22.1%。
2.3.2 固定化酶与游离酶最适稳定pH分析 由图5可知,在 pH 5.5~8.5范围内,50℃保温 1 h,琼脂糖-谷氨酸固定化酶剩余的相对酶活均高于45%,而游离酶在较低酸碱条件下加热处理,酶活损失较大。pH 8.5下剩余的相对酶活仅为2.1%。由此可知,琼脂糖-谷氨酸固定化酶比游离酶具有更强的酸碱抵抗能力。

图4 不同温度下游离酶与固定化酶热稳定性比较Fig.4 Comparison of the stability between free and immobilized xanthineoxidaseunderdifferent temperatures

图5 游离酶与固定化酶的pH稳定性Fig.5 pH stability of free and immobilized xanthine oxidase
2.3.3 固定化酶与游离酶存储稳定性的比较 将琼脂糖-谷氨酸固定化酶与游离酶置于50℃保温,二者相对酶活随时间变化曲线见图6。由图可知,游离酶放置3 h后,相对酶活仅剩余8.0%,而琼脂糖-谷氨酸固定化酶仍剩余48.3%,半衰期由游离酶的0.84 h延长至固定化酶的2.2 h,提高了1.6倍。
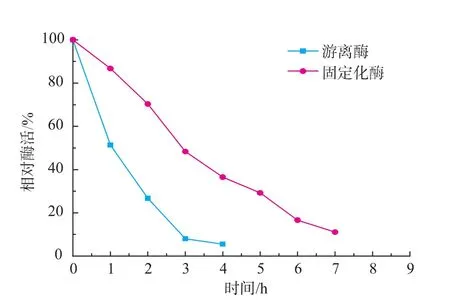
图6 固定化酶与游离酶存储稳定性Fig.6 Storage stability of free and immobilized xanthine oxidase
3 结语
节杆菌Arthrobacter M3黄嘌呤氧化酶为含两个不同亚基的异质二聚体,相对分子质量为135 000,与所报道文献中均不同,其最适反应温度为37℃,最反应pH为7.5。采用修饰的琼脂糖介质及大孔阴离子交换树脂对黄嘌呤氧化酶进行固定化,发现以修饰的琼脂糖介质固定化的酶热稳定性较好,其中以琼脂糖-谷氨酸固定化的酶性能最佳,50℃下半衰期提高了1.6倍,有效提高了黄嘌呤氧化酶稳定性,为其在医学诊断及工业催化中的稳定应用奠定基础,后期将进一步探索改造黄嘌呤氧化酶稳定性的方法。
[1]Pritsos C A.Cellular distribution,metabolism and regulation of the xanthine oxidase enzyme system[J].Chem Boil Interact,2000,129:195-208.
[2]黎瑞珍,杨庆建,陈贻锐.超氧化物歧化酶(SOD)活性的测定及其应用研究[J].琼州大学学报,2004,1l:34-36.LI Ruizhen,YANG Qingjian,CHEN Yirui.Study of determination of superoxide dismutase (SOD) activation and application[J].Journal of Qiongzhou University,2004,11(5):34-36.(in Chinese)
[3]Pei J H,Li X Y.Xanthine and hypoxanthine sensors based on xanthine oxidase immobilized on a CuPtCl6 chemically modified electrode and liquid chromatography electrochemical detection[J].Ana Chim Acta,2000,414(1):205-213.
[4]胡红焱,崔云龙,邹德勇,等.黄嘌呤氧化酶比色法测定血清无机磷[J].中华医学检验杂志,1998,2l(4):214-216.HU Hongyan,CUI Yunlong,ZHOU Deyong,et al.A enzymatic method for the determination of inorganic phosphate in serum[J].Chinese Journal of Medical Laboratory Sciences,1998,21(4):214-216.(in Chinese)
[5]孟疆辉,陈蔚梅.利用黄嘌呤氧化酶提高病毒唑转化率[J].武汉大学学报:自然科学版,1999,45(6):838-840.MENG Jianghui,CHEN Weimei.Using xanthine oxidase to improve the productivity of Ribavirin (RBV)[J].Journal of Wuhan University:Natural Science Edition,1999,45(6):838-840.(in Chinese)
[6]Bhushan B,Paquet L,Halasz A,et al.Mechanism of xanthine oxidase catalyzed biotransformation of HMX under anaerobic conditions[J].Biochem Biophy Res Commun,2003,306(2):509-515.
[7]Thomas S,Annette R,Jan R A.Selenium-containing xanthine dehydrogenase from Eubacterium barkeri[J].Eur J Biochem,1999,264(3):862-871.
[8]William T S,Thressa C S.Selenium-dependent metabolism of purines:A selenium-dependent purine hydroxylase and xanthine dehydrogenase were purified from Clostridium purinolyticum and characterized[J].Proc Natl Acad Sci,2000,97:7208-7213.
[9]Koenig K,Andreesen J R.Xanthine dehydrogenase and 2-furoyl-coenzyme A dehydrogenase from Pseudomonas putida Fu1:two molybdenum-containing dehydrogenases of novel structural composition[J].J Bacteriol,1990,172:5999-6009.
[10]黄蓓,孙建中,李伟,等.聚丙烯酰胺-聚乙二醇对L-天门冬酰胺酶的包埋研究[J].高校化学工程学报,2003,17(4):431-437.(in Chinese)HUANG Bei,SUN Jianzhong,LI Wei,et al.Studies on immobilized L-asparaginase based on polyacrylamide and PEG[J].Journal of Chemical Engineering of Chinese Universities,2003,17(4):431-437.
[11]Kumar S,Dwevedi A,Kayastha A M.Immobilization of soybean (glycine max) urease on alginate and chitosan beads showing improved stability:analytical applications[J].J Mol Catal B:Enzym,2009,58(1-4):138-145.
[12]苏二正,夏涛,宛晓春,等.单宁酶和β-葡萄糖苷酶的共固定化[J].食品与生物技术学报,2006,25(1):40-44.SU Erzheng,XIA Tao,WAN Xiaochun,et al.Studies on the co-immobilization of tannase and β-glucosidase[J].Journal of Food Science and Biotechnology,2006,25(1):40-44.(in Chinese)
[13]时敏,王雪,马丽娜,等.醋酸纤维素-聚丙烯复合膜固定化转谷氨酰胺酶的研究[J].食品科学,2013,34(9):155-158.SHI Min,WANG Xue,MA Lina,et al.Cellulose acetate-polypropylene composite membrane immobilized phospholipase[J].Food Science,2013,34(9):155-158.(in Chinese)
[14]虞英,蒋慧亮.离子交换树脂吸附法固定化脂肪酶的研究[J].食品与生物技术学报,2007,26(4):97-100.YU Ying,JIANG Huiliang.Study of lipase immobilization on the exchange resin by adsorption[J].Journal of Food Science and Biotechnology,2007,26(4):97-100.(in Chinese)
[15]Amini K,Sorouraddin M H,Rashidi M R.Activity and stability of rat liver xanthine oxidase in the presence of pyridine[J].Can J Chem,2011,89:1-7.
[16]李忠琴,许小平,王武.奶油黄嘌呤氧化酶的酶学性质研究[J].食品科学,2008,29(9):420-422.LI Zhongqin,XU Xiaoping,WANG Wu.Study on characteristics of xanthine oxidase from milk cream[J].Food Science,2008,29(9):420-422.(in Chinese)
[17]ZHANG Yuran,XIN Yu,YANG Hailin,et al.Novel affinity purification of xanthine oxidase from Arthrobacter M3[J].J Chromatogr B,2012,906:19-24.
[18]李忠琴,许小平,王武.辣根过氧化物酶分光光度法测定黄嘌呤氧化酶的活性[J].分析化学,2006,34(6):821-824.LI Zhongqin,XU Xiaoping,WANG Wu.Spectrophotometic determination of activity of xanthine oxidase by horseradish peroxidase[J].Chinese journal of analytical chemistry,2006,34(6):821-824.(in Chinese)
[19]XIN Yu,YANG Hailin,XIA Xiaole.Affinity purification of a cholesterol oxidase expressed in Escherichia coli[J].J Chromatogr B,2011,879:853-858.
