毛细管电泳法测定绿茶酶解液中的还原糖成分
2014-12-16王芝彪章银军龚玉雷沈雪亮
王芝彪,章银军,龚玉雷,沈雪亮
(浙江工业大学生物与环境工程学院,浙江杭州,310014)
茶饮料是一种非酒精饮料,生产中一般选用粗茶作为原料加水浸提,存在提取率低、滋味淡、茶沉淀多等缺点,现代生物酶技术的应用可解决这些缺点。添加外源果胶酶、纤维素酶等[1]主要植物破壁酶,将高聚植物纤维、果胶等细胞壁成分水解成可溶性还原糖,既能促进茶叶中有效成分的扩散和浸出,又能增加茶浸提液的甜度。
在绿茶的浸提中通常把果胶酶和纤维素酶等酶复配起来应用,这些复配的水解酶水解绿茶后主要产物是不同的还原糖,其中果胶酶水解的终产物主要是半乳糖醛酸、鼠李糖[2-3]等;纤维素酶水解后的终产物主要是葡萄糖[4]等;糖苷酶水解的终产物主要是半乳糖和甘露糖等[5],所以准确地检测绿茶酶解液中还原糖的组分和含量,可以为评价每种酶水解绿茶的效果和植物破壁酶的复配提供参考。
根据茶叶来源和叶芽的不同,绿茶中的还原糖组分和含量也不同。结合文献报道[6-7],绿茶中主要含有麦芽糖、乳糖、木糖、阿拉伯糖、葡萄糖、鼠李糖、半乳糖、甘露糖、半乳糖醛酸等9种还原糖。目前,还原糖定量分析方法主要有气相色谱(GC)或高效液相色谱(HPLC)[6]。由于还原糖具有沸点高、不易挥发且不含生色基团等特点,使用气相检测需要将还原糖转化为挥发性衍生物,操作繁琐复杂。液相检测需要添加特殊设备如蒸发光检测器[7]或衍生发色基团[8]等,检测的灵敏度相对较低,所用的液相柱价格昂贵。毛细管电泳法是根据质荷比分离物质,具有操作简单、分离效率高、样品消耗少、绿色环保等特点,能弥补气相和液相色谱的不足。利用毛细管电泳仪检测还原糖目前仅见于牛奶、啤酒[11]、海带中单糖[9]和藏红花[10]等,在绿茶酶解液还原糖的检测中尚未见报道。本文对毛细管电泳法的检测条件进行了优化,建立了测定绿茶浸提液中还原糖组分和含量的实验方法,并进一步验证了该方法的可行性。
1 材料与方法
1.1 原材料
炒青绿茶:由杭州浙大百川生物食品技术有限公司(以下简称浙大百川)提供。
自制复合水解酶:将果胶酶和纤维素酶(由浙大百川提供)按比例复配而成[14],其中果胶酶和纤维素酶的活力分别为527.96 U/mL和167.3 IU/mL。
植物水解酶:购自诺维信公司,其中果胶酶活力为437.0 U/mL,纤维素酶活力为8.3 IU/mL。
1.2 仪器与试剂
Beckman P/ACETM MDQ CE型毛细管电泳仪,非涂层石英毛细管柱(50 μm×61.5 cm,有效长度54.5 cm)。
色谱级甲醇和分析级药品:PMP(1-甲基-3-苯基-5-吡唑啉酮),NaOH,HCl,柠檬酸,柠檬酸三钠,三氯甲烷和标准品 D-麦芽糖(Mal)、D-乳糖(Lac)、D-木糖(Xyl)、L-阿拉伯糖(Ara)、D-葡萄糖(Glc)、D-鼠李糖(Rha)、D-半乳糖(Gal)、D-甘露糖(Man)、D-半乳糖醛酸(GalA)。
1.3 电泳标准品的衍生
准确配制浓度均为10 mmol/L的9种还原糖混合标样,取200 μL标样(或绿茶浸提液)加入400 μL 0.3 mol/L 的 NaOH和400 μL 0.5 mol/L的PMP(1-苯基-3甲基-5-吡唑啉酮,配好放至深黑色)衍生剂混匀,70℃水浴反应30 min,冷却至室温后加入400 μL 0.3 mol/L的HCl溶液和1 mL CHCl3萃取,去掉下层液,重复萃取3 次[11],12 000 r/min 离心 6 min,取上清液备用进样。
1.4 绿茶样品的制备
1.0 g烘干的炒青绿茶浸泡于20 mL pH 5.0的柠檬酸缓冲液中,加入不同的水解酶,在50℃、200 r/min下保温8 h,将酶解液于12 000 r/min下离心6 min,取上清液,按照1.2衍生标样的方法将绿茶样品衍生后备用进样。
1.5 毛细管电泳测定方法
测定条件:结合文献报道[10-11]确定电压20 kV,硼酸浓度175 mmol/L,pH 值10.5,柱温25℃,每次使用前用0.1 mol/L NaOH和超纯水各洗5 min。
进样程序:0.1 mol/L NaOH溶液洗柱3 min,超纯水洗柱5 min,缓冲液洗柱7 min,0.5 psi进样10 s,检测波长254 nm,20 kV电压分离60 min。
1.6 分析计算方法
分离度又称分辨率,是判断分离物质在色谱柱中的分离情况,用R表示,R等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比。
样品加标回收率:取2份相同的样品,其中1份加入定量的待测成分标准物质;2份同时按相同的步骤分析,加标的1份所得的结果减去未加标1份所得的结果,其差值同加入标准物质的理论值之比即为样品加标回收率。加标回收率的测定,是实验室内经常用以自控的一种质量控制技术。
最低检测极限由于缺少明确的定义,目前比较公认的分为方法检测限和仪器检测限两种,本文使用方法检测极限。公式如下:

式中:T1、T2指色谱峰的保留时间;Y1、Y2色谱峰峰宽;Ct测得样品的总量;Cb本底的量;Cstd标样添加量;Cl样品的最低检测极限;Ki置信因子取3;Si为12次样品读数的标准偏差;C样品含量;样品测量读数平均值。
2 结果与讨论
2.1 毛细管电泳条件的优化
2.1.1 采用毛细管电泳测定9种还原糖标样
毛细管电泳条件:电压 20 kV,硼酸浓度 175 mmol/L,pH 值 10.5,柱温 25 ℃,每次使用前用 0.1 mol/L NaOH和超纯水各洗5 min,9种糖在该条件下有较好的分离(图1)。但是乳糖和木糖、半乳糖和甘露糖这两对糖的出峰时间比较接近,分离度分别是0.77和0.91,均小于1,不能达到基线分离。另外最后一个峰(半乳糖醛酸)的出峰时间相对较长,达到了44.39 min,为了提高实验的分离效率,本文用该峰的出峰时间代替整体峰的出峰时间,把乳糖和木糖的分离度R1、半乳糖和甘露糖的分离度R2,以及半乳糖醛酸的出峰时间TGalA(min),作为参考标准,对毛细管电泳分离影响较大的硼酸缓冲液浓度、pH值和电压条件进行优化,获得9种还原糖的基线分离。

图1 毛细管电泳初始条件下分离9种标样图Fig.1 Separation of 9 standard samples by capillary electrophoresis under initial conditions
2.1.2 pH 值的影响
pH值对物质的电泳分离条件影响非常大,糖类样品通常在pH 9~11之间能够得到较好的分离。所以本实验先固定硼酸浓度为175 mmol/L,分离电压20 kV,调节 pH 至 10.5~11.2。实验结果表明(表1),随着pH值的增大,乳糖和木糖的分离度(R1)有较大的提高,半乳糖和甘露糖的分离度(R2)也缓慢增大,同时半乳糖醛酸的出峰时间TGalA向后推移。从出峰时间和分离度两方面考虑,选择pH值为11.0进行下一步实验。
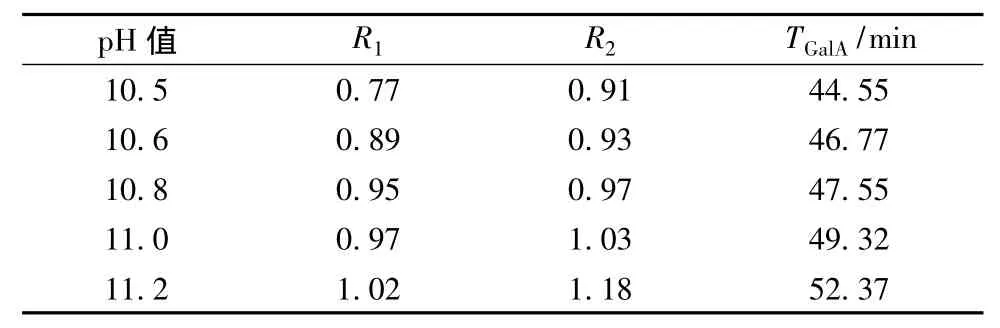
表1 pH值对R1、R2和半乳糖醛酸出峰时间的影响Table 1 Effects of pH value on the separation of R1,R2and migration time of galacturonic acid
2.1.3 硼酸浓度的影响
硼酸与糖结构中的羟基形成络离子,影响电渗流以及迁移率,是分离糖类物质常用的缓冲液。固定pH值为11.0,分离电压20 kV,调节硼酸浓度为150~225 mmol/L。表2显示了不同硼酸浓度缓冲液对分离度的影响,分离度R1随着硼酸浓度的增大而增大,R2先增加后减小,但出峰时间也在随着硼砂浓度的增大而延长,因此,选择硼酸浓度为200 mmol/L作进一步实验。
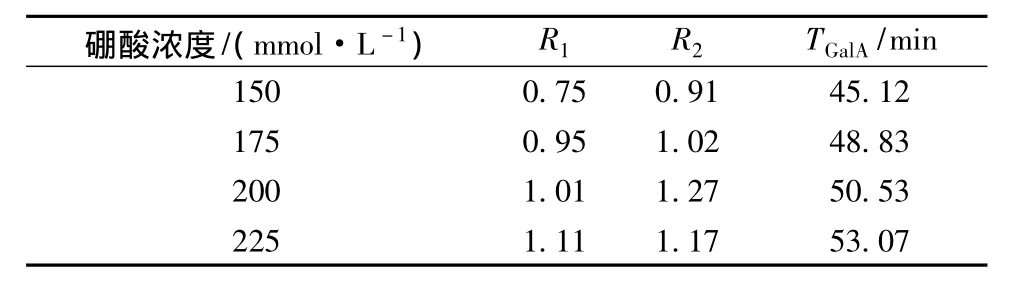
表2 硼酸浓度对R1、R2和半乳糖醛酸出峰时间的影响Table 2 Effects of borate concentrations on the separation of R1,R2and migration time of galacturonic acid
2.1.4 电压值的影响
固定pH为11.0,硼砂浓度为200 mol/L,微调电压20~21.5 kV。表3 显示,R1的值大于1.0,基本达到了色谱基线分离条件,但随着R1的增大导致木糖向乳糖峰靠近。R2随着电压值增大而先增加后降低,降低原因是两峰峰宽变大,所以电压值确定为21 kV,在该值下出峰时间较短,各组还原糖都得到了基线分离。

表3 电压对R1、R2和半乳糖醛酸出峰时间的影响Table 3 Effects of voltage on the separation of R1,R2 and migration time of galacturonic acid
2.1.5 应用优化条件测定9种还原糖标样
经上述实验优化后的毛细管电泳最佳测定条件为电压 21 kV,硼酸缓冲液浓度 200 mmol/L,pH 11.0,柱温25 ℃,进样程序,0.1 mol/L NaOH 溶液洗柱3 min,超纯水 5 min,缓冲液 7 min,0.5 psi进样 10 s,检测波长254 nm,21 kV电压分离60 min。在此条件下,9种还原糖中乳糖和木糖、半乳糖和甘露糖这两对糖的分离度分别是1.23和1.32。如图2所示,9种还原糖获得了很好的分离,达到了基线完全分开的色谱分析要求。

图2 9种混合还原糖标样电泳图Fig.2 Typical electropherograms of nine standard reducing carbohydrates
2.2 线性回归方程、相关系数和最低检测极限
将9种还原糖混合标样的母液,稀释至0.5、1、2、4、8、10 mmol/L六个浓度梯度,分别衍生后进样分析,以峰面积为纵坐标(Y),浓度为横坐标(X)作图,得9种还原糖的回归方程,见表4。线性回归方程相关系数 r2在 0.9939~0.9994 之间均大于 0.99,线性相关性较好。再把9种还原糖母液稀释到8 mmol/L,衍生后重复进样12次,按信噪比(S/N=3)算出最低检测极限(Cl)。表4显示,最低检测极限在0.09~0.23 μmol/mL,表明该方法的检测灵敏度较高。
2.3 重复性和稳定性试验
取9种标样还原糖混合液衍生,1天内重复进样6次;另取1份放在4℃的冰箱中,每天进样1次,连续进样5天,记录出峰时间和峰面积,结果见表5。日内和日间的相对标准偏差分别在1.2~4.1和1.3~2.8、1.4~4.7 和 1.5~5.0之间,表明仪器日内重复性良好,5天内的稳定性也能达到检测要求,可以满足大批量的实验结果处理分析。
2.4 加标回收率试验
精确称取1 g茶叶样品3份,添加8 U的自制复合水解酶和4 U的纤维素酶,水解后的酶解液作为本底还原糖的量,再分别按表6加入5种标样还原糖,按1.4方法处理,各重复3次取平均值,按公式计算出每个浓度的还原糖加标回收率。5种还原糖的加标回收率在96.74%~100.38%之间,符合复杂物质回收率可以在95%~110%之间的要求,说明该方法能很好地应用于检测绿茶酶解液中还原糖的组分和含量。
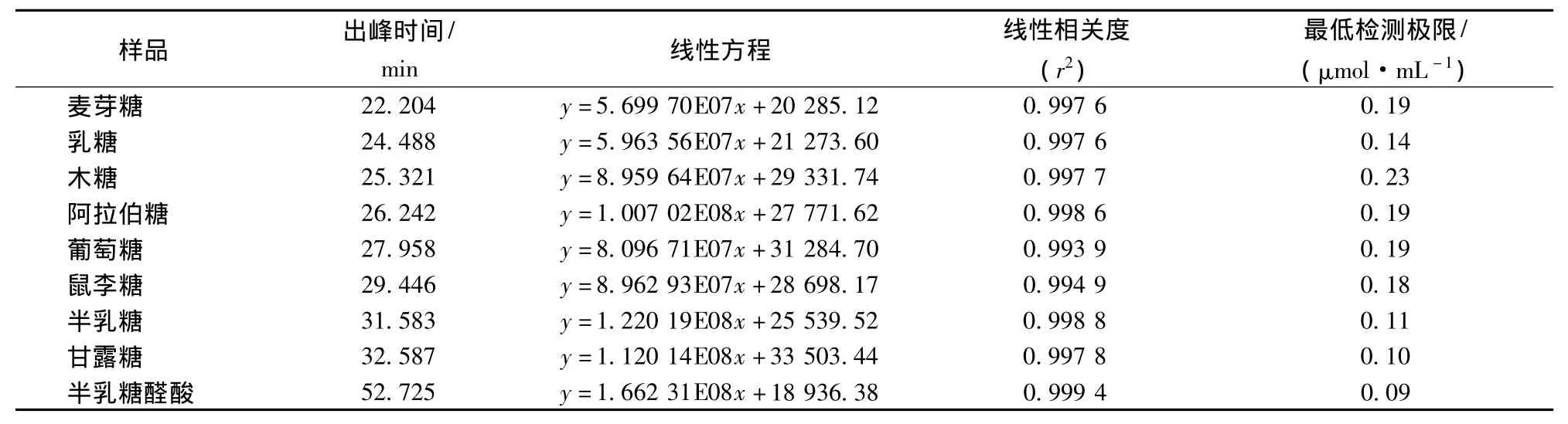
表4 9种还原糖的出峰时间、线限方程、相关系数和最低检测限Table 4 Retention time of 9 reducing carbohydrates,regression analysis,Co-efficient and minimum detection limit of CZE method

表5 日内重复性及日间稳定性实验Table 5 Precision of the migration time and corrected peak area of the tested carbohydrates by the developed CZE method
2.5 采用CZE检测绿茶酶解液中还原糖的组分与含量
2.5.1 CZE测定2种酶解液中还原糖的组分图
加入自制复合水解酶和诺维信植物水解酶按果胶酶活力计各8 U,按1.4的方法处理后进样,测定绿茶酶解液中还原糖的组分和含量。如图3和图4所示,两种酶水解绿茶后酶解液中还原糖的组分主要有木糖、阿拉伯糖、葡萄糖、半乳糖和半乳糖醛酸5种,5种还原糖与标样的出峰时间能很好地吻合,并且不同峰相互之间的出峰时间间隔也很大。所以该优化条件能够完全满足检测绿茶酶解液中还原糖的需要。

表6 毛细管电泳检测绿茶酶解液中加标回收率Table 6 CZE determination of the reducing sugars in the sample of green tea extract and recovery analysis
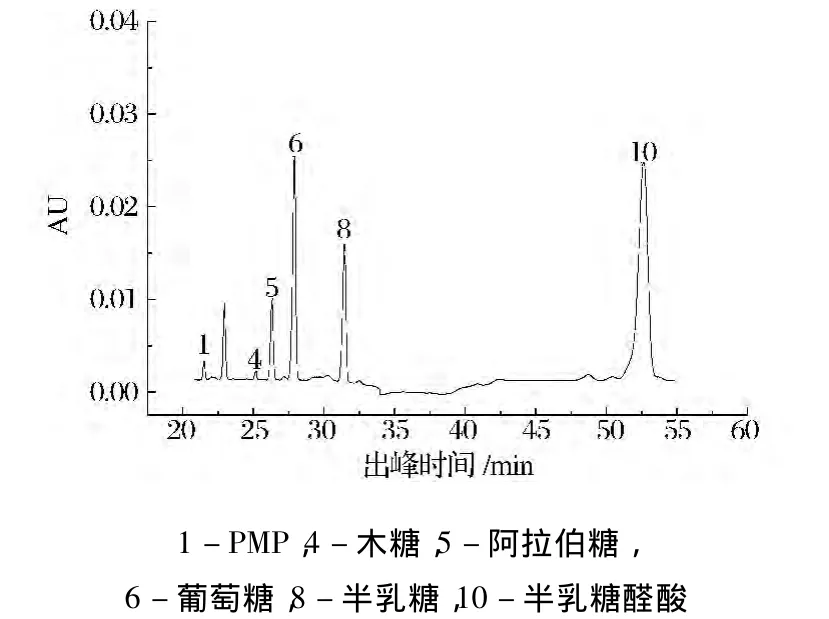
图3 诺维信植物水解酶水解绿茶后酶解液中主要还原糖的成分图Fig.3 The compositional reducing carbohydrates of plant hydrolysis enzyme hydrolysis of green tea extract

图4 自制复合水解酶水解绿茶后酶解液中主要还原糖的成分图Fig.4 The compositional reducing carbohydrates ofcompound enzyme enzyme hydrolysis of green tea extract
2.5.2 采用CZE测定2种酶解液中还原糖的含量
精确称取1g茶叶3份,1份加入水作为对照组,另外2份分别加入诺维信植物水解酶和自制复合水解酶各8 U,按1.4的方法处理后进样,重复3次,测定绿茶酶解液中还原糖的组分和含量,结果见表7。对照组只加水不加酶,只有少量葡萄糖,添加植物水解酶和自制复合水解酶组,5种还原糖量与对照组相比成倍的增加,特别是葡萄糖和半乳糖醛酸分别提高了十几倍。两种水解酶水解绿茶后产生的5种还原糖含量基本相近,没有太大的差异。所以本实验室自制复合水解酶在水解绿茶产生还原糖含量的参比指标上,可以和诺维信植物水解酶相媲美。
本实验可以再结合其他评价指标如绿茶浸提率、茶汤颜色等,系统而全面地评价自制复合水解酶对绿茶的水解效果,从而得出一种对绿茶浓缩液生产效果好且物美价廉的自制复合水解酶。
3 结论
本文针对绿茶酶解液中还原糖的检测建立了一种快速、高效、灵敏度高的毛细管电泳方法,其检测条件为:电压 21 kV,硼酸缓冲液200 mmol/L,pH 11.0,柱温25℃,进样程序,0.1 mol/L NaOH溶液洗柱3 min,超纯水 5 min,缓冲液 7 min,0.5 psi进样 10s,检测波长254 nm,21 kV电压分离60 min。
对此方法进行可行性试验显示,线性回归方程的相关系数在0.9939~0.9994 之间均大于 0.99,达到了检测物质的线性要求。检测极限在0.09~0.23 μmol/mL,方法的检测的灵敏度高。日内和日间的重复性和稳定性试验相对标准偏差分别在1.2~4.1和1.3~2.8、1.4~4.7 和1.5~5.0,表明仪器日内重复性良好,5天内的稳定性也能达到检测要求,并且5种还原糖的加标回收率在96.74%~100.38%,完全符合检测分析方法所需要的数据条件。应用本方法检测诺维信植物水解酶和实验室自制复合水解酶水解绿茶后产生还原糖的组分和含量,得出两种酶解液中还原糖的组分相同,含量相近,自制复合水解酶在水解绿茶产生还原糖指标上,复配效果非常好。
[1]龚玉雷,魏春,王芝彪,等.生物酶在茶叶提取加工技术中的应用研究[J].茶叶科学,2013,33(4):311-321.
[2]Jayani R S,Saxena S,Gupta R.Microbial pectinolytic enzymes:A review[J].Process Biochemistry,2005,40(9):2 931-2 944.
[3]Mutter M,Beldman G,Schols H A,et al.Rhamnogalacturonan α-L-Rhamnopyranohydrolase.A novel enzyme specific for the terminal nonreducing rhamnosyl unit in rhamnogalacturonan regions of pectin[J].Plant Physiology,1994,106(1):241-250.
[4]Tomme P,Warren R A,Gilkes N R.Cellulose hydrolysis by bacteria and fungi[J].Advances In Microbial Physiology,1995,37:1-81.
[5]Dhawan,Samriti Kaur,Jagdeep.Microbial Mannanases:An Overview of Production and Applications[J].Critical Reviews in Biotechnology,2007,27(4):197-216.
[6]LV You,YANG Xingbin,ZHAO Yan,et al.Separation and quantification of component monosaccharides of the tea polysaccharides from Gynostemma pentaphyllum by HPLC with indirect UV detection[J].Food Chemistry,2009,112(3):742-746.
[7]袁勇,黄建安,李银花,等.高效液相色谱-蒸发光散射检测法测定茶叶中单糖和双糖[J].茶叶科学,2010,30(6):435-439.
[8]徐瑾,张庆合,张维冰,等.液相色谱荧光衍生法在糖类物质分析中的应用[J].色谱,2003,21(2):115-120.
[9]GUO Huaizhong,LIU Fangli,JIA Guiying,et al.Extraction optimization and analysis of monosaccharide composition of fucoidan from Saccharina japonica by capillary zone electrophoresis[J].Journal of Applied Phycology,2013,25(6):1 903-1 908.
[10]马海宁,华玉娟,屠春燕,等.毛细管电泳法分析藏红花植物细胞多糖中单糖组成[J].色谱,2012,30(3):304-308.
[11]WANG Tong,YANG Xingbin,WANG Dongying,et al.Analysis of compositional carbohydrates in polysaccharides and foods by capillary zone electrophoresis[J].Carbohydrate Polymers,2012,88(2):754-762.
[12]GUO Huaizhong,JIANG Wenyue,PANG Xiaomin,et al.Study on the separation mechanism of 1-phenyl-3-methyl-5-pyrazolone derivatives of aldoses in acid buffer by capillary zone electrophoresis[J].Analytical Methods,2012,4(1):265-269.
[13]Salla Hiltune,Heli Sirén.Analysis of monosaccharides and oligosaccharides in the pulp and paper industry by use of capillary zone electrophoresis:a review[J].Anal Bioanal Chem,2013,405(17):5 773-5 784.
[14]龚玉雷.纤维素酶和果胶酶复合体系在茶叶提取加工中的应用研究[D].杭州:浙江工业大学,2013.
