戊糖片球菌产蛋白酶对发酵鲢鱼鱼糜凝胶性能的影响*
2014-12-16戴梦婕许艳顺姜启兴夏文水
戴梦婕,许艳顺,姜启兴,夏文水
(江南大学食品学院,江苏无锡,214112)
我国淡水鱼资源丰富,发酵是一种重要的淡水鱼加工手段。生物发酵可以改善淡水鱼糜制品风味,赋予产品独特的凝胶质构和口感,同时还增加了产品的营养价值,延长了保质期[1]。近年来,研究人员对发酵鱼糜的工艺进行了系统研究,通过单一和混合发酵剂进行淡水鱼糜发酵,得到了具有风味独特、高凝胶强度的发酵鱼糜制品[2-3]。凝胶性能是体现鱼糜制品品质的重要指标,鱼糜凝胶形成机理受到国内外的广泛关注,目前对它的机理研究主要集中在微生物发酵产酸对凝胶形成的作用方面[4]。微生物在发酵过程中除了产酸还会产生大量的代谢产物,如微生物酶、胞外多糖等,微生物产酶对鱼糜的影响不能忽视,但是有关微生物酶在鱼糜凝胶形成中的作用的研究鲜见报道。
本文选取1株广泛用于发酵鱼糜工艺的菌种——戊糖片球菌作为产酶研究对象,利用葡萄糖酸内酯(GDL)和抗生素建立模拟发酵体系,探讨戊糖片球菌产酶对鱼肉蛋白及鲢鱼肌动球蛋白的蛋白质降解作用以及其对鱼糜凝胶性能的影响。
1 材料,设备和方法
1.1 材料与设备
1.1.1 主要材料
鲢鱼:鲜活,体重2~3 kg/条,购于无锡雪浪农贸市场。
菌种:戊糖片球菌,由食品学院提供。
葡糖糖酸内酯(GDL),含量≥99%,食品级。
1.1.2 主要试剂
青霉素,中诺药业有限公司;链霉素,深圳华药南方制药有限公司;两性霉素B,上海金穗生物科技有限公司;干酪素、(NH4)2SO4、三氯乙酸、三羟甲基氨基甲烷(tris)等,购自国药集团化学试剂有限公司。
1.1.3 主要仪器和设备
TA-XT2i质构仪,英国Sable Micro Systems公司;S3500激光粒度分析仪,美国Microtrac公司;冷冻离心机,德国Sigma公司;UV-1000紫外-可见分光光度计,上海天美科学仪器有限公司;pH计,梅特勒-托利多仪器上海有限公司;西贝乐SQ2119DX多功能食品加工机,上海帅佳电子科技有限公司。
1.2 实验方法
1.2.1 戊糖片球菌产酶及粗酶液提纯
将经过2次活化的戊糖片球菌以4%的接种量接种到液体MRS培养基中33℃培养20 h后,10 000 g离心15 min(4℃),上清液即为粗酶液。用不同的饱和度的(NH4)2SO4溶液盐析粗酶液,置4℃冰箱中过夜,选择60%最佳饱和度使蛋白质沉淀完全后,于10 000 g,4℃离心15 min,用Tris-HCl缓冲液(pH 6.8)按1∶5(V/V)溶解沉淀后透析[5]。采用紫外法测定酶活。
1.2.2 建立模拟酸化体系
将新鲜鲢鱼(2~3 kg/条)去头、清洗、取肉后,添加2.5g/100g 葡萄糖酸内酯(GDL)、抗生素[6](20 mg/100 g青霉素,20 mg/100 g链霉素,20 mg/100 g两性霉素)、2%葡糖糖、2%食盐制成鱼糜样品。将鱼糜样品分成均等的2份,1份按照200 u/100 g鱼糜添加粗酶液制成加酶组[7],另1份每100 g鱼糜添加与粗酶液等量体积的 Tris-HCl缓冲液(pH 6.8)作为空白对照。将2份样品搅拌均匀后灌肠,置于30℃的培养箱中。
1.2.3 鲢鱼肌动球蛋白的提取
提取方法参照 Riebroy等的方法[8],将鱼肉绞碎,加入5倍(w∶v)的20 mmol/L磷酸盐缓冲液(pH 6.8),内含有 0.05 mol/L NaCl,匀浆,5,000 g,4 ℃离心10 min弃去上清液,沉淀部分按上述步骤重复操作2次。将收集的沉淀悬浮于10倍(w∶v)的0.6 mol/L NaCl溶液(pH 7.0)中,匀浆,10 000 g,4 ℃离心10 min,用尼龙网过滤去除上清液的结缔组织后加入3倍体积的冷蒸馏水是肌动球蛋白沉淀,10 000 g,4℃离心10 min收集沉淀,即为肌动球蛋白样品。用0.6 mol/L NaCl溶液将肌动球蛋白溶解稀释到10 mg/mL,用HCl溶液调节 pH 值分别为5.0和4.5。按1∶1体积比添加粗酶液,35℃反应24 h后进行浊度,粒径,TCA-溶解肽等指标测定。
1.2.4 pH 及微生物分析
取10 g鱼糜,加入90 mL生理盐水均质后用pH计测定pH值。无菌取样10 g,加入90 mL无菌生理盐水,混合均匀后吸取1 mL上清液进行梯度稀释,选择适合梯度采用涂布平板法在PCA培养基上37℃培养48 h后计数。
1.2.5 非蛋白氮含量测定
非蛋白氮含量测定参考Dierick[9]等的方法。
1.2.6 TCA-溶解肽含量的测定
参照Visessanguan等[10]的方法,取3 g绞碎的鱼糜样品,加入27 mL 4℃的5%的TCA溶液,均质后于4℃静置1 h后,在4℃下12,000 g离心15 min,以牛血清蛋白(BSA)绘制标准曲线,采用双缩脲法测定上清液中蛋白质含量。TCA-溶解肽含量用μmol tyrosine/g表示。测定肌动球蛋白TCA-溶解肽的变化处理样品时用10%TCA溶液与肌动球蛋白按体积比1∶1混合,其他步骤与测定鱼糜样品一致。
1.2.7 浊度分析
将肌动球蛋白稀释到0.2 mg/mL,进行相应处理后测定在350 nm处的吸光度值。
1.2.8 粒径分析
将肌动球蛋白稀释到1 mg/mL,用激光粒度分析仪测定蛋白粒径。
1.2.9 凝胶强度的测定
参照Benjakul等[11]的方法,用20 mm长的凝胶样品(去除肠衣)放置在TA-XT2i质构仪试验台上,采用P50s球形探头,以1.0 mm/s速度穿刺样品至strain 50%处,穿刺曲线上的第1个峰即为破断强度,对应的距离为凹陷深度。
凝胶强度(g·cm)=破断强度(g)×凹陷深度(cm)
破断强度反映凝胶硬度,凹陷深度反映鱼糜凝胶弹性。每个样品做3次平行测定。
1.2.10 数据处理
采用软件Origin8.5和SPSS 18对试验结果进行统计分析。
2 数据与分析
2.1 模拟酸化体系pH变化
从图1中看出,空白组和加酶组在加入GDL和抗生素4 h后pH值从6.5左右降到4.5左右,并在之后的92 h内两者无明显差异,pH值在4.5上下略有浮动。根据其他学者研究发现,pH值的降低会引起蛋白质的变性,对鱼糜凝胶强度产生影响[3],保持pH值稳定性与一致性有利于在酸化体系中客观评价微生物酶对蛋白质的作用以及凝胶性能的影响。

图1 酸化体系pH变化Fig.1 The changes of pH in the acidified system
2.2 模拟酸化体系微生物分析
如图2显示,由于抗生素的作用以及GDL产生的低酸环境,酸化体系中的微生物的生长繁殖受到一定抑制,在96 h的反应过程中,增长趋势平缓,菌落总数控制在104~105CFU/g,不添加抗生素的自然条件下鱼糜微生物数量由初始值104~105CFU/g在24 h内快速增长至108CFU/g,并在之后72 h保持增长最终达到109~1010CFU/g,远高于添加抗生素和GDL的模拟酸化体系中微生物数量。微生物发酵鱼糜中的微生物生长情况与酸化体系相似,发酵菌种成为鱼糜发酵过程中的优势菌,抑制了其他杂菌的生长,除了发酵菌种本身外的其他菌数量也在104~105CFU/g。
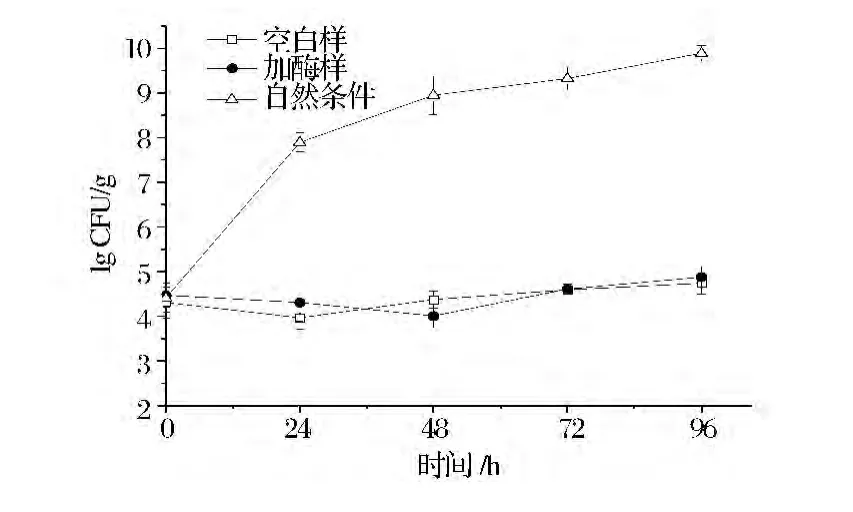
图2 酸化体系微生物变化Fig.2 Microbiological changes in the acidified system
2.3 酸化体系蛋白质降解分析
非蛋白氮的增加是由于鱼肉蛋白在微生物蛋白酶和内源组织蛋白酶的作用下发生了降解作用,生成了低分子质量的多肽和游离氨基酸等。从图3中发现,在反应过程中,空白组与加酶组的非蛋白氮含量在反应24 h时较为接近,分别为4.31和4.93 mgN/g,加入蛋白酶的样品非蛋白氮增长迅速,在96 h时达到 9.73 mgN/g,此时空白组只有 8.47 mgN/g。添加的戊糖片球菌蛋白酶在酸化体系中与蛋白质作用,和内源酶共同生成了较多的低分子质量多肽和游离氨基酸。尤其在24h之后,加酶样与空白样差异性增大,产生的非蛋白氮含量明显增多。

图3 酸化体系NPN变化Fig.3 The changes of NPN in the acidified system
由图4可知,酸化体系中TCA-溶解肽随时间的延长逐渐上升,同时加酶组的含量在96 h中一直高于空白组,增加速度快,含量高,在96 h时加酶组含量多 达 156.2 μmol Tyr/g,比 空 白 组 高 出 27.7 μmol Tyr/g,与开始24 h相比,加酶组与空白组间差异明显加大,这说明戊糖片球菌产酶对鱼糜中蛋白质产生降解作用,鱼糜中低分子肽和游离氨基酸含量增多[12],随着反应时间的增加,戊糖片球菌产酶对鱼糜的作用更加显著。

图4 酸化体系TCA-溶解肽变化Fig.4 The changes of TCA-soluble peptides in the acidified system
2.4 鲢鱼肌动球蛋白降解及聚集程度分析
图5显示了在2种不同pH下的鲢鱼肌动球蛋白TCA-溶解肽的变化。在pH4.5的肌动球蛋白中,加入戊糖片球菌蛋白酶的样品TCA-溶解肽含量明显高于空白样含量,pH 5.0的肌动球蛋白中加酶样比空白样的含量有增加,但增幅不明显。这一方面是因为戊糖片球菌产的蛋白酶为酸性蛋白酶,其最适pH更接近4.5,对蛋白质降解程度大于pH 5.0的肌动球蛋白。

图5 肌动球蛋白TCA-溶解肽变化Fig.5 The changes of TCA-soluble peptides in silver carp actomyosin
浊度和粒径可以用于监测蛋白质的聚集动力学过程。2种pH下肌动球蛋白的浊度和粒径的变化见表1。从表1中看出,pH 5.0条件下的浊度在加酶前和加酶反应后都低于pH 4.5条件下的浊度。浊度的增加表明肌动球蛋白分子相互作用形成了大分子聚集物,利用分光光度计检测时导致光散射增加[13]。2种pH下加入蛋白酶反应后浊度降低,说明蛋白酶的作用破坏了肌动球蛋白的聚集状态,由于蛋白质的聚集状态直接影响凝胶的网络结构,蛋白的聚集状态被蛋白酶破坏后,对凝胶形成亦造成破坏作用。从粒径角度分析,总体上粒径随着pH的降低而增大,同时蛋白酶的加入导致粒径减小,pH4.5条件下由91.26 μm 减低到 85.30 μm。而 pH 5.0 条件下,加入酶反应24 h后粒径减小3.74 μm ,pH 4.5 条件下减小幅度更为明显。
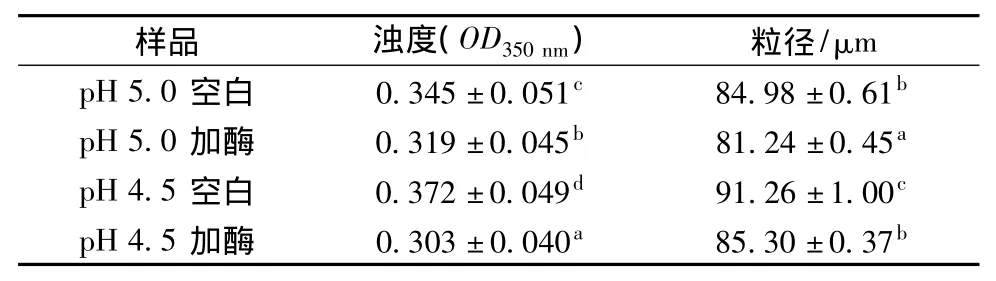
表1 肌动球蛋白浊度及粒径变化Table 1 The changes of turbidity and particle size in silver carp actomyosin
2.5 酸化体系凝胶强度测定
表2反映了蛋白酶加入模拟发酵体系后对鱼糜蛋白的凝胶强度的影响。在体系形成4 h后,随着模拟发酵体系的pH值下降并趋于稳定,因为GDL作用鱼糜的凝胶强度较大。随后在12 h及24 h中鱼糜的破断强度和凹陷深度的变化较小,鱼糜的硬度和弹性保持稳定,添加蛋白酶的鱼糜与空白组之间差距不明显,甚至在12h时加酶组的凝胶强度略大于空白组。在24 h后空白组和加酶组的凝胶强度都开始明显下降,但加酶组鱼糜的弹性和硬度下降幅度更大,加酶组鱼糜凝胶强度始终低于空白组,在96 h后空白组的凹陷深度减少0.11 cm,加酶组减少0.14 cm;空白组破断强度减少299.1 g,加酶组减少354.9 g,其弹性和硬度明显低于空白组。加酶组96 h时的凝胶强度仅为4 h时凝胶强度的32.9%。造成空白组和加酶组凝胶强度降低及两者差异的原因可能是空白组鱼糜中的内源组织蛋白酶对蛋白产生降解作用,而加酶组则由内源组织蛋白酶和微生物酶共同作用,在鱼糜凝胶形成后对凝胶产生劣化影响。
3 结论
在稳定的低酸性环境中,戊糖片球菌产蛋白酶降解了鱼糜中蛋白质,生成了低分子肽和游离氨基酸。蛋白酶一定程度上破坏了肌动球蛋白的聚集,并且在pH 4.5条件下蛋白酶对肌动球蛋白的影响更大。戊糖片球菌产蛋白酶对鱼糜凝胶的硬度和弹性都产生劣化影响并且作用强度随着反应时间的增加而增大,作用时间主要在凝胶形成24 h后。这些有关戊糖片球菌产酶对发酵鱼糜的研究在进一步了解了发酵鱼糜凝胶形成机理的同时将有助于今后发酵鱼糜工艺的改进及发展。

表2 不同时间下空白组和加酶组的凝胶强度变化Table 2 The changes of gel strength in the acidified system
[1]YIN LJ,Pan CL,Jiang ST.Effect of lactic acid bacterial fermentation on the characteristics of minced mackerel[J].Journal of Food Science,2002,67(2):786-792.
[2]HU YJ,XIA WS,GE CR.Characterization of fermented silver carp sausages inoculated with mixed starter culture[J].Lwt-Food Science and Technology,2008,41(4):730-738.
[3]XU YS,XIA WS,YANG F,et al.Effect of fermentation temperature on the microbial and physicochemical properties of silver carp sausages inoculated with Pediococuss pentosaceus[J].Food Chemistry,2010,118(3):512-518.
[4]XU YS,XIA WS,JIANG QX,et al.Acid-induced aggregation of actomyosin from silver carp(Hypophthalmichthys molitrix)[J].Food Hydrocolloids,2012,27(2):309-315.
[5] 施巧琴.酶工程[M].北京:科学出版社,2005(2):149-164.
[6]Molly K,Demeyer D,Johansson G,et al.The importance of meat enzymes in ripening and flavour generation in dry fermented sausages.First results of a European project[J].Food Chemistry,1997,59(4):539-545.
[7]Olga D,Manuela F,Gonzalo D,et al.Proteolysis in dry fermented sausages:The effect of selected exogenous proteases[J].Meat Science,1997,46(1):115-128.
[8]Riebroya S,Benjiakula S,Visessanguanb W,et al.Acidinduced gelation of actomyosin from Atlantic cod(Gadus morhua)and burbot(Lota lota)[J].Food Hydrocolloids,2009,23(1):26-39.
[9]Dierick N,Vanderkerckove V,Demeyer D.Changes in non-protein nitrogen compounds during dry sausage ripening[J].Journal of Food Science,1973,39:301-304.
[10]Visessanguan W,Benjakul S,Riebroy S,et al.Changes in composition and functional properties of proteins and their contributions to Nham characteristics[J].Meat science,2004,66(3):579-588.
[11]Balange A,Visessanguan W,Thongkaew C,et al.Effect of frozen storage on chemical and gel-forming properties of fish commonly used for surimi production in Thailand[J].Food hydrocolloids,2005,19(2):197-207.
[12]Suttirug P,Soouawat B,Wonnop V.Effects of washing with oxidizing agents on the gel-forming ability and physicochemical properties of surimi produced from bigeye snapper[J].Food Chemistry,2006,98(3):431-439.
[13]Lefevre F,Fauconneau B,Thompson J W,et al.Thermal denaturation and aggregation properties of Atlantic salmon myofibrils and myosin from white and red muscles[J].Journal of Agricultural and Food Chemistry,2007,55(12):4 761-4 770
