4种模式美拉德反应条件及其产物抗氧化作用
2014-12-16周向军周健冯进兵黄凯
周向军,周健,冯进兵,黄凯
(天水师范学院生命科学与化学学院,甘肃 天水,741001)
美拉德反应为非酶促褐变,是指食品加工和贮藏过程中还原糖羰基与胺、蛋白质或氨基酸等含氮化合物发生复杂化学反应的总称,其产物(Maillard reaction products,MRPs)结构复杂、种类繁多,主要含有类黑精、还原酮及含N、S的杂环化合物[1]。美拉德反应分为3个阶段:初级阶段起始于羰基与氨基的缩合、Amadori/Heyns化合物的生成;高级阶段主要是Amadori/Heyns的降解、烯醇化和醇醛缩合等生成风味小分子物质;终极阶段是指小分子物质自身或相互聚合成大分子褐色物质[2]。研究表明,影响美拉德反应的因素除糖和氨基化合物的种类、浓度外,还受温度、pH、时间、水分活度等因素的影响[3]。壳聚糖是广泛存在于甲壳类动物硬壳及菌类细胞壁中的碱性高分子多糖,具有提高免疫能力、降低胆固醇等活性,其含有游离的羰基和氨基,分别加入阿拉伯糖和果糖时,壳聚糖的氨基能与后者的羰基发生美拉德反应。与其他化学和酶法改性相比,壳聚糖/还原糖体系的MRPs具有一定的抗氧化性、抑菌性、乳化性和水溶性等,因而在食品添加剂行业具有广阔的应用前景。研究表明,BHA、BHT等可能有致癌作用,TBHQ的应用也受到严格的限制,而MRPs可为天然抗氧化剂的开发提供新的思路。MRPs的研究主要集中在其成分鉴定、机理探讨及抗氧化活性测定等方面[4-6],但由于美拉德反应极其复杂,不易控制,其产物的分离制备极为困难[7],因此,目前大多只能采用模式美拉德反应来进行研究,从而获得少量特定氨基供体与羰基供体发生美拉德反应的信息。同时,MRPs的形成机制、组成结构、性质及抗氧化机理仍未明确[8],不同体系产生的 MRPs,其抗氧化活性难以找到共同规律,要阐明食品体系MRPs的抗氧化作用机理及相关因子,目前的技术手段尚不能对其进行定性定量分析,具体哪种物质对MRPs抗氧化起主要作用还有待进一步研究。本试验分别以精氨酸和赖氨酸为氨基供体,麦芽糖为羰基供体;壳聚糖为氨基供体,阿拉伯糖和果糖分别为羰基供体,研究各体系紫外可见光谱和荧光光谱随加热时间的变化,氨基与羰基物质的量比、初始pH值、温度对产物褐变的影响及反应过程的pH变化,MRPs对DPPH·、HO·、H2O2的清除作用和总还原力。
1 材料与方法
1.1 材料与试剂
果糖、赖氨酸、精氨酸、麦芽糖、L-阿拉伯糖、壳聚糖、邻二氮菲、FeSO4、K3Fe(CN)6、三氯乙酸、FeCl3及H2O2等,均为国产分析纯;DPPH为Sigma产品。
1.2 仪器
AL204型电子天平,梅特勒-托利多仪器有限公司;TGL-20M型高速台式冷冻离心机,湖南湘仪离心机仪器有限公司;PHS-3D雷磁pH计,上海精密科学有限公司;UV-9600型紫外分光光度计,北京瑞利分析仪器公司;UV-1800型分光光度计,日本岛津;RF-5301型荧光分光光度计,日本岛津。
1.3 实验方法
1.3.1 MRPs制备
称取0.1 g精氨酸、0.1 g赖氨酸于烧瓶中,加入蒸馏水使之完全溶解,加入麦芽糖,使氨基与羰基物质的量比为1∶3,混匀,pH=11,110℃下油浴回流,反应结束后快速冷却,稀释10倍用于抗氧化试验,壳聚糖-果糖/阿拉伯糖同法操作。MRPs褐变在420nm测定[9]。
1.3.2 紫外可见光谱及荧光光谱扫描
4种体系的MRPs各稀释一定倍数,进行紫外可见光谱和荧光光谱扫描。
1.3.3 单因素试验
在90 ℃、各初始 pH、精氨酸2.2 g、赖氨酸0.25 g,壳聚糖1.053 g,探讨氨基与羰基物质的量比分别为3∶1、2∶1、1∶1、1∶2、1∶3时,MRPs褐变程度;在 90℃、各初始 pH、精氨酸 2.2 g、赖氨酸 0.25 g,壳聚糖1.053 g,氨基与羰基物质的量比分别为 3∶1、2∶1、1∶1、1∶2、1∶3,探讨反应过程 pH 值的变化;在 90 ℃、精氨酸0.03 g、赖氨酸0.025 g,氨基与羰基物质的量比为1∶3、探讨初始 pH 值为 8、9、10、11、12 时,其对MRPs褐变的影响,壳聚糖0.561 3 g,氨基与羰基物质的量比为1∶3,不同醋酸浓度对褐变的影响;在pH=11、精氨酸 0.03 g、赖氨酸 0.1 g,壳聚糖 1.053 g,氨基与羰基物质的量比为 1∶3,探讨 80、90、100、110、120℃时,其对MRPs褐变的影响。
1.4 抗氧化作用
1.4.1 DPPH·的清除作用[10]
分别加入一定体积的MRPs,蒸馏水补至2 mL,加入2 mL 0.04 g/L DPPH无水乙醇溶液,混匀,室温暗处反应20 min,取上清液在517 nm测吸光度,为Ai。无水乙醇代替DPPH无水乙醇溶液,吸光度为Aj;以DPPH无水乙醇溶液+无水乙醇作为参比,吸光度为A0。
DPPH·清除率K=[1-(Ai-Aj)/A0]×100%
1.4.2 HO·的清除作用[11]
1 mL 1.25 mmol/L邻二氮菲乙醇溶液于试管中,加入 0.05、0.1、0.15、0.2、0.25 mL 蒸馏水,pH 7.4 0.2 mol/L磷酸缓冲溶液补至2 mL,混匀,加入1 mL 1.25 mmol/L 硫酸亚铁,1 mL 0.025%H2O2,37℃水浴60 min,536 nm测吸光度,为A损。以蒸馏水代替H2O2,为A未,以MRPs代替损伤管样品溶剂,为A样。
HO·清除率/%=[(A样-A损)/(A未-A损)]×100
1.4.3 总还原力[12]
分别加入一定体积的 MRPs,0.2 mol/L pH 6.6磷酸缓冲液补至1 mL,1%K3Fe(CN)61 mL,混匀,50℃水浴20 min,加入1 mL 10%三氯乙酸,振荡混匀,5 000 r/min离心10 min。取上清液2 mL,加入0.1%FeCl30.5 mL,混匀,静置 10 min,700 nm 测定吸光度,为 A样,以蒸馏水代替 MRPs,同法操作,为A空白。

1.4.4 对 H2O2的清除作用[13]
4 mL 10 mmol/L H2O2于100 mL容量瓶中,分别加入一定体积的MRPs,混匀,定至100 mL,248 nm测吸光度,为 A1,不加 MRPs的 H2O2,为 A0,不加 H2O2的 MRPs,为 A2。
清除率/%={[A0-(A1-A2)]/A0}×100
2 结果与分析
2.1 光谱分析
2.1.1 紫外可见光谱变化
由图1-a和图b可知,MRPs在260~270 nm处均出现吸收峰,强度随加热时间的延长而增加,表明有新物质生成且不断积累。与报道的294 nm有所不同[14],Brands[15]认为,该吸收是美拉德反应高级阶段通过Strecker裂解产生的酮、醛等类无色小分子中间物,为褐色素的形成的前体,其主要为呋喃、吡喃、糠醛及吡啶等及其衍生物。由图1-b可知,330 nm处出现肩峰,可能是糖降解产生的各种小分子发色团通过赖氨酸活性侧链共价结合,此时产物的最大吸收峰是各种发色团最大吸收波长的综合表现,即没有特征性吸收峰。由图1-c和图1-d可知,280 nm处均出现吸收峰,且强度随加热时间的延长而增加,Morales[16]认为是酸性条件下发生了糖的异构化和脱水反应,分别产生羟甲基糠醛和糠醛类美拉德反应标志物。随加热时间的延长,图1-d中在220 nm处出现吸收峰,美拉德反应中220 nm的特征性吸收峰很少有报道,一般认为是小分子有机酸如甲酸、乙酸或Amadori降解生成具有共轭双键且含有C O发色团的邻酮糖类物质等的吸收。4种体系MRPs主要吸收范围在200~400 nm,说明产物主要为中、小分子物质[17],其在可见光区几乎没有吸收。当反应120 min后,各峰强度均接近稳定状态,表明已生成的无色小分子物质之间发生聚合反应,进入终级阶段生成褪色的类黑精类物质,小分子具有一定的消除速率。当消除速率与生成速率接近时,峰强度不变,甚至有所下降,与孙丽平[18]、Hofmann[19]认为的无特征性吸收峰、随波长增加吸光度降低是类黑精的典型表现和Cark[20]提出的“尾巴模式”观点一致,即波长越短,吸光度越大。
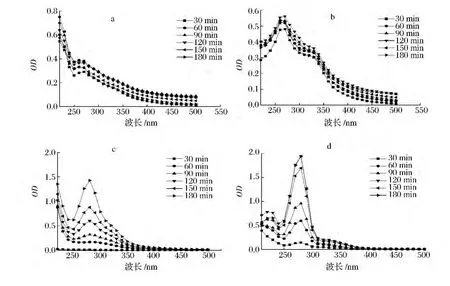
图1 不同加热时间下MRPs的紫外可见光谱变化(a)精氨酸-麦芽糖(b)赖氨酸-麦芽糖(c)壳聚糖-果糖(d)壳聚糖-阿拉伯糖Fig.1 The change of ultraviolet-visible spectrum with different heating time(a)arginine-maltose(b)lysine-maltose(c)chitosan-fructose(d)chitosan-arabinose
2.1.2 荧光光谱变化
精氨酸/赖氨酸-麦芽糖体系的激发波长分别为330和335 nm,发射波长为417和420 nm,壳聚糖-果糖/阿拉伯糖的激发波长分别为330和319 nm,发射波长为423和385 nm。385 nm处的发射波长与MRPs的荧光特征有所不同[21]。荧光物质是美拉德反应高级阶段的小分子物质,可灵敏地反映其早期过程,其强度代表高级阶段荧光物质的生成情况。如图2-a和图2-b所示,当反应进行一定时间后,荧光物质开始积累,达到最大值后开始降低,表明美拉德反应开始进入终极阶段,Jing认为[22],此时荧光物质聚合形成类黑精类物质的速率大于其自身生成速率,荧光物质的积累越来越少,因而荧光强度的增长较为缓慢,但这是以产生风味为目的美拉德反应所不期望的。赖氨酸-麦芽糖体系的荧光强度强于精氨酸-麦芽糖体系,可能是赖氨酸的空间位阻相对小于精氨酸[23],反应易向高级阶段进行,美拉德反应程度也越高。由图2-c和图2-d可知,精氨酸/赖氨酸-麦芽糖体系的最大发射波长未随时间的延长而变化,但壳聚糖-果糖/阿拉伯糖体系的最大发射波长随加热时间的延长发生变化,这表明长时间加热使该体系的一些荧光中间物聚合成化学结构更为复杂的荧光物质,或者是具有新化学结构的荧光物质生成,原来荧光物质被消耗而不再占优势,与张严[24]研究一致。Lertittikul[25]研究表明,美拉德反应体系中荧光光谱与紫外光谱表现为不同的动力学行为,因此荧光小分子物质不同于2.1.1中260~270 nm紫外吸收的小分子物质,但它们均为美拉德反应的中间产物。
2.3 单因素试验结果
2.2.1 氨基与羰基物质的量比对褐变的影响
由图3-a和图3-b可知,随加热时间的不断延长,精氨酸/赖氨酸-麦芽糖体系褐变程度均逐渐增加,氨基与羰基物质的量比越低,褐变程度越高,这说明糖浓度的相对增加能促进美拉德反应,同时氨基的增多易使分子内氨基和羧基失水形成内酰胺而降低了参与美拉德反应的氨基的物质的量,使褐变速率降低[26],此时,只有增大羰基的相对物质的量,才有可能使羰氨反应占据优势,分子内成酰胺作用降至最低,故当氨基与羰基物质的量比从 3∶1、2∶1、1∶1、1∶2降至1∶3时,褐变程度逐渐达到最强。由图3-c和图3-d可知,壳聚糖-果糖/阿拉伯糖体系的褐变均存在较长时间的延滞期,原因可能是壳聚糖含有大量氨基,从而溶于酸性溶液中,因此体系的酸度较大,不利于美拉德反应的进行。一般而言,对于不同的糖类,五碳糖褐变速率高于六碳糖,醛糖比酮糖易于发生反应,碳链较短或空间位阻效应小者,反应活性相对大一些[27]。另外,Kim[28]认为果糖与其它还原糖不同,其参与的氨基酸-还原糖模式反应所产生的褐变,部分原因是由焦糖反应引起的。

图2 不同加热时间下MRPs的荧光光谱变化Fig.2 The change of fluorescence spectrum with different heating time

图3 氨基与羰基物质的量比对褐变的影响Fig.3 The effects of amount of substance ratio of amino to carbonyl group on browning
2.2.2 反应过程pH值变化MRPs的pH值变化趋势与氨基酸和还原糖的种类有关。由图4-a和图4-b可知,反应初始时溶液为碱性,随加热时间的延长,pH值逐渐下降,原因是反应初始时,体系pH分别取决于精氨酸和赖氨酸,其均为碱性氨基酸,随后发生羰氨反应,使氨基被封闭[29],Rufian-Henares 及 Liu[30-31]认为,还原糖在高pH值条件下加热,易降解生成甲酸和乙酸等酸性化合物,从而pH值下降,这与 Lertittikul[25]等研究基本一致。由于羰氨缩合反应为可逆过程,当反应进行至420 min后,存在两种情况:当氨基与羰基物质的量比>1时,2种体系pH或维持在碱性环境而趋于平稳或缓慢下降;当氨基与羰基物质的量比<1时,pH值降至酸性范围,说明此时羰氨缩合的可逆反应并不占据优势。由图4-c和图4-d可知,壳聚糖-果糖/阿拉伯糖体系的吸光值变化不大,且无一定规律,与王惠英等研究一致[32],这说明美拉德反应产物及其中间产物比较复杂,可能是中间产物发生重排所致,同时酸性条件不利于美拉德反应,从而使吸光值发生漂移。这种pH的相对稳定性对开发食品抗氧化剂是相当有利的[33]。

图4 反应过程pH变化Fig.4 pH change of reaction process
2.2.3 初始pH值及醋酸浓度对褐变的影响
一般认为,pH≤7,糖易发生异构化和脱水反应,美拉德反应主要产物为糠醛(戊糖参与反应)或羟甲基糠醛(己糖参与反应)。pH>7时,Amadori重排产生还原酮和丙酮醇、丙酮醛和双乙酰等。由图5-a和图5-b可知,初始pH值越高,反应速率越快,褐变程度越深,原因是碱性条件下,1,2-烯醇化较为困难,2,3-烯醇化较易进行,同时,反醇醛、烯醇化和脱水反应等均为碱催化作用的结果[34]。由图5-c和图5-d可知,在0~60 min范围内,吸光值较低,这是因为在醋酸溶液中,壳聚糖氨基被质子化,由于正电荷的吸引,电子发生离域,1,2-烯醇化较易生成,而糖胺不能形成。同时,羰氨缩合反应为可逆反应,酸性条件下易水解,不利于美拉德反应而被抑制。但随加热时间的延长,2种体系褐变程度均明显加深。
2.2.4 温度对褐变的影响
温度是影响美拉德反应的一个重要因素。随温度的升高,氨基和羰基的反应活性增加,美拉德反应速率加快,在不同加热时间下褐变程度均逐渐增加,这是因为高温条件下开链式还原糖及非质子化氨基含量增加,有利于美拉德反应的发生[35]。由图6-a和图6-b可知,当温度增至110℃时,达到最大褐变,继续增加温度,褐变程度下降,说明过高温度不利于MRPs的稳定。由图6-c可知,随温度升高,壳聚糖-果糖体系的褐变程度逐渐增加,当温度增至100℃后,褐变程度下降。由图6-d可知,壳聚糖-阿拉伯糖体系的褐变逐渐增加并趋于平稳。Lan[36]研究表明,在80~120℃范围内,褐变速率随温度的升高而加快,超过120℃后,褐变速率趋于平缓。

图5 初始pH及醋酸浓度对褐变的影响Fig.5 The effects of initial pHand acetic acid concentration on browning

图6 温度对褐变程度的影响Fig.6 The effects of temperature on browning
2.3 抗氧化试验结果
在反应体系总体积不变的条件下,随MRPs体积的增大,可认为其浓度也相应增大。DPPH·是一种相对稳定的自由基,可与MRPs提供的氢原子结合形成稳定的DPPH-H顺磁分子,从而达到清除自由基的目的。由图7-a和图7-b可知,随MRPs浓度的增加,精氨酸/赖氨酸-麦芽糖体系对DPPH自由基的清除作用降低,这可能是早期生成的具有抗氧化作用的MRPs 被热分解造成的[37],与 Morales[38]认 为 的,MRPs抗氧化能力并不完全依赖于其褐变程度的研究结论一致。壳聚糖-果糖/阿拉伯糖体系对DPPH·的清除作用与其浓度呈正相关,且清除作用均较强,原因可能是美拉德反应过程中产生大量独特结构的杂环化合物,如噻吩、噻唑、吡咯等,其具有芳香性,电子非定域分布在环上,使碳原子上电子过剩,有利于自由基的亲电加成,从而清除自由基。另外,MRPs的部分属性如疏水性,也可能是影响DPPH·清除能力的因素[39]。

图7 MRPs对DPPH·(a、b)、HO·(c、d)和H2O2(e、f)的清除作用和总还原力(g、h)Fig.7 The scavenging action of MRPs on DPPH(a),hydroxyl free radical(b),total reducing power(c)and H2O2(d)
由图7-a、图7-d可知,精氨酸/赖氨酸-麦芽糖体系对羟自由基清除作用几乎均不随浓度的增加而变化,且前者强于后者,可能是随反应的进行,MRPs将部分Fe3+还原为Fe2+后,又被Fe2+螯合,使Fenton反应自身受到抑制,从而清除·OH能力保持不变[40-41]。壳聚糖-果糖/阿拉伯糖体系则随其浓度的增加,对羟自由基清除作用增强,这可能是壳聚糖衍生物通过吡喃环上的-OH或-NH2进行氢原子转移来达到清除羟自由基[42],另外,Silvan[43-44]认为生成的类黑精和还原酮提供的羟基也可以通过链的断裂来表现抗氧化作用。
MRPs的大分子物质和中间产物如吡咯酮、还原酮类、脱氧果糖嗪等具有供氢能力,可提供电子作为还原性物质,将Fe3+还原成Fe2+,Fe2+进一步发生普鲁士蓝反应[39]。由图7-a和图7-f可知,随MRPs浓度的增大,精氨酸/赖氨酸-麦芽糖体系的总还原力逐渐增强,可能是MRPs中的大分子结构上具有羟基或具有还原能力的发色团所致,但壳聚糖-果糖/阿拉伯糖体系的总还原力先增大后减小,可能是还原性物质首先形成于反应初期Amadori产物的热解,Charurin[45-46]认为随反应时间的延长和加热,美拉德反应或焦糖化过程中所产生的杂环化合物开始分解,分子发生重排,从而使还原能力趋于平缓、甚至降低。
由图7-g和图7-h可知,4种体系均表现出较好的H2O2清除作用,且均随MRPs浓度的增加而增强。
3 结论
本试验对精氨酸/赖氨酸-果糖、壳聚糖-果糖/阿拉伯糖模式体系的美拉德反应进行了研究。结果表明随加热时间的延长,前者褐变程度和酸度均逐渐增加,后者的褐变均增加,但酸度变化无规律。各体系氨基与羰基物质的量比为1∶2~1∶3、pH 11~12和110~120℃时,褐变程度分别接近最大程度。随各体系MRPs浓度的增加,前者对DPPH自由基清除率逐渐降低,后者则逐渐增强,说明其抗氧化能力并不完全依赖于MRPs的褐变程度;对羟自由基清除作用,前者几乎保持不变,后者则逐渐增强;前者总还原力及对H2O2的清除作用均逐渐增强,后者则总还原力先增加后降低,对H2O2的清除作用逐渐增强。这说明不同的反应体系和反应条件产生的MRPs具有不同的抗氧化性能[47]。由于MRPs并非单一物质,体系十分复杂,既有低分子质量化合物,也有类黑精类高分子物质,故单一波长难以真正反映其真实颜色,最好用色差计测定体系颜色变化,同时辅助荧光光度法才能全面准确地反映MRPs不同阶段产物的色泽[48]。因此,MRPs作为抗氧化剂的商业应用还有待于进一步研究。
[1]孙涛,朱云,谢晶,等.低聚壳聚糖与α-丙氨酸/天冬酰胺的美拉德反应及其衍生物的抗氧化性能研究[J].天然产物研究与开发,2012,24(4):450-453.
[2]LI B,CHEN F,WANG X,et al.Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chemistry,2007,102(4),1 135-1 143.
[3]龚巧玲,张建友,刘书来,等.食品中的美拉德反应及其影响[J].食品工业科技,2009,30(2):330-334.
[4]孙涛,朱云,王燕萍,等.低聚壳聚糖的美拉德反应及其衍生物的抗氧化性能研究[J].海洋科学,2012,36(5):65-70.
[5]赵喜荣.壳聚糖与葡萄糖发生美拉德反应的条件及产物的抗氧化性能[J].食品科学,2004,25(6):61-63.
[6]Wagner K H,Derkits S,Herr M,et al.Antioxidative potential of melanoidins isolated from a roasted glucose-glycine model[J].Food Chemistry,2002,78:375-382.
[7]郑文华,许旭.美拉德反应的研究进展[J].化学进展,2005,17(1):122-129.
[8]邵澜媛,周建伟,刘东红.食品中美拉德反应机理及动力学模型的研究进展[J].中国食品学报,2012,12(12):103-112.
[9]Morales F J,Jiménez-Pérez S.Free radical scavenging capacity of maillard reaction products as related to colour and fluorescence[J].Food Chemistry,2001,72(1):119-125.
[10]贾俊强,马海乐,曲文娟,等.超声预处理大米蛋白制备抗氧化肽[J].农业工程学报,2008,24(8):288-293.
[11]牛慧慧,马美湖,杨昆.蛋清肽的抗氧化稳定性与功能特性[J].食品科学,2011,32(15):139-143.
[12]李菁,刘骞,孔保华,等.L-赖氨酸与3种还原糖美拉德反应产物的理化特性及抗氧化活性[J].食品科学,2013,34(3):80-85.
[13]郭丽萍,王凤舞,刘翠翠.木糖与甘氨酸美拉德反应产物抗氧化性能的研究[J].食品工业科技,2012,33(7):79-81.
[14]孙丽平.美拉德反应体系的光谱特性、抗氧化活性及评价方法[D].青岛:中国海洋大学,2009.
[15]Brands C M,Alink G M,Van boekel M A,et al.Mutagenicity of heated sugar-casein systems:effect of the maillard reaction[J].Journal of Agricultural and Food Chemistry,2000,48(6):2 271-2 275.
[16]Morales F J,Romero C,Jiménez-Pérez S.Chromatographic determination of bound Hydroxymethylfurfural as an index of milk protein glycosylation[J].Journal of Agricultural and Food Chemistry,1997,45(5):1 570-1 573.
[17]张晓溪,曾艳,张泽生,等.果糖与氨基酸美拉德反应产物的抗氧化性研究[J].食品工业科技,2011,32(6):175-178.
[18]孙丽平,庄永亮,张莉,等.酶解小麦蛋白产物-还原糖美拉德反应的光谱研究[J].分析化学,2009,37(9):1 359-1 362.
[19]Hofmann T.Studies on the relationship between molecular weight and the color potency of fractions obtained by ther-mal treatment of glucose/amino acid and glucose/protein solutions by using ultracentrifugation and color dilution techniques[J].Journal of Agricultural and Food Chemistry,1998,46(10):3 891-3 895.
[20]Clark A V,Tannenbaum S R.Isolation and characterization of pigments from rotein-carbonyl browning systems.Models for two insulin-glucose pigments[J].Journal of Agricultural and Food Chemistry,1974,22(6):1 089-1 093.
[21]刘平.美拉德肽的形成机理及功能特性研究[D].无锡:江南大学,2012:42-43.
[22]Jing H.,Kitts D.D.Antioxidant activity of sugar-lysine Maillard reaction products in cell free and cell culture systems[J].Archives of Biochemistry and Biophysics,2004,429(2):154-163.
[23]孙炜炜,于淑娟,杨晓泉,等.乳清分离蛋白-葡聚糖接枝物性质的荧光光谱法分析[J].光谱学与光谱分析,2011,31(12):3 307-3 310.
[24]张严,汪何雅,钱和.美拉德反应产物的褐变、荧光吸收及抗氧化性的研究[J].食品工业科技,2012,33(6):193-196.
[25]Lertittikul W.,Benjakul S.,Tanaka M.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J].Food Chemistry,2007,100(2):669-677.
[26]赵晶,张宏坤,马丹雅,等.葡萄糖与赖氨酸美拉德反应产物的抗氧化性研究[J].食品工业科技,2013,34(11):92-95.
[27]吴惠玲,王志强,韩春,等.影响美拉德反应的几种因素研究[J].现代食品科技,2010,26(5):441-444.
[28]Kim J.S.,Lee Y.S.Effects of reaction pH on enolization and racemization reactions of glucose and fructose on heating with amino acid enantiomers and formation of melanoidins as result of the Maillard reaction[J].Food Chemistry,2008,108(2):582-592.
[29]王惠英,孙涛,周冬香,等.L-赖氨酸与葡萄糖美拉德反应及其产物的抗氧化性能研究[J].食品与发酵工业,2007,33(9):54-56.
[30]Rufian-Henares J A,Delgado-Andrade C,Morales F.J.Occurrence of acetic acid and formic acid in breakfast cereals[J].Journal of the Science of Food and Agriculture,2009,86(9):1 321-1 327.
[31]LIU S C,YANG D J,JIN S Y,et al.Kinetics of color development,pH decreasing,and anti-oxidative activity reduction of Maillard reaction in galactose/glycine model systems[J].Food Chemistry,2008,108(2):533-541.
[32]王惠英,孙涛,周冬香,等.壳聚糖的美拉德反应及其产物的抗氧化性能研究[J].食品工业科技,2007,28(10):91-93.
[33]童彦,雒莎莎,应铁进.鱼蛋白水解液美拉德反应条件优化及反应前后氨基酸组成变化[J].中国食品学报,2011,11(8):101-106.
[34]Shibamoto T,Bernhard R A.Investigation of pyrazine formation pathways in sugar-ammonia model systems[J].Agricultural and Food Chemistry,25(3):609.
[35]李伶俐.美拉德反应体系中影响烤肉风味形成的因素研究[D].无锡:江南大学,2011:17.
[36]LAN X H,LIU P,XIA S Q,et al.Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system:Further insights into thermal degradation and cross-linking[J].Food Chemsistry,2010,120(4):967-972.
[37]邹利,赵妍嫣,朱坦,等.猪骨粉酶解液的美拉德反应产物清除DPPH·的研究[J].食品工业科技,2013,34(13):79-82.
[38]Morales F J,Jiménez-Pérez S.Free radical scavenging capacity of Maillard reaction products as related to color and fluorescence[J].Food Chemistry,2001,72(1):119-125.
[39]黄梅桂.大豆肽美拉德反应体系中色泽抑制及其机理研究[D].无锡:江南大学,2012:32-33.
[40]夏炳乐,刘永军.生理温度下苯丙氨酸-葡萄糖模式体系Maillard反应的影响因素研究[J].中国科学技术大学学报,2011,41(5):422-427.
[41]徐红萍,余翔,张迎阳,等.美拉德反应改性壳聚糖产物体外抗氧化能力的研究[J].食品工业科技,2013,34(16):150-153.
[42]XIE W M,XU P X,LIU Q.Antioxidant activity of watersoluble chitosan derivatives[J].Bioorganic & Medicinal Chemistry Letters,2001,11(13):1 699-1 701.
[43]Silvan J M,Van de lagemaat J,Olano A,et al.Analysis and biological properties of amino acid derivates formed by Maillard reaction in foods[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(5):1 543-1 551.
[44]王莹莹,许朵霞,焦琼,等.天然防腐剂美拉德反应改性研究进展[J].食品科学,2013,34(7):296-301.
[45]Charurin P,Ames J M,Castillo M D.Antioxidant activity of coffee model systems[J].Journal of Agricultural and Food Chemistry,2002,50(13):3 751-3 756.
[46]赵晶,马丹雅,张筠,等.酪蛋白与还原糖美拉德反应产物抗氧化性的研究[J].食品工业科技,2011,32(12):187-189.
[47]张凌燕,李倩,尹姿.3种氨基酸和葡萄糖美拉德产物的物理化学特性及抗氧化活性的研究[J].中国食品学报,2008,8(3):12-22.
[48]沈军卫,樊金玲,朱文学,等.模式美拉德反应物的抗氧化性与反应进程的关系研究[J].食品科技,2010,35(3):253-257.
