发酵面团中抗单增李斯特氏菌乳酸菌的筛选及鉴定*
2014-12-16李东霞王雁萍李宗伟袁世超杨慧晓金庆生
李东霞,王雁萍,李宗伟,袁世超,杨慧晓,金庆生
1(郑州大学离子束生物工程省重点实验室,河南郑州,450052)2(浙江省农业科学院作物与核技术利用研究所,浙江杭州,310021)
单增李斯特氏菌是一种威胁人畜健康的重要病原菌;该菌在自然界分布广泛,在土壤、污水、粪便、动物饲料中均有存在,且动物很容易摄入该菌,并且通过摄入和排泄的途径到处传播[1]。近年来,在某些食品如乳制品,肉制品以及即食用型蔬菜中该菌检出率很高,因食品污染李斯特氏菌而引起的食物中毒,脑膜炎及败血症病例也频繁发生。采取有效的措施控制单增李斯特氏菌在食品中的污染,消除其对食品安全及人类健康造成的威胁已经引起世界各国的重视[2-3]。
近年来,一些学者发现应用食品级乳酸菌产生的细菌素是抑制单增李斯特氏菌的一种有效方法[4]。乳酸菌(lactic acid bacteria,LAB)是发酵糖类主要产物为乳酸的革兰氏染色阳性细菌,其具有拮抗肠道内病原菌的作用,可通过产生有机酸、过氧化氢和细菌素等多种代谢产物,抑制食品中的腐败菌和病原菌;现已被广泛应用于食品加工、医药保健、饲料发酵及畜禽疾病防治等方面。乳酸菌细菌素(Bacteriocins of LAB)是指乳酸菌在代谢过程中通过核糖体合成的对革兰氏阳性菌有抑制作用的多肽或蛋白质类物质。由于食品病原菌和滥用抗生素危害的加剧,人们开始寻找天然安全的食品添加剂,细菌素以其无毒性、易被消化道内酶降解等特性,被公认为具有应用于食品和饲料中杀菌防腐的潜力[5-6]。
我国乳酸菌资源丰富,如何有效地开发利用现有的乳酸菌资源尤为重要。现在,一些学者开始重视研究来自传统食品中的优良乳酸菌菌株[7]。发酵面食是我国传统食品之一,我国传统发酵面食采用的“面引子”由于其自然发酵产生的多种芳香物质能够赋予面食特殊的风味,也是发酵面食所用菌种的主要来源。在不同地区的发酵面团中,真菌主要以酵母菌(Saccharomyces cerevisiae)为主,细菌主要以乳酸菌(lactic acid bacteria)为主[8-9];但是目前关于发酵面团来源的乳酸菌及其抑菌活性的研究较少。
本研究以普通发酵面团为乳酸菌分离源,并从中筛选到一株对单增李斯特氏菌有较强抑制作用的乳酸菌,经鉴定该菌为Lactobacillus curvatus,为其在食品和饲料中进一步深入研究和应用奠定基础。
1 实验材料
1.1 实验菌株
乳酸菌菌株共54株,分离自河南开封,商丘,天津,黑龙江大兴安岭呼玛县四地区家庭普通发酵面团样品,根据形态学特征初定为乳酸菌;指示菌为单增李斯特氏菌(Listeria monocytogenes,ATCC BAA-751),保存于本实验室。
1.2 试剂及培养基
过氧化氢酶,胰蛋白酶,蛋白酶K,菌株DNA提取试剂盒,MRS培养基,NA培养基。
2 实验方法
2.1 抗单增李斯特氏菌乳酸菌的初筛
将保存于-80℃冰箱中的54株乳酸菌活化后,接种到MRS液体培养基,30℃培养24 h。制备乳酸菌无细胞发酵上清液,制备指示菌菌悬液,采用牛津杯双层平板法进行抑菌试验[10]。
2.2 产抗单增李斯特氏菌细菌素乳酸菌的复筛
2.2.1 酸作用的排除
挑取对单增李斯特氏菌有抑制作用的菌株,制备无细胞发酵上清液,测上清液的pH值,用2 mol/L NaOH调发酵上清液pH值至7.0,用牛津杯双层平板法做抑菌试验。
2.2.2 过氧化氢酶作用的排除
将酸排出后依然有抑菌作用的乳酸菌菌株无细胞发酵上清液pH调至7.0,按照过氧化氢酶终浓度为1.0 mg/mL加入到发酵液中,37℃水浴2h,检测其抑菌活性。
2.2.3 蛋白酶解检测
挑取筛选出的乳酸菌制备无细胞发酵上清液,调发酵上清液pH至7.0,按100μg/mL加入胰蛋白酶和蛋白酶K,同上处理。
2.3 乳酸菌细菌素初步分析
2.3.1 热敏感性
将筛选出的菌株无细胞发酵上清液pH调至7.0后分别置60℃,80℃,100℃水浴锅30 min和60 min,121℃灭菌锅15 min;冷却后进行抑菌实验。
2.3.2 pH 敏感性
用2 mol/L HCL和2 mol/L NaOH调无细胞发酵上清液 pH 值分别为 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0,37 ℃温育2 h 后,进行抑菌试验。
2.3.3 共培养性质
将乳酸菌上清液和单核增生李斯特菌进行试管混合共同培养,在NA液体培养基内按照5∶2的体积比例接入乳酸菌无细胞发酵上清液,再加入100μl培养24h的单增李斯特氏菌菌液;每4 h取样,测定600 nm条件下的光密度值;以NA液体培养基接入MRS液体培养基,再加入同上单增李斯特氏菌菌液为对照。以共培养时间为横坐标,光密度值为纵坐标,绘制乳酸菌上清液与单核增生李斯特菌共培养的曲线图。
2.3.3 细菌素分子量的测定
乳酸菌菌株无细胞发酵上清液经70%饱和度硫酸铵盐析、透析及超滤浓缩处理,将依然保留较强抑菌活性的纯化液采用Tricine-SDS-PAGE[11]方法测定细菌素分子量。
2.4 产细菌素乳酸菌的鉴定
根据乳酸菌生理生化特性以及16S rDNA的遗传学鉴定[12]。
3 结果
3.1 初筛结果
对实验室保存的从发酵面团中分离出的54株乳酸菌进行抑菌试验,发现有43株对单增李斯特氏菌有较强的抑制作用。挑选这43株菌进一步筛选产抗单增李斯特氏菌细菌素的乳酸菌。
3.2 复筛结果
43株乳酸菌中只有编号为ZZU M5-2的菌株在酸排除及过氧化氢排除后仍然有抑菌活性。如表1及图1所示,在pH调至7.0后,菌株ZZU M5-2的上清液与原液相比抑菌作用有所减弱,但依然保留非常明显的抑菌活性;由此推测其发酵上清液中存在除有机酸以外的其他抑菌活性物质。乳酸菌在生长代谢过程中可能产生过氧化氢抑制其他细菌的生长,因此实验将ZZU M5-2菌株发酵上清液pH调至7.0后加过氧化氢酶处理,结果显示其抑菌圈直径较酸排除处理的差别不大,这说明该菌株发酵上清液主要抑菌活性物质不是过氧化氢。

表1 ZZU M5-2的抑菌效果Table 1 Antimicrobial activity of ZZU M5-2
将菌株ZZU M5-2的发酵上清液进行胰蛋白酶和蛋白酶K的酶解实验,发现在加入胰蛋白酶或蛋白酶K后其抑菌活性完全消失,如图1所示,说明菌株ZZU M5-2发酵上清液中存在的主要抑菌活性物质是蛋白类物质,是一类细菌素。

图1 ZZU M5-2的抑菌效果Fig.1 Antimicrobial activity of ZZU M5-2
3.3 细菌素初步分析
3.3.1 细菌素对热的稳定性
将pH值调至7.0的乳酸菌无细胞发酵上清液分别在60、80、100 ℃处理30和60 min,121 ℃15 min后做抑菌试验,结果如表1所示,其在60和80℃热处理后抑菌活性基本保持不变,表现出良好的热稳定性,且加热时间对其影响不大;但随着温度的继续升高,加热时间延长,其抑菌活性逐渐降低,甚至在121℃时完全消失。
3.3.2 细菌素对pH的稳定性
从表1可以看出,菌株M5-2产生的细菌素在pH 2.0~8.0范围内,对单增李斯特氏菌有抑制作用;且其抑菌活性随着pH值的减小而增大,当pH 9.0时,抑菌活性消失。这说明该菌株产生的细菌素在酸性及中性环境中可以很好地发挥抑菌作用。
3.3.3 共培养性质
由图2可知,在培养8h之前加入ZZU M5-2发酵上清液与对照相同对单增李斯特氏菌的生长没有明显影响,在8h后可以看出2种处理的单增李斯特氏菌都进入了对数生长期,但是加入ZZU M5-2发酵上清液的处理与对照相比生长缓慢,且随着时间的延长这种趋势越来越明显,并在24h时比对照提前进入稳定期;这进一步说明ZZU M5-2发酵上清液中抑菌物质可以明显抑制单增李斯特氏菌的生长。

图2 ZZU M5-2发酵上清液对单核细胞增生李斯特菌的抑制作用Fig.2 The inhibition of ZZU M5-2 towards L.monocytogenes
3.3.4 细菌素分子质量的测定
将分离纯化的细菌素样品经过Tricine-SDSPAGE电泳分析,所得电泳图谱见图3,ZZUM5-2产生的细菌素分子质量约为25 kDa。

图3 ZZU M5-2产细菌素的电泳图谱Fig.3 Tricine-SDS-PAGE of bacteriocin produced by ZZU M5-2
3.4 产细菌素乳酸菌的鉴定
3.4.1 菌落形态
菌落呈圆形,半透明,表面光滑,边缘整齐。
3.4.2 菌株的形态及生理生化特性
由表2可以看出菌株ZZU M5-2可以耐受10℃低温,而在45、50℃高温及5℃低温条件下生长能力微弱;在 pH 4.0~9.0可以生长良好;可以耐受 3.5%的盐浓度。

表2 菌株形态及生理生化特性鉴定结果Table 2 The results of strain shape and microbiological identification
3.4.3 16S rDNA 序列分析
将测得的16S rDNA序列与通过Blast在Gen-Bank中检测得到的标准菌株序列信息用CLUSTAL W软件比对。采用邻接法构建进化树(neighbor-joining method)如图3所示,枯草芽孢杆菌Bacillus subtilis被用作外围菌株。
结合生理生化试验及16S rDNA序列结果分析,ZZU M5-2被鉴定为Lactobacilluscurvatus.
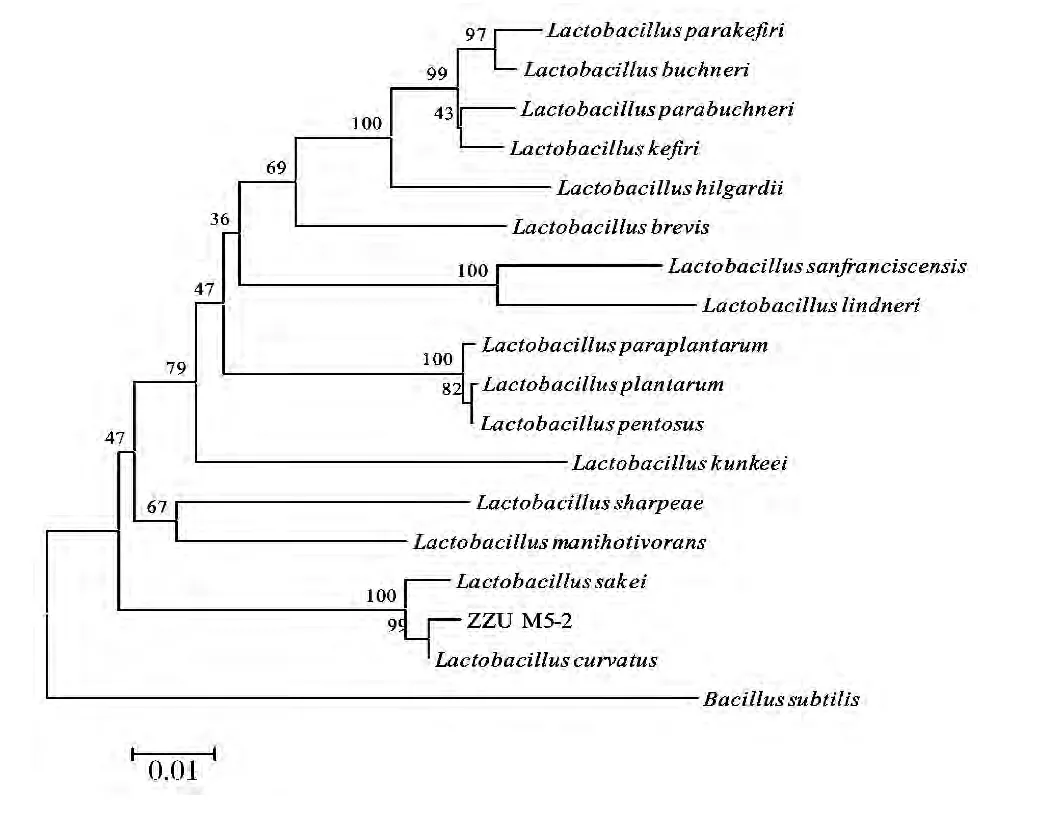
图3 ZZU M5-2的16S rDNA序列系统进化树Fig.3 Phylogenetic tree of strain ZZU M5-2 based on 16S rDNA sequence
4 讨论
实验从发酵面团来源的乳酸菌中筛选到1株对单增李斯特氏菌有较强抑制作用的菌株ZZU M5-2,该菌株无细胞发酵上清液在经过酸排除及过氧化氢排除后依然有很强的抑菌活性,但这种抑菌活性在蛋白酶处理后消失,这与前人报道的细菌素情况一致[13],因此推断该菌株产生的能够抑菌活性物质主要为细菌素。
乳酸菌种类繁多,不同的菌株产生的细菌素性质也不尽相同,S.Oh等人的实验菌株Lactobacillus acidophilus 30SC所产生的细菌素在121℃处理20 min仍然保持50%的抑菌活性[14],Yurong Gao等人从中国传统发酵蔬菜中分离到的Lactobacillussake C2产生的细菌素sakacin C2在121℃处理20 min后仍然对Staphylococcus aureus ATCC 63589有80.9%的抑菌活性;本实验筛选到的ZZU M5-2产生的细菌素在60和80℃热处理后能保持稳定的抑菌活性,但在100℃时活性明显下降,并在121℃活性完全消失;推测原因可能是本实验筛选出的乳酸菌所产细菌素是蛋白质类细菌素,对热敏感,在高温条件下空间结构容易发生变化,从而失活导致抑菌活性降低;这类细菌素物质其分子质量较大(>10kDa)[15],在食品生产中常用的巴斯德灭菌温度为62~65℃,时间为30 min,这对菌株ZZU M5-2产生的细菌素保持良好的抑菌活性没有影响,因此其在食品加工中有良好的应用前景。
XIE等人从马奶酒中分离到Lactobacillus plantarum LB-B1所产的细菌素在pH 2.0~8.0对Listeria monocytogenes保持稳定的抑菌活性,在pH为10.0时抑菌活性略有下降[16]。与之相似,本实验筛选到的ZZU M5-2产生的细菌素在pH 2.0~8.0范围内均有明显的抑菌活性,但在pH 9.0时抑菌活性消失;其抑菌活性随着pH值的减小而增强,且在pH 2.0时抑菌活性最大,这可能是因为过酸的原因,研究表明,单增李斯特氏菌不能在此pH下生长[2]。
将ZZU M5-2发酵上清液与单增李斯特氏菌共培养实验结果进一步表明ZZU M5-2菌株发酵上清液中存在能抑制单增李斯特氏菌生长的活性物质,这与宁佳的实验结果类似[2],其在单增李斯特氏菌的对数早期加入乳酸片球菌P9发酵液虽然不能完全杀死指示菌,但可以明显抑制生长。
本实验测定出菌株ZZU M5-2所产细菌素分子量为25kDa,与前面推测结果相一致,进一步证实其细菌素类型为大分子蛋白质类细菌素。
在不同地区的发酵面团中,细菌的组成差别较大。其中河南地区以Lactobacillus为优势菌,所占比例达40.704%[9],与之相一致,本实验从开封地区发酵面团样品中分离出的产细菌素菌株ZZU M5-2鉴定为Lactobacillus curvatus,其所产细菌素的分离纯化及作用机理等有待进一步研究。
[1]何浩,吴永生,于霞.产单核细胞增生性李斯特氏菌研究现状[J].肉品卫生,2003(7):9-16.
[2]宁佳.具有抑制单核细胞增生李斯特菌的乳酸菌的筛选及抑菌性质的研究[D].无锡:江南大学,2012:18-21.
[3]于丰宇.食品中单核细胞增生李斯特氏菌的毒力研究[D].重庆:重庆大学,2011:11.
[4]Hartmann H A,Wilke T,Erdmann R.Efficacy of bacteriocin-containing cell-free culture supernatants from lactic acid bacteria to control Listeria monocytogenes in food[J].International Journal of Food Microbiology,2011,146(2):192-199.
[5]韩雪,李研东,王颖.产细菌素乳酸菌的分离与筛选[J].中国饲料,2011(7):31-32.
[6]张艾青,刘书亮,詹莉,等.产广谱细菌素乳酸菌的筛选[J].中国酿造,2007,167(2):45-48.
[7]李青青,陈启和,何国庆,等.我国传统食品中乳酸菌资源的开发[J].食品科学,2009,30(23):516-520.
[8]李晓红.自然发酵面团中乳酸菌菌株的分离与鉴定[J].保鲜与加工,2013,13(4):45-47.
[9]张国华,何国庆.我国不同地区发酵酸面团的菌群组成及差异研究[C].北京:中国食品科学技术学会第八届年会暨第六届东西方食品业高层论坛,2011-11-3.
[10]石金舟.产细菌素乳酸菌的筛选鉴定和细菌素发酵条件的研究[D].合肥:安徽农业大学,2005:9-10.
[11]张锐昌,王琦,张应龙,等.Tricine-SDS-PAGE测定小麦蛋白酶解物分子量分布[J].食品研究与开发,2012,33(12):168-171.
[12]PANG H,ZHANG M,QIN G,et al.Identification of lactic acid bacteria isolated fromcorn stovers[J].Animal Science Journal,2011,82(5):642-653.
[13]GAO Y,JIA S,GAO Q,et al.A novel bacteriocin with a broad inhibitory spectrum produced by Lactobacillus sake C2,isolated from traditional Chinese fermented cabbage[J].Food Control,2010,21(1):76-81.
[14]Oh S,Kim S H,Worobo R W.Characterization and purification of a bacteriocin produced by apotential probiotic culture,Lactobacillus acidophilus 30SC[J].Journal of Dairy Science,2000,83(12):2 747-2 752.
[15]宫正,薛平海,颜世发,等.乳酸菌产细菌素研究进展[J].本溪冶金高等专科学校学报,2004,6(2):34-36.
[16]XIE Y,AN H,HAO Y,et al.Characterization of an anti-Listeriabacteriocin produced by Lactobacillus plantarum LB-B1 isolated from koumiss,a traditionally fermenteddairy product from China[J].Food Control,2011,22(7):1 027-1 031.
