响应曲面法优化亚麻籽蛋白提取工艺
2014-12-16徐江波肖江陈元涛张炜郭智军
徐江波,肖江,陈元涛,*,张炜,郭智军
(1.青海师范大学润德亚麻籽工程技术研究中心,青海西宁810008;2.青海师范大学化学系,青海西宁810008)
亚麻(Linum usitatissimum L.),亚麻科、亚麻属的一年生或多年生草本植物[1],主要分布在北美、印度、中国等国家,是世界上最古老的纤维作物,品种较多,已成为世界十大油料作物之一[2-4]。亚麻籽(flaxseed或linseed)是亚麻的种子,含有油脂和蛋白质等营养成分。其中,脂肪占31.9%~37.8%,含有多种脂肪酸,尤其不饱和脂肪酸含量很高;蛋白质占21.9%~31.6%,含有几乎所有种类的氨基酸,且氨基酸的评分较高,具有很高的营养价值[2];另外,亚麻籽中还含有一定量的亚麻籽胶,随品种和栽培区域不同而不同,约占种子质量的2%~10%[5]。诸多文献[6-9]研究表明,油料蛋白质的提取主要有等电点沉淀、离子交换、碱溶酸沉法、反胶束溶液萃取、膜分离、酶法等方法,其中碱溶酸沉法是我国普遍采用的蛋白质提取工艺,该方法能够有效地提高蛋白质的提取率,充分利用蛋白质资源。
响应曲面法(Response Surface Methodology)是利用合理的实验设计并通过对实验数据进行一定的处理,建立影响因素与响应值之间的函数关系,采用多元二次回归方程来拟合影响因素与响应值之间的函数关系,并通过对回归方程的分析来寻求最佳工艺参数,解决多变量问题,由于其精度高,目前在食品工业和天然产物开发研究过程中应用广泛[10-11]。
目前,尽管亚麻籽中含有大量的亚麻籽蛋白,但在我国应用亚麻籽提取亚麻籽蛋白的文献很少,更未见有规模化生产亚麻籽蛋白的报道[12]。这是由于亚麻籽中富含亚麻籽胶,其具有黏性大、吸水性强、乳化效果强等特点[13-15],会造成亚麻籽蛋白在提取过程中乳化、难离心、不易过滤等问题。因此,在对亚麻籽进行蛋白质的提取过程中,应该先对亚麻籽胶进行预处理。本课题组首先采用果胶酶法[16]对亚麻籽进行脱胶预处理,然后粉碎脱脂后采用响应曲面分析法优化亚麻籽蛋白碱溶酸沉的工艺条件,探讨料液比、浸提pH、浸提时间和浸提温度4个因素对亚麻籽蛋白提取率的影响,确定最佳的工艺参数,为亚麻籽蛋白的进一步开发利用及规模化生产提供研究基础。
1 材料与方法
1.1 原料与试剂
亚麻籽:青海润德生物科技有限公司,挑选完整、饱满、无虫害的亚麻籽作为实验原料;果胶酶(酶活力 10000 U/mL):诺维信(中国)生物技术有限公司;盐酸、氢氧化钠、石油醚:北京化学试剂厂;以上试剂及其它化学试剂均为分析纯;蒸馏水:青海师范大学化学实验中心自制。
1.2 仪器与设备
pH计:梅特勒-托利多(上海)仪器有限公司;LXJ-64-01离心机:北京医疗仪器修理厂;分析天平:赛多利斯科学仪器(北京)有限公司;LGJ-22型冷冻干燥机:长沙湘仪离心机仪器有限公司;DHG-9140型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;双层玻璃反应釜:上海申生科技有限公司;K360 BUCHI步琪凯氏定氮仪:广州和竺生物科技有限公司;ZD-2上海雷磁自动电位滴定仪:上海恒磁电子科技有限公司;超级恒温器:上海市实验仪器厂;索氏抽提器:北京欣维尔玻璃仪器有限公司。
1.3 方法
1.3.1 亚麻籽粉基本组成成分测量
水分测定:常压直接干燥法,参照GB 5009.3-2010《食品安全国家标准食品中水分的测定》;蛋白质的测定按照GB/T 5009.5-2010《食品安全国家标准食品中蛋白质的测定》;灰分的测定采用灼烧重量法,按照GB/T 5009.4-2010《食品安全国家标准食品中灰分的测定》;脂肪的测定采用索实提取器,按照GB/T 14772-2008《食品中粗脂肪的测定》;总纤维的测定按照GB/T 5009.10-2003《植物类食品中粗纤维的测定》。
1.3.2 亚麻籽蛋白的制备
1.3.2.1 原料预处理
首先用果胶酶对亚麻籽进行脱胶处理,然后将脱胶干燥后的亚麻籽进行粉碎,并在常温下用石油醚脱脂3次,置于通风橱中12 h以挥发溶剂,得脱脂粉,于冰箱5℃保存备用。脱脂亚麻籽粉中蛋白质含量采用凯式定氮法进行测定。
1.3.2.2 亚麻籽蛋白的制备工艺流程
亚麻籽→果胶酶脱胶→干燥→粉碎(过80目筛)→脱脂→碱溶浸提→离心→等电点沉淀→离心→洗涤→冷冻干燥→亚麻籽蛋白粉
1.3.2.3 亚麻籽蛋白的具体提取步骤[17-18]
称取一定量脱胶脱脂亚麻籽粉与蒸馏水按一定料液比混合,用NaOH调至一定的pH,于一定温度下搅拌浸提30 min,然后在以 4000 r/min离心20 min。沉淀物再重复提取1次,合并2次上清液,用HCl调pH至等电点使蛋白质沉淀,再以4000r/min离心20min,用蒸馏水洗涤沉淀2次,再用NaOH回调至pH为7.0,搅拌使沉淀复溶后进行冷冻干燥,则可得到亚麻籽蛋白粉。
1.3.3 碱溶酸沉提取亚麻籽蛋白试验
1.3.3.1 等电点的确定
称取10.0 g亚麻籽脱脂粉,料液比为1∶20(g/mL),用NaOH调节pH至10.0,控制温度为50℃下搅拌浸提30 min,然后在以 4000 r/min离心20 min。沉淀物再重复提取1次,合并2次上清液,分别取上清液9份各25 mL,加盐酸调节 pH 为 2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5后离心,弃上清液后称重,将上述过程重复一次,绘出沉淀量与pH的曲线关系图,图中沉淀量最大时的pH即为亚麻籽蛋白质的等电点。
1.3.3.2 料液比的确定
分别设定料液比为 1 ∶5、1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30(g/mL),50℃,pH 为 10.0下浸提 90 min,研究料液比对蛋白质提取率的影响,确定最佳的料液比。
1.3.3.3 浸提pH的确定
料液比选择1∶20(g/mL),分别选择浸提pH为8.0、9.0、10.0、11.0、12.0、13.0,温度为 50 ℃下浸提 90 min,研究浸提pH对蛋白质提取率的影响,确定最佳的浸提pH。
1.3.3.4 浸提温度的确定
料液比选择1∶20(g/mL),分别选择浸提温度为20、30、40、50、60、70 ℃,pH 为 10.0 下浸提 90 min,研究浸提温度对蛋白质提取率的影响,确定最佳的浸提温度。
1.3.3.5 浸提时间的确定
料液比选择1∶20(g/mL),分别选择浸提时间为30、50、70、90、110、130 min,在 pH 为 10.0 和温度为50℃下,研究浸提时间对蛋白质提取率的影响,确定最佳的浸提时间。
1.3.4 碱溶酸沉工艺优化试验
依据单因素试验的结果,采用Box-Behnken进行试验设计,以料液比(g/mL)、浸提温度(℃)、浸提pH及浸提时间(min)为影响因素,采用四因素三水平的响应曲面法进行试验,利用Design-Expert8.0.5b软件进行数据的处理和回归分析。分别用A、B、C、D来表示4个影响因素,并用+1、0、-1分别代表变量的水平,亚麻籽蛋白提取率为响应值,试验设计方案[19]见表1。
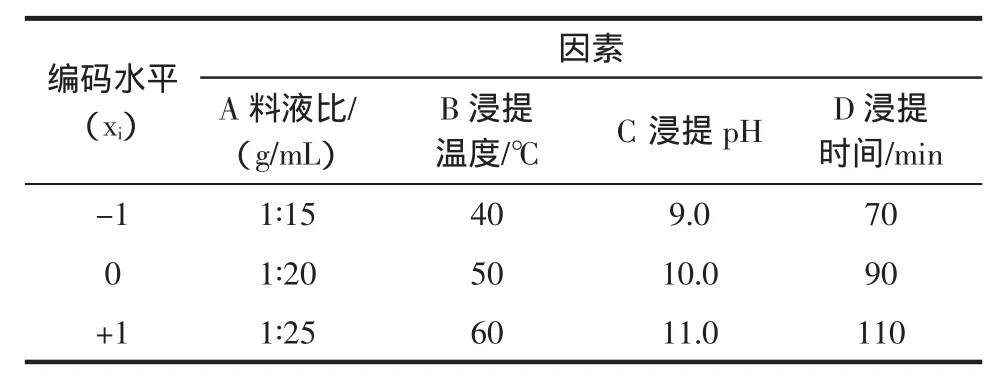
表1 响应面设计实验因素与水平Table 1 Variables and levels in response surface design
1.4 分析方法
1.4.1 亚麻籽粗蛋白含量的测定
凯式定氮法。
1.4.2 亚麻籽蛋白得率的计算
亚麻籽蛋白得率(%)=粗提产物中蛋白质含量/脱脂粉总蛋白质含量×100%
2 结果与讨论
2.1 脱胶脱脂亚麻籽粉基本组分测定结果
对脱胶脱脂后的亚麻籽粉进行成分测定,结果见表2。

表2 亚麻籽粉基本组分Table 2 The basic components of flaxseed meal
2.2 亚麻籽蛋白等电点的测定
碱溶酸沉法提取蛋白质的过程中,加酸至等电点是非常关键的一步。在等电点时,蛋白质的沉淀量会达到最大值,见图1。
从图1中可以看出,当酸沉pH达到4.5时,亚麻籽蛋白的沉淀量最大,故选择酸沉pH为4.5作为亚麻籽蛋白的等电点。
2.3 蛋白质提取单因素试验结果
2.3.1 料液比对蛋白质提取率的影响
按照1.2.2.2方法进行试验,得到料液比对蛋白质提取率的影响试验结果如图2所示。
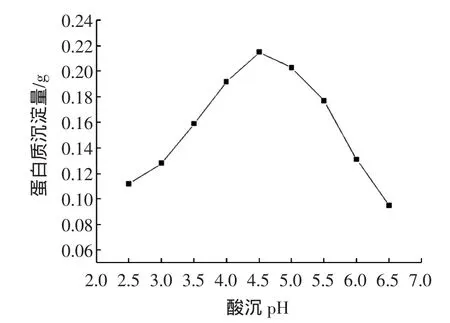
图1 亚麻籽蛋白等电点Fig.1 The isoelectric of flaxseed protein

图2 料液比对蛋白质提取率的影响Fig.2 Relationship between ratio of flaxseed to solution and extraction rate of flaxseed protein
从图2可以看出,蛋白质提取率随着料液比的增大而增加,当料液比增大到1∶20(g/mL)时蛋白质提取率达到最大值,此后随着料液比的增大蛋白质提取率已趋于平衡,没有明显变化。因此,考虑到经济成本及后续实验的处理过程,本实验选择料液比为1∶20(g/mL)作为最佳的料液比参数。
2.3.2 浸提pH对蛋白质提取率的影响
按照1.2.2.3方法进行试验,得到浸提pH对蛋白质提取率的影响试验结果如图3所示。

图3 浸提pH对蛋白质提取率的影响Fig.3 Relationship between extraction pH and extraction rate of flaxseed protein
由图3可以看出,随着浸提pH的升高,亚麻籽蛋白提取率随之增加,在浸提pH=10.0时蛋白质提取率达到最大值。当浸提pH继续增大,蛋白质提取率反而会下降,造成的原因可能是浸提pH太高引起了部分蛋白质变性,使得提取率反而会下降。因此,本实验选择浸提pH=10.0作为最佳的浸提pH。
2.3.3 浸提温度对蛋白质提取率的影响
按照1.2.2.4方法进行试验,得到浸提温度对蛋白质提取率的影响试验结果如图4所示。

图4 浸提温度对蛋白质提取率的影响Fig.4 Relationship between extraction temperature and extraction rate of flaxseed protein
由图4可以看出,浸提温度对亚麻籽蛋白提取率有较大的影响。在20℃~50℃,亚麻籽蛋白提取率随浸提温度的增大而增加,当温度达到50℃时,蛋白质提取率达到最大;当温度继续升高时,蛋白质提取率明显降低,造成该现象的原因是:当温度小于50℃时,随着温度的升高蛋白质的溶解度会随之增大,而浸提温度过高则导致部分蛋白质发生变性,反而不利于提取。因此,本实验选择浸提温度为50℃作为最佳的浸提温度。
2.3.4 浸提时间对蛋白质提取率的影响
按照1.2.2.5方法进行试验,得到浸提时间对蛋白质提取率的影响试验结果如图5所示。
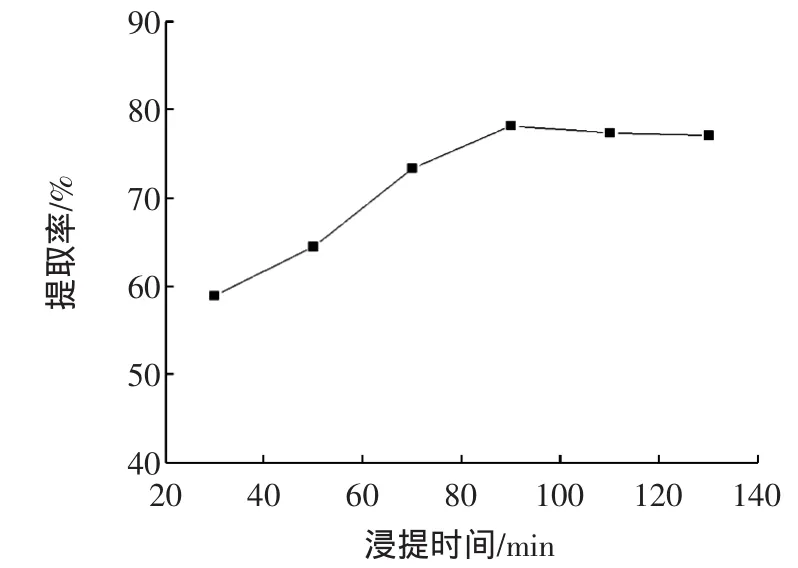
图5 浸提时间对蛋白质提取率的影响Fig.5 Relationship between extraction time and extraction rate of flaxseed protein
由图5可以看出,当浸提时间小于90 min时,亚麻籽蛋白提取率随着浸提时间的增长而提高;当浸提时间大于90 min时,亚麻籽蛋白提取率有缓慢的下降趋势。原因可能是:当提取时间小于90 min时,提取率比较低,这是由于亚麻籽脱脂粉的溶胀需要一定的时间;若时间过长,整个提取过程的平衡会被破坏,可能使部分蛋白质变性,而且浸提时间过长,从经济上考虑会增加生产成本,因此,综合各个因素考虑,本试验选择浸提时间为90 min作为最佳的浸提时间。
2.4 碱溶酸沉提取工艺的优化
2.4.1 试验结果
采用四因素三水平的响应曲面法进行碱溶酸沉提取亚麻籽蛋白工艺的优化,按照1.2.3的设计方案进行试验,结果见表3。

表3 方案设计及响应面法试验结果Table 3 Response surface experimental design and results
2.4.2 模型的建立及显著性检验
利用Design-Expert 8.0.5.0软件对表2试验数据进行多元回归拟合,得到亚麻蛋白质得率对A料液比(g/mL)、B浸提温度(℃)、C浸提pH及D浸提时间(min)的二次多项回归模型为:Y(%)=78.69+3.85A-3.27B+1.93C+1.58D+0.18AB -0.56AC -1.82AD -0.71BC+3.17BD+5.91CD -3.59A2-10.02B2-7.44C2-5.18D2。
对该模型进行显著性检验及回归模型系数显著性结果(见表4)分析得出,该二次回归方程的模型项、一次项 A、B,二次项 A2、B2、C2、D2和交互项 CD 都表现出极显著影响,一次项C,交互项BD都表现出显著影响,而且失拟项不显著,表明该模型有显著意义。为了简化二次回归方程,剔除偏回归系数不显著的AB、AC、BC、AD项,简化可建立如下二次回归模型为:Y(%)=78.69+3.85A-3.27B+1.93C+1.58D+3.17BD+5.91CD-3.59A2-10.02B2-7.44C2-5.18D2。
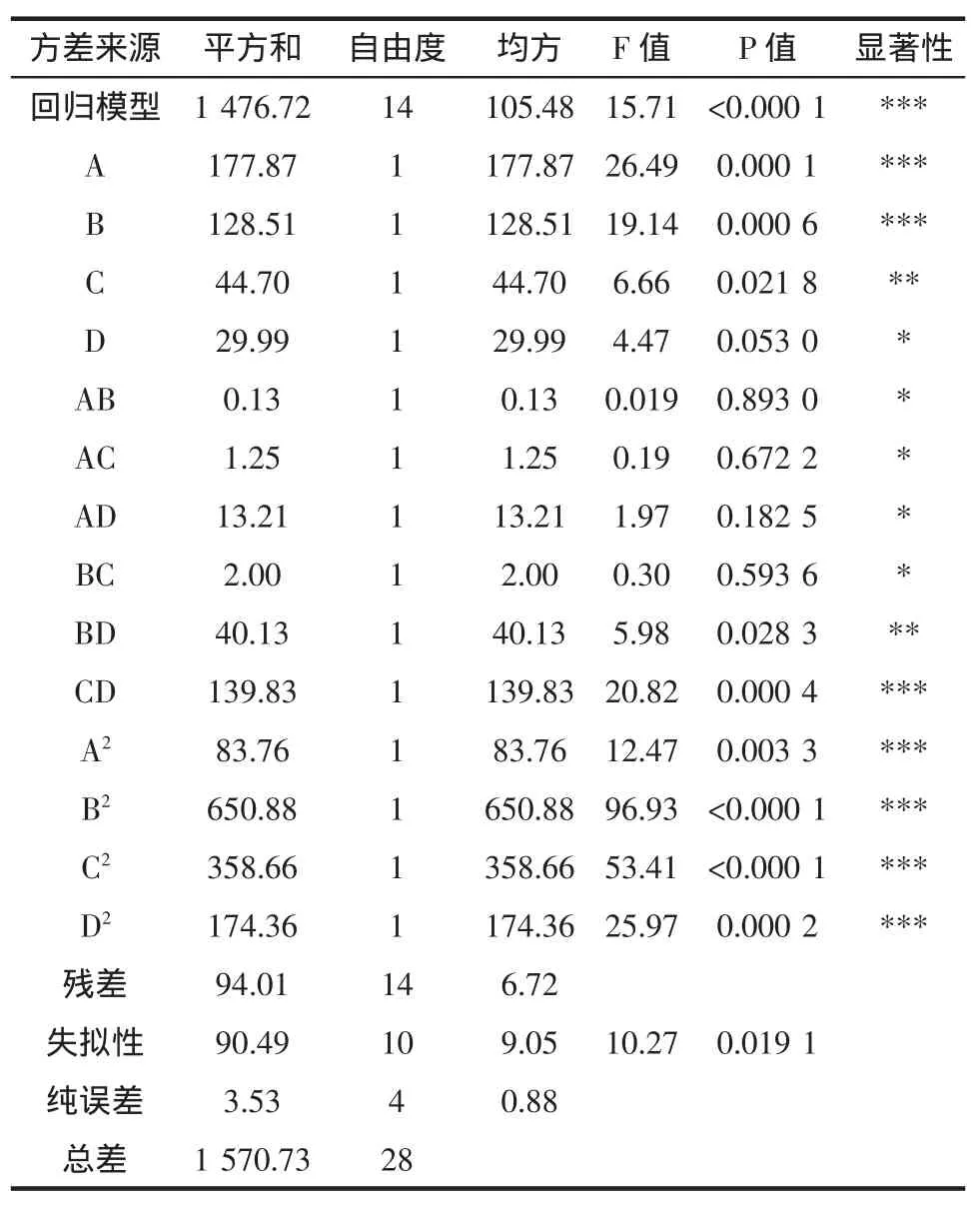
表4 实验结果的方差及显著性分析Table 4 Variance and significance analysis of the experimental results
由表3可以看出,回归模型具有高度的显著性(P<0. 0001),失拟性具有不显著性(P=0. 9744>0.05),且回归模型的R2=0. 9360>0.9,表明模型充分拟合实验数据,因此二次模型成立,应用此模型可以分析和预测亚麻籽蛋白质碱溶酸沉提取工艺的优化。由表3拟合二次多项式模型的方差及显著性分析的结果可知,模型的一次项A、B均显著,C差异显著,D不显著,二次项均显著,交互相CD显著,BD为差异显著,其他交互相均不显著。由F值可知,影响亚麻籽蛋白提取率的因素依次为A>B>C>D,即料液比>浸提温度>浸提pH>浸提时间。
2.4.3 两交互因素之间的作用
等高线的形状反映了各因素之间交互效应的强弱大小,圆形表示两因素交互作用不显著,而椭圆形则表示两因素交互作用显著。由表4的显著性分析及等高线图可知,浸提时间和浸提温度(BD)、浸提时间和浸提pH(CD)的交互作用对亚麻蛋白质的提取率的影响显著。具体分析如下。

图6 浸提时间和浸提温度交互作用对蛋白质提取率的影响Fig.6 Response surface and contour plots showing the interactive effects of extraction temperature and time on extraction efficiency of flaxseed protein extraction yields
图6表示料液比为1∶20(g/mL),浸提pH为10.0时,浸提时间与浸提温度对亚麻蛋白质的提取率的影响。当浸提时间一定时,亚麻蛋白质的提取率随着浸提温度的升高先增加后减小,在提取温度小于50℃时,亚麻蛋白质的提取量是随之增加的;当浸提温度一定时,亚麻蛋白质的提取量随浸提时间的增长而增大,当时间超过1.5 h时,蛋白质提取率也会趋于平缓。


图7 浸提时间和浸提pH交互作用对蛋白质提取率的影响Fig.7 Response surface and contour plots showing the interactive effects of extraction pH and time on extraction efficiency of flaxseed protein extraction yields
图7表示料液比为 1∶20(g/mL),浸提温度为50℃时,浸提时间与浸提pH对亚麻蛋白质的提取率的影响。当浸提时间一定时,亚麻蛋白质的提取率随着浸提pH的升高先增加后减小,在提取pH小于10.0时,亚麻蛋白质的提取量是随之增加的;当浸提pH一定时,亚麻蛋白质的提取量随浸提时间的增长而增大,当时间超过1.5 h时,蛋白质提取率也会趋于平缓。
2.4.4 亚麻籽蛋白提取条件的优化
通过用Design Expert 8.0.5.0软件分析,碱溶酸沉提取亚麻籽蛋白的最佳工艺条件如表5。

表5 最佳提取率的各个因素组合Table 5 Optimum extraction rate of various combinations of factors
由表5可知,碱溶酸沉提取亚麻籽蛋白的最佳工艺参数为:料液比 1∶20(g/mL),浸提温度为 48.4℃,浸提pH为10.09,浸提时间为89.6 min,在此条件下,亚麻籽蛋白的提取率理论值为79.26%。为了检验响应曲面法所得的结果的可靠性,采用上述优化提取条件进行亚麻蛋白质提取试验,考虑到实际操作的便利,将提取工艺参数修正为:料液比1∶20(g/mL),浸提温度为48℃,浸提pH为10.0,浸提时间为90 min。在此条件下进行提取,实际测得的亚麻蛋白质的提取率为78.47%,与理论值79.26%比较接近。因此,建立的二次型模型与实际情况基本吻合。
3 结论
1)本实验采用响应曲面法对碱溶酸沉法提取亚麻籽中的蛋白质工艺进行分析优化,建立的二次多项式数学模型具有良好的显著性。碱溶酸沉提取亚麻籽蛋白的最佳工艺条件为:浸提温度为50℃,料液比1 ∶20(g/mL),浸提 pH 为 10.0,浸提时间为 90 min,理论上的亚麻蛋白质的提取率可达79.26%,实际其提取率为78.47%。同时,在本实验的范围内,各影响因素对蛋白质提取率的作用大小依次为:料液比>温度>浸提pH>浸提时间。
2)利用果胶酶对亚麻籽进行脱胶的预处理之后,再来提取亚麻籽蛋白质,为亚麻籽蛋白资源的进一步开发提供基础理论研究技术。
[1] 周瑞宝.特种植物油料加工工艺[M].北京:化学工业出版社,2010:370-371
[2] BeMiller,James N,Roy L.Whistler,eds.Industrial gums:polysaccharides and their derivatives[M].Academic Press,1993,234-237
[3] Mazza G,Biliaderis C G.Functional properties of flax seed mucilage[J].Journal of Food Science,1989,54(5):1302-1305
[4] 陈海华,许时婴,王璋.亚麻籽胶化学组成和结构的研究[J].食品工业科技,2004,25(1):103-105
[5] 陈海华.亚麻籽的营养成分及开发利用[J].中国油脂,2004,29(6):72-74
[6] 汤茜.碱溶酸沉法制备火麻仁蛋白工艺研究[J].中国酿造,2011,228(3):108-110
[7] 鲁子贤.蛋白质和酶学的研究方法[M].北京:科学出版社,1998:37-39
[8] 赵晓燕,陈复生,薛文通,等.不同反胶束体系提取大豆蛋白质的研究[J].食品科学,2007,28(4):109
[9] 张敏,程志飞,王鹏.不同酶解条件对米糠蛋白提取率影响的研究[J].食品科学,2008,29(9):178
[10]Guan J,Fang Q,Hanna M A.Selected functional properties of extruded starch acetate and natural fibers foams[J].Cereal chemistry,2004,81(2):199-206
[11]杨文雄,高彦祥.响应面法及其在食品工业中的应用[J].中国食品添加剂,2005(2):62-71
[12]胡晓军.亚麻籽加工产业现状及对策[J].粮油食品科技,2009,17(6):28-30
[13]鹿保鑫,杨健,刘婷婷.亚麻胶提取工艺的研究[J].黑龙江农业科学,2007(3):95-97
[14]张文宾,许时婴.亚麻籽粘质物质的脱除工艺[J].食品与生物技术学报,2006,25(3):93-98
[15]Fedeniuk RW,Biliaderis CG,Composition and physicochemical properties of linseed(Linum usi tatissimum L.)mucilage[J].Journal of Agricultural and Food Chemistry,1994,42(2):240-247
[16]肖江,陈元涛,张炜,等.酶法脱除亚麻籽胶的工艺研究[J].食品科技,2012,37(12):151-154
[17]邓红,田芸芸,田子卿,等.响应面曲线优化文冠果种仁蛋白的碱溶酸沉提取工艺[J].食品工业科技,2010,31(8):197-200
[18]李静娟,易建华,朱振宝.响应面法优化桃仁蛋白提取工艺[J].中国油脂,2010,35(12):20-23
[19]刘进杰,张玉香,冯志彬,等.超声波提取莲花粉多糖工艺[J].食品科学,2011,32(18):44-48
