缺血再灌注对大鼠颌下腺分泌功能的影响
2014-12-16肖孟刘少华刘云生魏奉才石亮
肖孟 刘少华 刘云生 魏奉才 石亮
1.山东大学齐鲁医院口腔颌面外科,山东大学口腔医学研究所;2.山东大学口腔医学院,山东省口腔生物医学重点实验室,济南 250012
重症角结膜干燥症是由多种原因引起的眼表及泪膜异常的疾病[1],通过自体颌下腺移植以颌下腺分泌的唾液代替泪液是有效的治疗方法[2-3]。血管化自体移植颌下腺难免要经历失神经和缺血再灌注过程,可能影响腺体的分泌功能[4]。缺血预适应能改善移植颌下腺的分泌功能[5],而目前缺血再灌注后颌下腺的损伤-应激反应尚缺乏研究。本实验建立了大鼠颌下腺原位缺血再灌注模型,探讨缺血再灌注对大鼠颌下腺的损伤及损伤-应激反应对颌下腺分泌功能的影响。
1 材料和方法
1.1 实验动物和材料
健康的雄性Wistar大白鼠购于山东大学实验动物中心,质量均大于200 g。GMS10016.5 v.A氧化应激活性氧检测试剂盒(Genmed公司,美国);末端核苷酸转移酶介导的生物素化的三磷酸脱氧尿苷(2’-deoxyuridine 5’-triphosphate,dUTP)末端标记(terminal deoxyribonucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)凋亡检测试剂盒(QIA33型;Merk公司,德国); CM1900冰冻切片机、DFC425 C型荧光显微镜(Leica公司,德国)。
1.2 方法
1.2.1 大鼠颌下腺原位缺血再灌注模型 健康雄性Wistar大鼠随机分成4组,每组6只。大鼠经腹腔注射10%水合氯醛麻醉、消毒后,做颈部正中切口,依次剥离肌肉和筋膜,寻找大鼠颌下腺血管、神经及颌下腺导管束。游离并保护大鼠舌神经支配颌下腺的分支,保留副交感神经的支配作用。4组大鼠腺体通过无损伤血管夹夹闭颌外动脉颌下腺供血支(图1A),待缺血90 min后分别再灌注1、12、24、72 h。对侧腺体作为对照组。
1.2.2 颌下腺分泌量测定 腺体经历1、12、24、72 h再灌注后,各组大鼠再次麻醉,游离两侧颌下腺导管至口底后切断导管(图1B、C),并于断端处插入直径约0.5 mm的聚乙烯塑料小管(由10 μL移液管枪头拉制)测量腺体的分泌量(图1D)。测量腺体分泌量的方法采用Schirmer实验,以5 min内滤纸条(35 mm×5 mm)湿润的长度来表示[6]。测量结果重复3次取平均值。
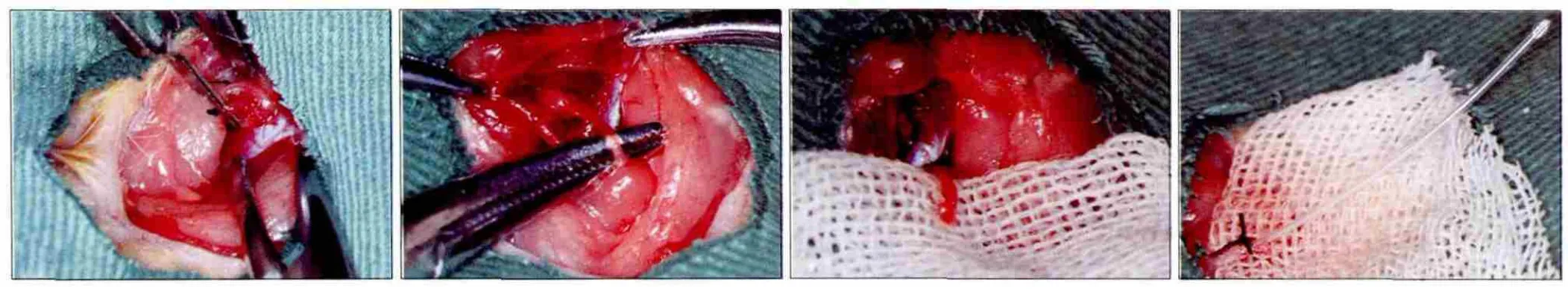
图1 大鼠颌下腺原位缺血再灌注模型的建立及腺体分泌量测定Fig 1 In situ ischemia reperfusion experimental model and salivary flow measurement of rat submandibular glands
1.2.3 颌下腺组织形态学观察 大鼠两侧颌下腺游离后摘除,取部分腺体组织于10%中性甲醛固定,经水洗、脱水、透明、包埋,切成5 μm厚的切片。腺体组织切片经苏木精-伊红(hematine-eosin,HE)染色,封固后于光学显微镜下观察腺体的组织学形态。
1.2.4 活性氧(reactive oxygen species,ROS)检测将部分新鲜颌下腺组织制成10 μm厚的冰冻切片,按氧化应激ROS检测试剂盒的说明检测腺体组织中ROS水平。荧光显微镜下观察(激发波长490 nm,散发波长520 nm),绿色荧光信号表示组织内ROS的水平。细胞核由4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)复染,显示出蓝色荧光信号。
1.2.5 腺体细胞凋亡检测 取5 μm厚的石蜡包埋组织切片,按照TUNEL凋亡检测试剂盒的说明检测腺体组织内细胞凋亡的水平,然后用甲基绿复染。通过光学显微镜观察,凋亡细胞核呈现深棕色,非凋亡细胞核呈现青绿色至淡绿色。每组标本在400倍的显微镜下随机选取10个视野,观察并记录各实验组TUNEL阳性细胞的数目。
1.2.6 统计学分析 采用SAS 9.1.3统计学软件对数据进行随机样本t检验,检验水准为双侧α=0.05。数据结果以均值±标准差表示。
2 结果
2.1 缺血再灌注后大鼠颌下腺分泌功能的变化
缺血再灌注后颌下腺分泌量的变化见图2:实验侧颌下腺分泌量在再灌注1、12 h时与对照侧相比明显降低(P<0.01);再灌注24 h,实验侧腺体分泌量开始增加,到再灌注72 h时,实验侧腺体的分泌量接近正常水平(P>0.05)。
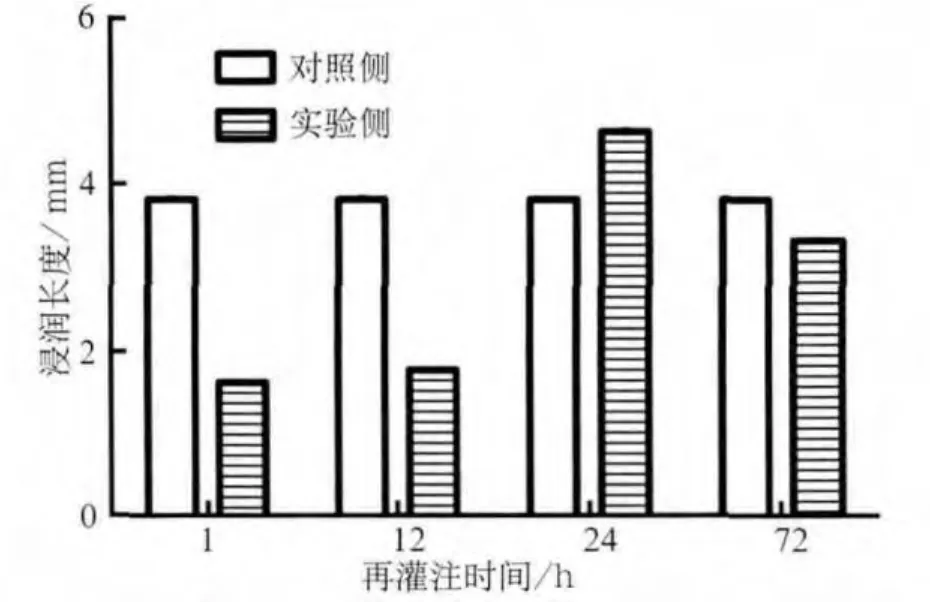
图2 缺血再灌注后颌下腺的分泌量Fig 2 The secretory function of the submandibular glands after ischemia reperfusion
2.2 缺血再灌注后颌下腺组织形态学的变化
对照侧颌下腺经HE染色后在显微镜下可观察到正常腺泡和导管的形态(图3A)。经过1 h再灌注,大鼠颌下腺的腺实质细胞轻度萎缩,间质较正常组织疏松,并出现充血、水肿现象;间质内可查见以少量单个核细胞为主的炎症浸润(图3B)。再灌注12 h后,颌下腺导管和腺体细胞萎缩,组织水肿加重,部分导管失去正常的形态,管腔闭锁;在腺小叶之间和导管周围出现大量的炎症细胞弥散分布,以早期中性粒细胞为主(图3C)。腺体经过24 h再灌注后,组织内炎症浸润以单核-巨噬细胞为主,组织水肿有所恢复,间质内可见少量梭形的纤维母细胞(图3D)。至再灌注72 h,组织水肿及炎症细胞浸润减轻,接近正常(图3E)。

图3 颌下腺缺血再灌注后的组织形态学变化 HE × 200Fig 3 The histological change of the submandibular glands after ischemia reperfusion HE × 200
2.3 缺血再灌注后大鼠颌下腺的氧化应激反应
正常颌下腺组织几乎检测不到ROS信号(图4A);实验侧腺体经历缺血再灌注后,荧光显微镜下可以观测到绿色ROS信号分布在腺体组织中,再灌注1~12 h,ROS信号逐渐增多(图4B、C);持续灌注24~72 h,腺体内ROS水平逐渐降低,最终接近正常组织(图4D、E)。
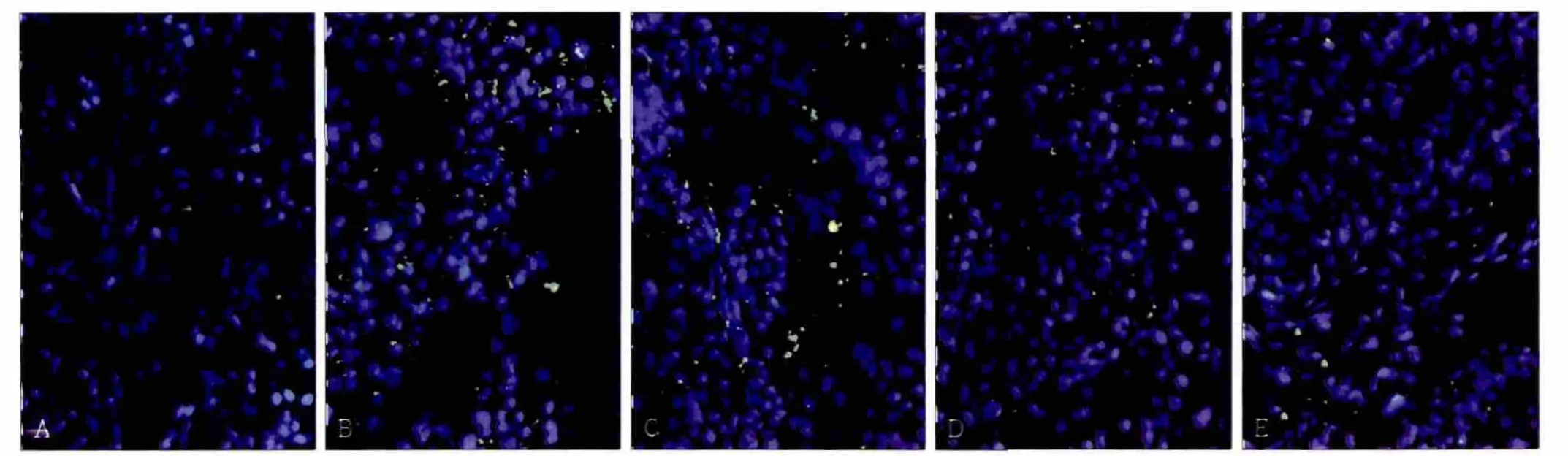
图4 颌下腺缺血再灌注后ROS的表达 免疫荧光染色 × 200Fig 4 ROS level of the submandibular glands after ischemia reperfusion immunofluorescence × 200
2.4 缺血再灌注后大鼠颌下腺细胞凋亡水平的变化
大鼠颌下腺缺血再灌注1、12、24、72 h后的细胞凋亡状况见图5。凋亡细胞呈深棕色,非凋亡细胞核呈青绿色至淡绿色。
在正常的腺体组织内,仅有少量TUNEL阳性细胞(图5A);而腺体经过缺血再灌注1、12、24 h后,凋亡细胞的数目明显增多(图 5B、C、D),随着再灌注时间延长,凋亡细胞的数目逐渐减少,再灌注72 h后,实验侧腺体细胞的凋亡数目与正常组织相当(图5E)。 经凋亡细胞计数,对照侧凋亡细胞为每视野(1.9±0.41)个,实验侧缺血再灌注1、12、24、72 h的凋亡细胞数分别为(14.7±1.40)、(11.0±0.56)、(9.0±0.89)、(2.8±0.59)个。经统计学分析,缺血再灌注1、12、24 h的凋亡细胞数明显多于对照侧(P<0.01),72 h后,实验侧与对照侧的差异无统计学意义(P>0.05)。
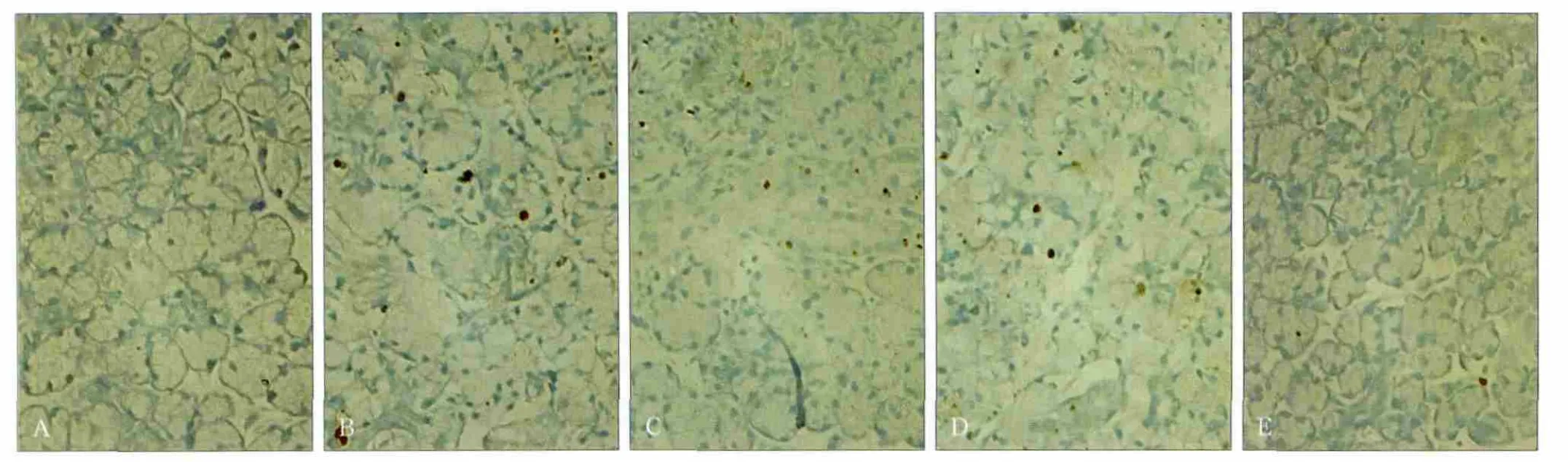
图5 颌下腺缺血再灌注后的细胞凋亡状况 TUNEL × 400Fig 5 Apoptotic cells of the submandibular glands after ischemia reperfusion TUNEL × 400
3 讨论
大量研究[7-8]证实,缺血再灌注损伤是临床多种疾病的病理基础,能够引起移植器官结构和功能状态的改变。为进一步探讨单纯缺血再灌注对移植腺体分泌功能的影响,本实验保留支配大鼠颌下腺分泌的神经分支,建立大鼠颌下腺原位缺血再灌注模型,通过观察腺体组织学变化、ROS水平、细胞凋亡及腺体功能状况,阐明单纯缺血再灌注能引起大鼠颌下腺损伤-应激反应及腺体分泌功能的改变。本研究证实,腺体的损伤-应激反应主要发生在再灌注早期,随着再灌注时间的延长而逐渐减轻。
本研究结果显示,经历缺血再灌注后大鼠颌下腺的组织学变化主要表现为早期的急性炎症反应及腺实质细胞的损伤。研究[9-10]证实,缺血再灌注后血管内皮细胞损伤,组织渗出增多,白细胞和巨噬细胞激活,导致多种趋化因子和细胞黏附分子大量生成、释放,并进一步介导局部组织细胞的炎症损伤。此外,缺血再灌注后血管功能紊乱和微循环的变化,可能会加重组织细胞的损伤[11]。本研究提示缺血再灌注后早期结构损伤与颌下腺分泌降低密切相关。
ROS是氧分子的活性代谢产物,主要包括超氧阴离子、过氧化氢和羟自由基等,能与许多生物分子发生活性反应。研究表明,ROS产生于缺血组织再灌注后早期,其引起的氧化应激是细胞损伤的主要因素[12]。缺血组织经历再灌注后产生大量的活性氧自由基,ROS能通过攻击细胞内生物大分子物质(如脂质、蛋白质、核酸),引起细胞通透性增加,破坏细胞内环境的稳定,导致细胞结构破坏和诱导细胞凋亡[13];同时,ROS可增加缺血再灌注后白细胞的激活、趋化及白细胞-内皮细胞的黏附,后者又进一步导致炎症介质的大量产生和释放,间接加重组织的损伤[14]。在本实验中,腺体缺血再灌注后ROS的水平与观察到的组织损伤情况相符,再灌注早期组织内ROS水平显著增加。
凋亡是细胞在生理或病理情况下发生的一种主动应激反应,大量的动物或人体器官模型研究表明,细胞凋亡是组织缺血再灌注损伤的病理特征之一。本实验发现,大鼠颌下腺缺血再灌注早期凋亡细胞的数目增加,其机制可能是由于缺血再灌注后的组织能量代谢障碍,氧应激及炎症反应等引起细胞内环境改变及结构破坏,并进一步通过下游细胞凋亡通路最终导致细胞凋亡的发生[15]。
颌下腺是主要的唾液分泌器官,在兔颌下腺移植实验中,移植腺体早期唾液分泌功能降低,而12 h后腺体出现暂时性分泌增多现象[5],失神经支配可能是其分泌改变的直接原因,而对于单纯缺血再灌注对腺体分泌功能的影响尚不清楚。本研究发现,大鼠颌下腺在保留神经支配的情况下经历缺血再灌注1~12 h后,腺体的分泌功能与正常组相比明显降低,与缺血再灌注后腺体的损伤-应激反应情况相符。该结果提示,缺血再灌注的损伤-应激反应是移植腺体早期分泌功能低下的重要原因。涎腺组织的水转运主要通过跨细胞和旁细胞途径来实现[16],本课题组前期的研究[5]也证实缺血预适应能够改善再灌注早期移植腺体的分泌功能;笔者推测,缺血再灌注后损伤-应激反应可能影响腺体水转运途径,其机制尚需要进一步的研究。明确缺血再灌注对颌下腺分泌功能的损伤作用,寻找合适的临床干预手段减少缺血再灌注损伤-应激反应,对改善移植腺体早期的分泌功能,减少腺体移植术后早期并发症有重要意义。
[1]Yao W, Davidson RS, Durairaj VD, et al. Dry eye syndrome:an update in office management[J]. Am J Med, 2011, 124(11):1016-1018.
[2]Paniello RC. Submandibular gland transfer for severe xerophthalmia[J]. Laryngoscope, 2007, 117(1):40-44.
[3]Yu GY, Zhu ZH, Mao C, et al. Microvascular autologous submandibular gland transfer in severe cases of keratoconjunctivitis sicca[J]. Int J Oral Maxillofac Surg, 2004, 33(3):235-239.
[4]Xiang B, Zhang Y, Li YM, et al. Phenylephrine protects autotransplanted rabbit submandibular gland from apoptosis[J]. Biochem Biophys Res Commun, 2008, 377(1):210-214.
[5]Yang NY, Shi L, Zhang Y, et al. Ischemic preconditioning reduces transplanted submandibular gland injury[J]. J Surg Res, 2013, 179(1):e265-e273.
[6]López-Jornet P, Camacho-Alonso F, Bermejo-Fenoll A. A simple test for salivary gland hypofunction using Oral Schirmer’s test[J]. J Oral Pathol Med, 2006, 35(4):244-248.
[7]Kadkhodaee M, Mikaeili S, Zahmatkesh M, et al. Alteration of renal functional, oxidative stress and inflammatory indices following hepatic ischemia-reperfusion[J]. Gen Physiol Biophys, 2012, 31(2):195-202.
[8]Eltzschig HK, Eckle T. Ischemia and reperfusion—from mechanism to translation[J]. Nat Med, 2011, 17(11):1391-1401.
[9]Lutz J, Thürmel K, Heemann U. Anti-inflammatory treatment strategies for ischemia/reperfusion injury in transplantation[J]. J inflamm: Lond, 2010, 7:27.
[10]Liu H, Drew P, Cheng Y, et al. Pirfenidone inhibits inflammatory responses and ameliorates allograft injury in a rat lung transplant model[J]. J Thorac Cardiovasc Surg, 2005,130(3):852-858.
[11]Schmitz V, Schaser KD, Olschewski P, et al.In vivovisualization of early microcirculatory changes following ischemia/reperfusion injury in human kidney transplantation[J]. Eur Surg Res, 2008, 40(1):19-25.
[12]Zhang W, Wang M, Xie HY, et al. Role of reactive oxygen species in mediating hepatic ischemia-reperfusion injury and its therapeutic applications in liver transplantation[J].Transplant Proc, 2007, 39(5):1332-1337.
[13]Sugawara T, Chan PH. Reactive oxygen radicals and pathogenesis of neuronal death after cerebral ischemia[J]. Antioxid Redox Signal, 2003, 5(5):597-607.
[14]Collard CD, Gelman S. Pathophysiology, clinical manifestations, and prevention ofischemia-reperfusion injury[J].Anesthesiology, 2001, 94(6):1133-1138.
[15]Crow MT, Mani K, Nam YJ, et al. The mitochondrial death pathway and cardiac myocyte apoptosis[J]. Circ Res, 2004,95(10):957-970.
[16]Murakami M, Shachar-Hill B, Steward MC, et al. The paracellular component of water flow in the rat submandibular salivary gland[J]. J Physiol: Lond, 2001, 537(Pt 3):899-906.
