舌鳞状细胞癌细胞与正常黏膜细胞微泡的差异蛋白组学研究
2014-12-16韩新生张卓远黄怡夏翼超李龙江
韩新生 张卓远 黄怡 夏翼超 李龙江
1.南充市中心医院口腔科,南充 637000;2.口腔疾病研究国家重点实验室 华西口腔医院头颈肿瘤外科(四川大学),成都 610041
微泡(exosome,EXO)又称外泌小体,是指由脂质膜所包裹的直径为40~100 nm的膜性囊泡[1]。EXO内含有丰富的mRNA、miRNA、蛋白质分子及脂质分子[2-3],其内容物的种类和数量取决于来源的细胞种类。多数类型的活细胞都可以分泌产生EXO,其中包括肿瘤细胞。EXO在各种生理和病理过程中起着非常重要的作用。近年来,在肿瘤细胞分泌EXO与肿瘤生长、侵袭,肿瘤的血管生成、免疫调节以及信息交流传递等方面进行了大量研究[4-7],结果认为,肿瘤细胞的EXO可成为肿瘤细胞的使者,在肿瘤物质和信息的传递方面起着非常重要的作用。然而,目前尚不清楚不同恶性肿瘤细胞外泌的EXO内可能的恶性物质及其功能情况,尤其是关于口腔癌细胞来源的EXO的研究较少。本文采用差异蛋白组学方法,分析舌鳞状细胞癌细胞与正常黏膜细胞EXO内蛋白质的表达情况,为研究舌鳞状细胞癌复发、转移、扩散机制提供分子生物学依据。
1 材料和方法
1.1 细胞株
舌鳞状细胞癌细胞Tca8113购自中国科学院细胞研究所,人永生化口腔黏膜上皮细胞HOK由四川大学口腔疾病研究国家重点实验室惠赠。
1.2 主要仪器和试剂
Leica TCS SP2型激光共聚焦扫描电子显微镜(scanning electron microscope,SEM)(德国莱卡公司),SJM-300型透射电子显微镜(transmission electron microscope,TEM)(日本电子株式会社),CP70 MX型冷冻高速离心机(日本日立公司),BIORAD450型酶联免疫检测仪(美国伯乐公司),稳压电泳系统(美国伯乐公司),DU530型核酸/蛋白分析仪(美国贝克曼公司),IPGphor等电聚焦仪、Ettan DALT six大型垂直电泳系统(美国通用电气公司),Ultraflex Ⅲ质谱仪(美国布鲁克公司);蔗糖、重水(D2O)、硫脲、除高峰度蛋白质试剂盒、碳酸钠、碳酸氢钠(Sigma公司,美国),DMEM高糖细胞培养基、角质细胞无血清培养基(defined keratinocyte-serum free medium,DK-SFM)(Gibco公司,美国),胎牛血清(fetal bovine serum,FBS)(杭州四季青生物工程材料有限公司),胰蛋白酶、鼠抗人主要组织相容性复合体Ⅰ类分子(major histocompatibility complex class Ⅰ,MHC-Ⅰ)单克隆抗体、鼠抗人热休克蛋白-70(heat shock protein-70,HSP-70)单克隆抗体(Santa公司,美国),辣根过氧化物酶标记的羊抗鼠IgG结合物(武汉博士德生物工程有限公司);Image Scanner扫描仪和LabScan软件,低熔点琼脂糖、固相pH值干胶条、蛋白质纯化试剂盒、定量试剂盒、考马斯亮蓝[安玛西亚生物技术(上海)有限公司]。
1.3 细胞培养及EXO的分离纯化和鉴定
1.3.1 细胞株的复苏、传代、培养 Tca8113细胞常规培养于含10% FBS的DMEM高糖培养基中,HOK细胞株用专用的DK-SFM无血清培养基于37 ℃、5%CO2孵箱中培养。根据细胞生长密度,一般每48 h换液1次。细胞传代:当细胞汇合程度达80%~90%时,细胞达到对数生长期,胰蛋白酶消化,按1∶2的比例传代。
1.3.2 细胞上清液的收集 为避免血清中EXO污染,将在含血清培养基中扩增的Tca8113按细胞密度为7×108个·mL-1接种到1 000 mL培养瓶,加无血清培养基200 mL,培养48 h后收集培养上清液;HOK细胞为无血清培养。将收集的上清液-20 ℃保存,到一定量后进行差速离心,以分离纯化上清液中的EXO。
1.3.3 EXO的分离纯化 将收集的细胞上清液在4 ℃下300 g离心5 min以去除死亡的细胞,再行2 000 g离心20 min,用直径为0.22 μm的滤器过滤以去除细胞碎片,收集过滤后的上清液,10 000 g离心30 min,收集上清液,随后110 000 g离心60 min得到沉淀的EXO,将沉淀的EXO重悬于5 mL PBS中,移至另一个底部装有以重水为密度垫的离心管中,以110 000 g离心60 min,在重水层得到的就是纯化的EXO[8]。将纯化的EXO用50 μlPBS稀释,将提纯稀释的EXO溶液装入EP管内,放入-80 ℃冰箱保存备用。
1.3.4 形态学观察 TEM观察:滴加30~40 μlEXO悬液于载样铜网上,室温静置3 min,滤纸吸干,滴加2%的磷钨酸溶液(pH=6.8)约20 μL于铜网上,室温负染2 min,滤纸吸干负染液,烤干约15 min,滴网法TEM下观察照相。SEM观察:将细胞爬片用2.5%的戊二醛固定液在4 ℃冰箱内固定1 h,系列梯度乙醇脱水,每次 5 min,将样本放入干燥仪内干燥约1.5 h,再将样品导电处理,完成后镜下观察。
1.3.5 Western blot 将获取的蛋白质样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),电泳后通过半干印迹法转移至聚偏氟乙烯膜上,室温下将膜置于含质量分数5%脱脂奶粉的磷酸盐缓冲液中封闭1 h,以阻断非特异性背景染色;然后于4 ℃下加入特异性抗体过夜。洗涤后加入辣根过氧化酶偶联多克隆抗体IgG共同孵育1 h。TTBS洗液中漂洗3次,最后在TBS中漂洗3 min,DAB显色,最后曝光及洗片,用Bio-Rad图像分析仪进行图像扫描。本实验使用的抗体及稀释度分别为:鼠抗人MHC-Ⅰ单克隆抗体(1∶100)和鼠抗人HSP-70单克隆抗体(1∶100),内参一抗的终稀释度为1∶500。
1.4 差异蛋白组学研究
1.4.1 EXO蛋白的纯化 用蛋白质纯化试剂盒进行EXO蛋白的纯化。
1.4.2 EXO蛋白的定量 采用Bradford法测定EXO悬液中的蛋白质质量浓度。将样本混匀,静置10 min,每组样本设3个复孔,放置在波长为595 nm的酶标仪中检测吸光度值。
1.4.3 双向聚丙烯酰胺凝胶电泳 1)第一向等电聚焦电泳(isoelectric focusing electrophoresis,IEF)。将制备好的蛋白质样品均匀涂布在胶条槽两电极之间,避免产生间断和气泡,然后撕掉胶条保护膜,将IPG(immobilized pH gradient)梯度干胶条的胶面向下,把整个胶条缓缓地放入胶条槽中,每个IPG胶条上均匀涂覆覆盖油以防止电泳时水分蒸发。电泳参数:30 V,12 h;500 V,1 h;1 000 V,1 h;8 000 V,0.5 h;10 000 V,10 h;500 V,12 h。2)第二向SDS-PAGE电泳。配制SDS-PAGE电泳缓冲液,然后配制琼脂糖封胶液并加热熔解。IPG胶条平衡方法如下:用平衡缓冲液进行两次平衡,每次在轨道摇床上摇动15 min;将平衡好的胶条水平附在SDS-PAGE凝胶上缘,缓缓加入少量上槽电泳缓冲液,使上、下槽缓冲液处于电泳槽标定刻度间的同一水平面。电泳参数:74 V,161 mA,12 W,1 h;91 V,132 mA,12W,1 h;257 V,389 mA,100 W,1 h;410 V,244 mA,100 W,4 h。电泳后将所得凝胶进行考马斯亮蓝染色。
1.4.4 凝胶图谱扫描和分析 用Image Scanner机器对凝胶图像进行扫描,用Image Master V 5.0软件对扫描图谱进行分析。
1.4.5 串联二级质谱(milli second/milli second,MS/MS)对差异点的分析 对获得的电泳凝胶进行酶解和除盐等一系列处理,然后利用基质辅助激光解析电离飞行时间质谱仪进行质谱分析。消化酶:胰酶;固定修饰:乙酰化,可变修饰:氧化;一级质量容差允许误差范围:±0.01%;二级片段质量公差允许误差范围:±0.7 g·mol-1;数据库:美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI);种属:人类。
2 结果
2.1 EXO的形态学观察
经SEM和TEM观察,均可见培养细胞分泌出大量的EXO;EXO呈现为圆形或类圆形的小体结构,大小不等,直径为40~100 nm(图1)。
2.2 EXO分子标志物的鉴定
以细胞全蛋白为阳性对照,以β-actin为内参,通过Western blot试验,EXO在相对分子质量为7.3×104处检测到HSP-70蛋白的表达,在4.0×104处有MHC-Ⅰ蛋白的表达。
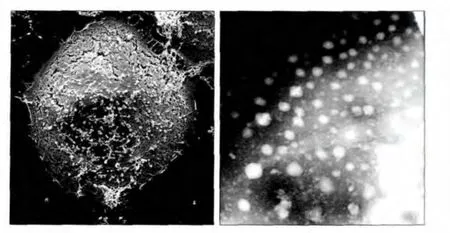
图1 Tca8113细胞表面外泌的EXO(左)及EXO的形态(右)Fig 1 EXO observed under SEM in Tca8113 cells surface (left) and EXO morphology observed under TEM (right)
2.3 差异蛋白组学实验
2.3.1 EXO的定量分析 通过Bradford法测定每次分离制备的EXO悬液中的总蛋白含量,平均每毫升EXO悬液可获得EXO(30.2±1.9)μg,质量范围为28.3~32.1 μg,95%可信区间为27.5~33.4 μg。
2.3.2 双向聚丙烯酰胺凝胶电泳 通过第一向IEF聚焦和第二向SDS-PAGE电泳得到的分离电泳图谱见图2。将得到的凝胶图谱进行考马斯亮蓝染色,通过Image Master V 5.0软件进行扫描和自动分析,设定差异表达量在2倍及以上的点纳入下一步实验。本实验共筛选纳入16个差异点进行质谱学分析和鉴定,其中舌鳞状细胞癌细胞EXO上调表达的有12个点,下调表达的有4个点。
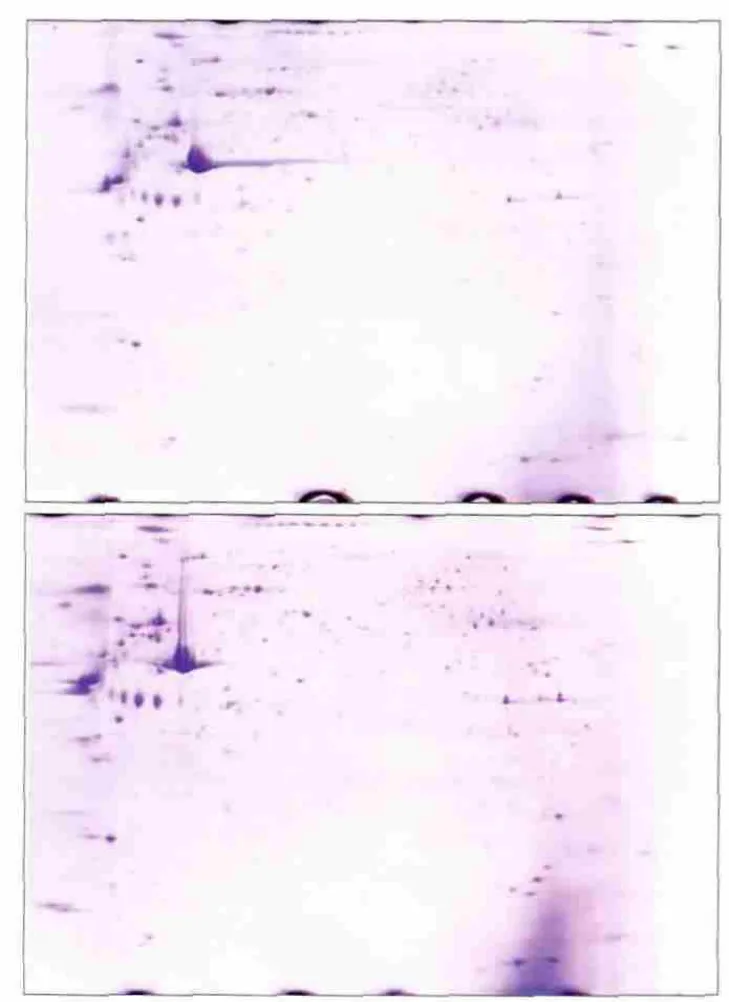
图2 对照组(HOK细胞,上)和实验组(Tca8113细胞,下)EXO的电泳图谱Fig 2 Electrophoretogram of EXO control group (HOK cells, top)and experimental group (Tca8113 cells, bottom)
2.4 MS/MS对差异点的分析
对所得16个差异表达点进行切胶、酶解、除盐以及固定和可变修饰等,得到16个一级肽质量指纹图谱,再对后者进行串联二级质谱的MS/MS分析,得到16组肽段的MS/MS数据,使用Biotools软件检索,以MASCOT为搜索引擎,搜索参数设置:数据库为NCBI,检索种属为人类,在线检索得到16个差异点的蛋白质名称和NCBI 库编号(表1)。分析表1可见,本研究出现了多个点鉴定为同一蛋白质的现象,其原因可能是由于体内同一蛋白有不同形式的修饰或剪切存在,从而形成相对分子质量和等电点不同的蛋白质,这些蛋白质在鉴定时会同时指向数据库中全长无修饰的同一蛋白质。本研究结果发现,差异表达的蛋白质中有肌动蛋白、黏着斑蛋白、波形蛋白以及锚定蛋白Ⅰ等,此类蛋白是细胞骨架蛋白,它在EXO中存在说明EXO的内容物来自细胞质成分。EXO的形成首先是质膜内陷形成含有多个微囊泡的多囊体,然后多囊体与细胞膜融合分泌到细胞外形成EXO。锚定蛋白的存在验证了质膜内陷、多囊体中各微囊泡的融合、多囊体和质膜融合释放EXO这一过程。波形蛋白可能是维持EXO分泌到细胞微环境并保持稳定结构的重要物质。本研究得到了两个有重要意义的差异表达蛋白即肿瘤拒绝抗原1(gp96)和K-sam蛋白。此外,本研究中检索出了假想蛋白,这是目前结构和功能均未知,但在人体中确实存在的蛋白质,分析其结构可能对其功能的研究提供重要线索。
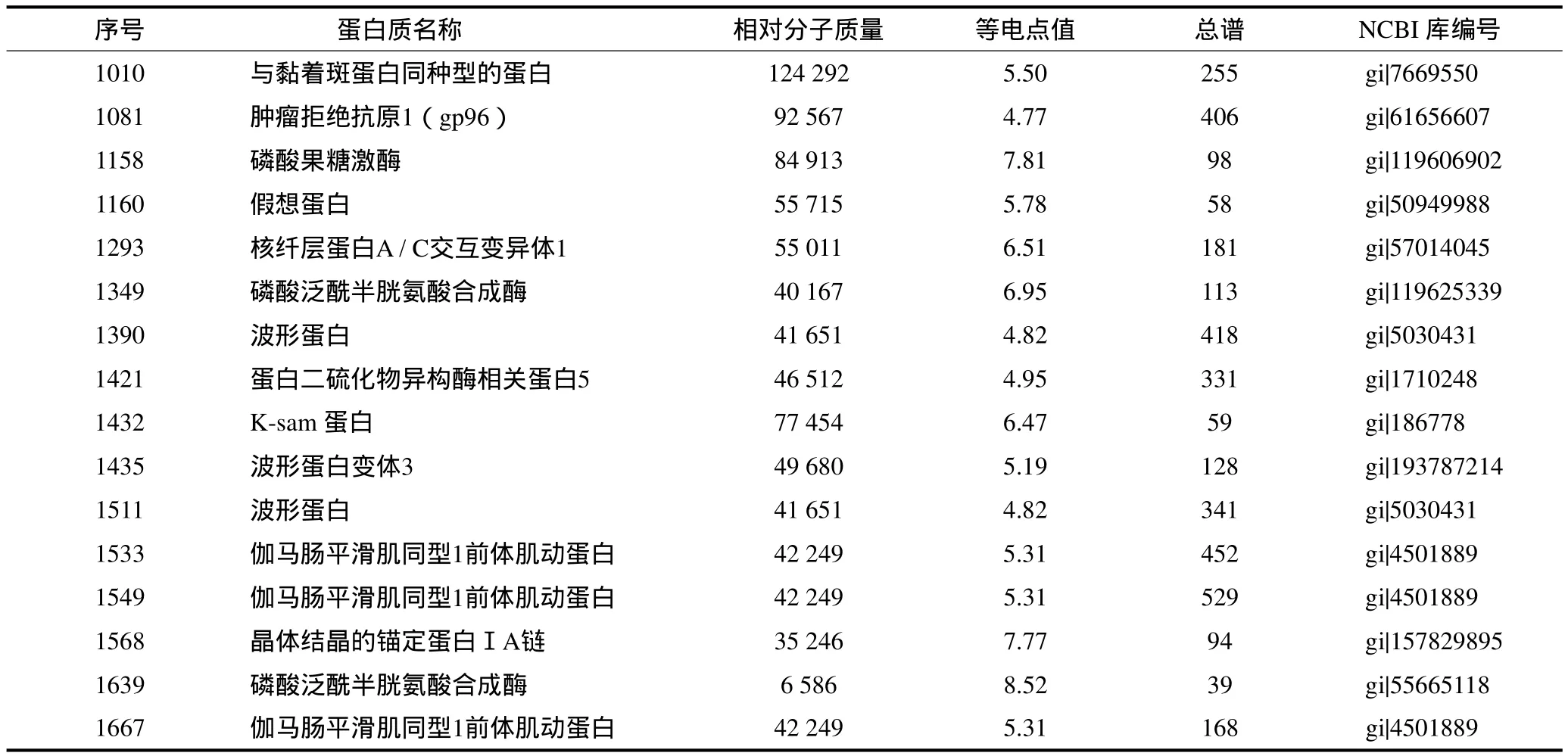
表1 16个差异蛋白点的MS/MS分析Tab 1 Sixteen differential points of MS/MS analysis
3 讨论
本研究结果证实了Tca8113和HOK细胞株在体外培养的情况下可以分泌大量的具有囊泡状结构的物质,这些物质经过EXO表面标志分子HSP-70和MHC-Ⅰ验证,证实为细胞外分泌形成的EXO,这与其他文献[9-11]报道一致。同时,本研究也证实,通过密度梯度离心法可以获得较高纯度的EXO,通过蛋白双向电泳可以获得分辨率和重复性较好的凝胶图谱,蛋白质组学技术是快速、高通量获取EXO蛋白质构成的有力方法[12]。
本研究发现,肿瘤拒绝抗原1(gp96)在舌鳞状细胞癌细胞来源的EXO中表达上调。gp96属于热休克蛋白HSP-90家族成员。目前研究表明,gp96可以作为分子伴侣参与肿瘤抗原向MHC-Ⅰ类分子途径的递呈过程,并与抗原肽形成gp96肽复合物,激活CD8+T淋巴细胞,产生抗肿瘤的特异性免疫反应。此外,gp96还能不依赖于抗原肽激活核因子-κB(nuclear factor-κB,NF-κB)信号转导,产生细胞因子和趋化因子,诱导树突状细胞成熟,通过上述多种作用调节非特异性免疫反应。gp96在舌鳞状细胞癌细胞来源的EXO中表达上调,可以推断出舌癌细胞可能通过分泌大量含有gp96的EXO从而排除自身的肿瘤抗原,进而使肿瘤逃避机体的免疫监视和免疫应答。这为进一步分离纯化舌鳞状细胞癌细胞来源的含有gp96的EXO,进而制备抗舌癌的疫苗提供了实验支持[13]。
本研究还观察到K-sam蛋白在舌鳞状细胞癌细胞EXO中表达上调。K-sam蛋白又称成纤维细胞生长因子受体2(fibroblast growth factor receptor 2,FGFR2)蛋白,由K-sam基因编码,K-sam基因是一种致癌基因,起初作为增殖基因从胃癌细胞株KATO-Ⅲ中分离得到[14],在弥散性胃癌中增殖作用明显。FGFR2与人类疾病密切相关,对癌症的进展起到重要的促进作用[15]。目前研究发现,在口腔癌、肺癌、胃癌、直肠癌、乳腺癌等肿瘤中均存在FGFR2的表达[16-19]。不少学者对FGFR2在口腔癌中的作用进行了研究,结果发现,在口腔鳞状细胞癌中成纤维细胞生长因子(fibroblast growth factor,FGF)及其受体FGFR,主要是FGFR2表达上调。Vairaktaris等[20]通过动物模型研究口腔癌从正常黏膜到黏膜细胞非典型增生再到口腔黏膜癌变的连续不同的阶段,发现在口腔黏膜癌变的起始阶段(从黏膜细胞非典型增生到早期浸润癌),FGFR2和FGFR3表达量上调,这提示FGFR2在口腔黏膜癌变的起始阶段有非常重要的作用。本研究同样发现,FGFR2(K-sam蛋白)在舌鳞状细胞癌细胞EXO中表达上调,可能是由于舌鳞状细胞癌细胞释放含有癌基因K-sam的EXO到细胞微环境中所致。笔者推测,这种EXO可以恶性转化周围的正常细胞,从而引起舌癌扩散、转移、复发,这一推测需要后续研究来做进一步验证。
[1]Simons M, Raposo G. Exosomes—vesicular carriers for intercellular communication[J]. Curr Opin Cell Biol, 2009, 21(4):575-581.
[2]Skog J, Würdinger T, van Rijn S, et al. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J]. Nat Cell Biol,2008, 10(12):1470-1476.
[3]Hong BS, Cho JH, Kim H, et al. Colorectal cancer cell-derived microvesicles are enriched in cell cycle-related mRNAs that promote proliferation of endothelial cells[J]. BMC Genomics,2009, 10:556.
[4]Mathivanan S, Ji H, Simpson RJ, et al. Exosomes: extracellular organelles important in intercellular communication[J]. J Proteomics, 2010, 73(10):1907-1920.
[5]Al-Nedawi K, Meehan B, Rak J, et al. Microvesicles: messengers and mediators of tumor progression[J]. Cell Cycle,2009, 8(13):2014-2018.
[6]Ludwig AK, Giebel B. Exosomes: small vesicles participating in intercellular communication[J]. Int J Biochem Cell Biol, 2012, 44(1):11-15.
[7]Muralidharan-Chari V, Clancy JW, Sedgwick A, et al. Microvesicles: mediators of extracellular communication during cancer progression[J]. J Cell Sci, 2010, 123(10):1603-1611.
[8]Théry C, Regnault A, Garin J, et al. Molecular characterization of dendritic cell-derived exosomes. Selective accumulation of the heat shock protein hsc73[J]. J Cell Biol, 1999,147(3):599-610.
[9]Février B, Raposo G. Exosomes: endosomal-derived vesicles shipping extracellular messages[J]. Curr Opin Cell Biol, 2004,16(4):415-421.
[10]Taylor DD, Gercel-Taylor C. MicroRNA signatures of tumorderived exosomes as diagnostic biomarkers of ovarian cancer[J]. Gynecol Oncol, 2008, 110(1):13-21.
[11]Bard MP, Hegmans JP, Hemmes A, et al. Proteomic analysis of exosomes isolated from human malignant pleural effusions[J]. Am J Respir Cell Mol Biol, 2004, 31(1):114-121.[12]Anderson NL, Anderson NG. Proteome and proteomics: new technologies, new concepts, and new words[J]. Electrophoresis, 1998, 19(11):1853-1861.
[13]Mignot G, Roux S, Thery C, et al. Prospects for exosomes in immunotherapy of cancer[J]. J Cell Mol Med, 2006, 10(2):376-388.
[14]Hattori Y, Itoh H, Uchino S, et al. Immunohistochemical detection of K-sam protein in stomach cancer[J]. Clin Cancer Res, 1996, 2(8):1373-1381.
[15]Basilico C, Moscatelli D. The FGF family of growth factors and oncogenes[J]. Adv Cancer Res, 1992, 59:115-165.
[16]Drugan CS, Paterson IC, Prime SS, et al. Fibroblast growth factor receptor expression reflects cellular differentiation in human oral squamous carcinoma cell lines[J]. Carcinogenesis, 1998, 19(6):1153-1156.
[17]Davies H, Hunter C, Smith R, et al. Somatic mutations of the protein kinase gene family in human lung cancer[J]. Cancer Res, 2005, 65(17):7591-7595.
[18]李新华. 胃癌蛋白质组与基因表达谱分析并差异蛋白质和基因的识别鉴定[D]. 广州: 中国人民解放军第一军医大学, 2003:18-47.
[19]Jang JH, Shin KH, Park JG, et al. Mutations in fibroblast growth factor receptor 2 and fibroblast growth factor receptor 3 genes associated with human gastric and colorectal cancers[J]. Cancer Res, 2001, 61(9):3541-3543.
[20]Vairaktaris E, Ragos V, Yapijakis C, et al. FGFR-2 and -3 play an important role in initial stages of oral oncogenesis[J]. Anticancer Res, 2006, 26(6):4217-4221.
