三种食源性致病菌挥发性代谢产物谱快速检测研究
2014-12-16操庆国徐海棠李东成
操庆国,郭 钦 ,刘 涵,徐海棠,李东成
(1.江苏农林职业技术学院生物工程系,江苏句容 212000;2.江苏大学食品与生物工程学院,江苏镇江 212013)
微生物挥发性代谢产物(MVOCs)是一类亲脂、低分子量(一般100~300u)、常温常压下易挥发的含碳化合物,其包含很多微生物有用的生物信息[1-2]。MVOCs谱具有种属特异性,多数由浓度不等的混合物组成,是微生物特定生理代谢活动途径的后果。特定的细菌产生特定代谢产物,如胺、氨气、吲哚、酯类和醇类等。MVOCs可以促进或抑制特定植物的生长、调节细菌和真菌种间和种内的相互作用、防止昆虫虫害,也可以作为检测特定细菌的方法之一、或作为检测人体疾病、食品腐败或房屋中霉菌生长的标记物[3-4]。某些MVOCs如高级醇类还可以作为生物柴油被利用。目前,已经建立的 MVOCs数据库(http://bioinformatics.charite.de/mvoc)已收集 349 种细菌和69种真菌近1000种代谢产物,并阐明了其结构和代谢途径。
副溶血弧菌、大肠杆菌和金黄色葡萄球菌是重要的食源性致病菌,每年引起多起食品中毒事件,造成了较大的经济损失和人员伤害。已经开发了多种检测方法,如传统的生化检验、PCR和多重PCR、荧光定量PCR、ELISA快速检测试剂盒和LAMP等,但这些方法都存在不足之处,如检测时间长、成本过高、操作步骤复杂和假阳性高等,因此建立一种快速、简便、无损的副溶血弧菌、大肠杆菌和金黄色葡萄球菌检测方法已迫在眉睫。当副溶血弧菌等细菌污染食物后,其在食物中早期生长时会散发出独特的 MVOCs,这些成分会在空气中扩散,因此对MVOCs的检测要早于后期细菌的可视见生长,有助于防止食物的进一步腐败,预防食物中毒。由于在细菌毒素合成之时,也会有对应的MVOCs散发,因此MVOCs的检测还可以判断食物中是否有食源性致病菌毒素的产生[5]。
本文主要通过SPME-GC-MS(固相微萃取-气质联用)联用,对以上三种食源性致病菌进行MVOCs谱的检测,研究其变化规律,找到其在各个生长时期的特征性挥发性代谢产物成分,从而为三种食源性致病菌的快速检测奠定基础。
1 材料与方法
1.1 实验材料
致病性副溶血弧菌(tdh+)VP-62和VP-73菌株 镇江市疾控中心;大肠杆菌1.02389和金黄色葡萄球菌金黄亚种1.02465 中国普通微生物菌种保藏中心(CGMCC)。TCBS培养基、BHI培养基、TSI培养基和LB培养基 青岛高科园海博生物技术有限公司;无水乙醇、氯化钠等其他化学试剂 华东国药集团化学试剂有限公司(上海)。
1.2 主要仪器与设备
超净工作台 苏州净化设备有限公司;LRH-250生化培养箱 上海一恒科学仪器有限公司;电子天平 上海精科天平仪器厂;3110-P1000型移液枪 德国Eppendorf公司;全自动高压蒸汽灭菌锅 鸟取三洋电机(广州)有限公司;台式高速冷冻离心机湖南湘仪实验室仪器开发有限公司;GC-MS(气相色谱质谱联用仪) 美国安捷伦科技有限公司;固相微萃取装置 美国安捷伦科技有限公司;手动SPME进样器 上海安普仪器有限公司;XH-C旋涡混合器江苏金坛市医疗仪器厂。
1.3 实验方法
1.3.1 副溶血弧菌的培养和纯化 从25℃保存的TSI斜面培养基挑取菌体,反复划线于TCBS平皿上,37℃生化培养箱中培养18~24h,挑取绿色单菌落进行下一步实验。
1.3.2 副溶血弧菌的定时取样 从TSI斜面培养基上挑取菌体,转接到BHI液体培养基中,37℃振荡培养18~24h。从活化后的液体培养基中吸取200μL菌液分别接种于装有5mL BHI液体培养基的15mL顶空瓶中,37℃振荡培养,于0、8、18、30、42、54h 定时取样,进行SPME-GC-MS检测。
1.3.3 大肠杆菌和金黄色葡萄球菌的培养和纯化从4℃保存的LB斜面培养基中挑取菌体,反复划线于LB平板上,37℃生化培养箱中培养12h,挑取单菌落进行下一步实验。
1.3.4 大肠杆菌和金黄色葡萄球菌的定时取样 挑取纯化好的单菌落,转接到LB液体培养基中,37℃振荡培养10~12h。从活化后的液体培养基中吸取200μL的菌液分别接种于装有5mL LB液体培养基的15mL 的顶空瓶中,37℃振荡培养,于 0、4、8、12、16、20、24h 定时取样,进行 SPME-GC-MS 检测。
1.3.5 固相微萃取条件 用老化时间和老化温度65μm萃取头(Supelco)进行萃取。在加有5mL发酵液的15mL顶空瓶中插入萃取头,37℃预热5min,萃取吸附30min,GC解吸5min(250℃),用于 GC-MS分析。
1.3.6 GC-MS分析条件 色谱柱为 AB-1701毛细管柱(30m ×0.25mm,i.d.× 0.25μm);升温程序:45℃保持4min,以8℃/min的速度升温至220℃,保持5min;载气 He 流速 1.0mL/min,进样量 1μL,不分流进样。质谱条件:电子轰击(EI)离子源;电子能量为70eV;离子源温度为 230℃;质量扫描范围 m/z 35~500。
2 结果与讨论
2.1 萃取头的选择
SPME有多种萃取头,非极性的100μm PDMS纤维头对非极性、弱极性或亲脂性组分灵敏度较高;弱极性的65μm PDMS/DVB纤维头对极性和非极性组分都有较好的吸附能力;75μm CAR/PDMS纤维头对于挥发性较强的如气体硫化物有很好的吸附能力。分别用这三种萃取头,对VP-62 54h培养物进行了SPME-GC-MS的测定,结果如表1所示。
从表1可以看出,65μm PDMS/DVB纤维头出峰数和可检出化合物数较多,对于极性、非极性和弱极性的挥发性化合物都具有很强的吸附能力。因此选择65μm PDMS/DVB纤维头进行三种食源性致病菌挥发性代谢产物谱的测定。
2.2 萃取条件优化
SPME分析结果除与纤维头本身的性质相关外,还与萃取时间、萃取温度、萃取头浸入深度等相关。
由于人体温度接近37℃,细菌的最适培养温度为37℃,因此选择37℃作为萃取温度;以VP-62 54h培养物为样品,选用65μm PDMS/DVB萃取纤维头,比较不同萃取时间对萃取结果的影响,结果如表2。
如表2所示,随着萃取时间的延长,出峰数不断增加,但当萃取时间超过30min后,出峰数虽然继续增加,但相差不大。萃取时间过长会使SPME纤维头带上大量水分,从而影响GC-MS的检测效果,因此选择30min作为萃取时间进行后续实验。
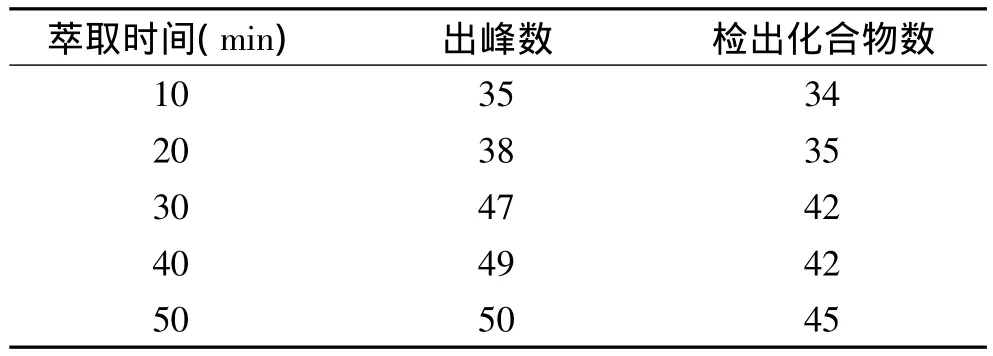
表2 不同萃取时间对萃取结果的影响Table 2 The effects of different extraction time on the extraction results
2.3 微生物挥发性代谢产物谱(MVOCs)分析
2.3.1 副溶血弧菌MVOCs谱分析 对2株副溶血弧菌和BHI空白培养基进行萃取,GC-MS检测发酵液中MVOCs成分,分析副溶血弧菌挥MVOCs的变化趋势,结果如图1所示。VP-62和VP-73在不同时间段MVOCs出峰数不同,随培养时间延长逐渐增加,均在30h时达到最大值,分别有41和37个峰,其后VP-62的出峰数迅速下降,而VP-73的出峰数在42h后又迅速上升。
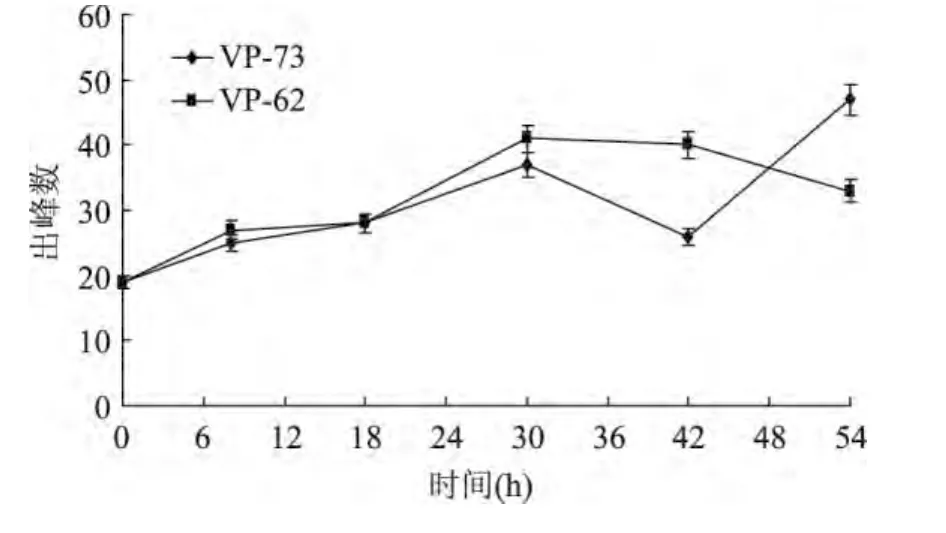
图1 副溶血弧菌挥发性代谢产物变化趋势Fig.1 The trends of volatile metabolites of Vibrio parahaemolyticus VP-62 and VP-73
对副溶血弧菌的MVOCs谱进行分析(表3),发现八甲基环四硅氧烷、十甲基环戊硅氧烷和六甲基环三硅氧烷含量较高,但这三种属于柱流失成分,应该与细菌代谢无关。除此之外,BHI空白培养基MVOCs能检出19种物质,其主要成分为(3-甲氧基-苯基)-(6-甲基-4-苯基喹唑啉-2-基)-胺、2,5-双(1,1-二甲基乙基)-苯酚和4-甲基-2-三甲基甲硅烷氧基-三甲基甲硅烷基酯苯甲酸。培养30h的VP-62和VP-73 MVOCs谱略有差异,可检出化合物分别为28和31个,包括烷、酸、醇、醚和肟等多种中间代谢产物和有机物。两者MVOCs谱都产生了相同的主要特征成分2-氯-4-(4-甲氧基苯基)-6-(4-硝基苯基)嘧啶、二叔丁基过氧化氢、3-甲基-1-丁醇等,而BHI培养基则缺乏这些成分,表明它们是由副溶血弧菌代谢过程中独特产生。副溶血弧菌一般都分泌胞外蛋白酶和脂肪酶,喜欢污染肉类食品,BHI培养基的主要成分为牛脑、牛心浸出物、蛋白胨和葡萄糖,营养丰富,蛋白质含量较高,因此其可以把培养基中的蛋白质和氨基酸分解成含硫和胺类化合物,脂肪则被氧化成过氧化物,进而分解为醛、酮等,糖类等则被分解成酸、醇等[6]。烷烃类的物质可能是脂肪降解和氧化的次级产物。这些成分混合在一起赋予副溶血弧菌发酵产物不愉快的腐败臭味,也具有一定的毒性。如2-氯-4-(4-甲氧基苯基)-6-(4-硝基苯基)嘧啶是一种化学防腐剂“果立鲜”的主要成分,二叔丁基过氧化氢和3-甲基-1-丁醇对粘膜及肠道有刺激作用,可引起灼烧感、头痛、恶心及呕吐等过敏反应,对该菌引起的胃肠道炎症有一定贡献。

图2 副溶血弧菌VP-62和VP-73培养12h发酵液总离子流色谱图Fig.2 The total ion chromatograms of V.parahaemolyticus VP-62(a)and VP-73(b)after 12h culture
2.3.2 大肠杆菌和金黄色葡萄球菌挥发性代谢产物检测
2.3.2.1 大肠杆菌挥发性代谢产物检测 对大肠杆菌1.02389发酵产物和LB空白培养基进行选择性萃取,用GC-MS对发酵液中MVOCs进行检测,分析大肠杆菌MVOCs的变化规律,结果如图3所示。LB空白培养基经GC-MS分析后共检测到51个峰,可检出化合物为44个。大肠杆菌1.02389不同培养时间出峰数略有不同,随时间的增加,出峰数先下降再升高,12h时达到最大值,有55个峰,可检出化合物为42个,其后出峰数迅速下降,16h后保持稳定。大肠杆菌MVOCs出峰数的变化可能跟其生长时期相关,对数期出峰较多,变化较大,稳定期后出峰数下降且
维持恒定。

表3 副溶血弧菌MVOCs谱Table 3 The MVOCs spectrum of V.parahaemolyticus
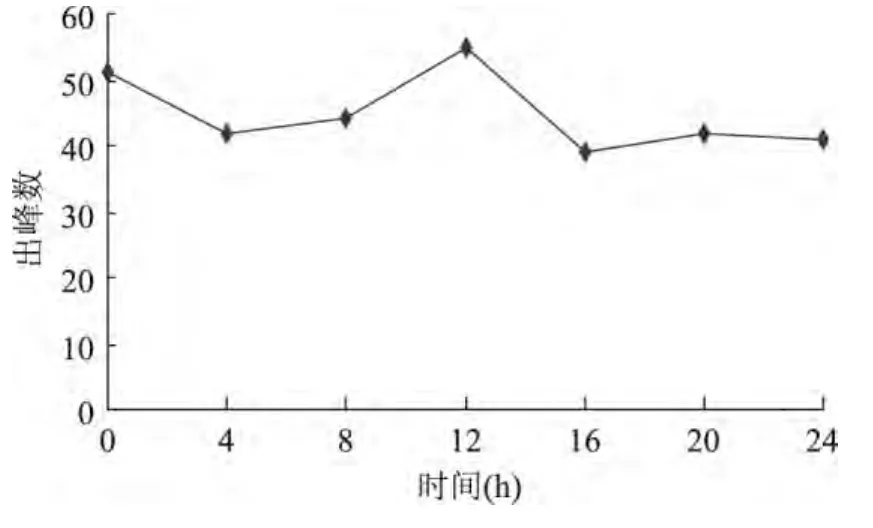
图3 大肠杆菌挥发性代谢产物变化规律Fig.3 The changes of volatile metabolites of E.coli

图4 空白LB培养基总离子流色谱图Fig.4 The total ion chromatograms of control
图5 大肠杆菌1.02389培养12h总离子流色谱图Fig.5 The total ion chromatograms of E.coli after 12h culture
大肠杆菌培养12h的MVOCs成分如表4,峰图见图5。从表4中看出,除掉柱流失成分外,LB空白培养基中主要成分为2-氯-4-(4-甲氧基苯基)-6-(4-硝基苯基)嘧啶和2,4-双(1,1-二甲基乙基)苯酚等酮类、苯酚类成分;而培养12h的大肠杆菌发酵液中MVOCs谱主要成分为烷类、烃类、杂环类和醇类化合物,其生长代谢产生了区别于LB的特征性挥发性物质,如硫代乙酸S-[8-(二乙基膦酰基)辛基]酯、1,3-二苯基-1-(三甲基甲硅烷氧基)-1-庚烯、环十二烷、2-甲基-1-丁醇和八溴癸等,这些物质都属于化学中间体,对皮肤和粘膜都具有刺激作用,可引起眩晕、呕吐及紫绀等反应。
2.3.2.2 金黄色葡萄球菌挥发性代谢产物检测 用SPME-GC-MS检测金黄色葡萄球菌发酵液MVOCs变化规律,结果如图6所示。随培养时间增加,金黄色葡萄球菌出峰数迅速下降,之后快速上升,8h达到最大值,有60个峰,可检出化合物为47个,其后出峰数慢慢下降,16h后保持稳定。MVOCs出峰数的变化可能跟其生长周期相关,对数期最高,稳定期后出峰数保持恒定。
金黄色葡萄球菌MVOCs谱成分较多(表4),培养8h产生的区别于LB培养基的特征性挥发性成分为吲嗪、3-甲基丁酸和4-甲氧基苄腈。其中,吲嗪又称为中氮茚,是吲哚的异构体之一,具有强烈臭味,其衍生物在生物、医药等领域具有广泛的应用。研究结果表明,金黄色葡萄球菌的生长代谢产生了特征性的挥发性物质。
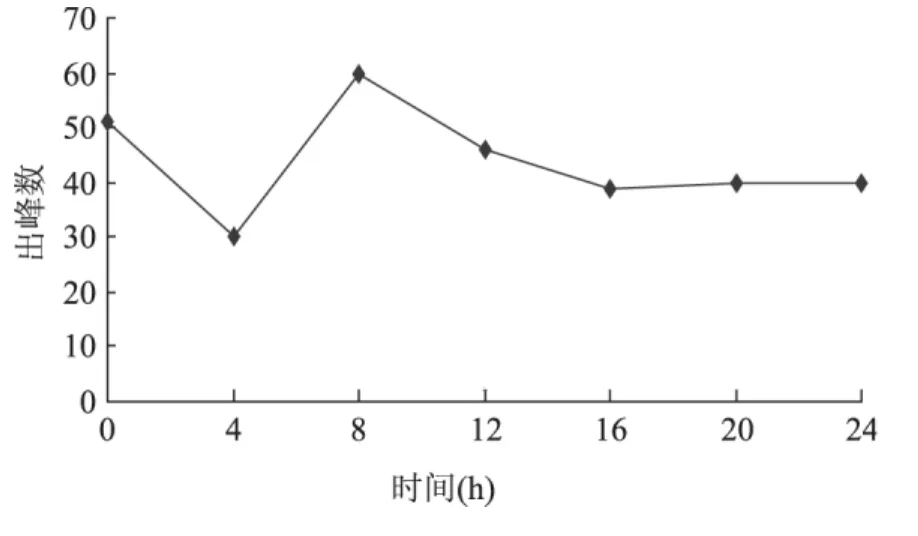
图6 金黄色葡萄球菌1.02465挥发性代谢产物变化规律Fig.6 The changes of volatile metabolites of Staphylococcus aureus
图7 金黄色葡萄球菌1.02465培养12h总离子流色谱图Fig.7 The total ion chromatograms of S.Aureus after 12h culture
3 结论
目前,SPMEGC-MS作为一种快速检测手段,已应用于食品风味和有害成分分析、食品微量元素检测、食品中农药和有机物残留及微生物MVOCs的快速定性、定量测定[7]。
不同微生物MVOCs谱区别较大,如链霉菌属和黄色粘球菌可分别产生26和42种挥发性代谢产物,本研究中两株副溶血弧菌MVOCs在30h有28和31种成分,大肠杆菌和金黄色葡萄球菌则分别为42和47种。随培养时间延长,微生物MVOCs谱逐渐变化[8],研究表明,这三种致病菌一般在对数期时MVOCs谱成分能达到最大值,稳定期后逐渐保持恒定,这可能是因为对数期细菌生长活跃、新陈代谢旺盛,所以产生的特征性代谢产物较多,因此当这三种致病菌污染食物时,应尽量在早期进行MVOCs谱测定。

续表

续表
每一个细菌都有其独特的MVOCs成分,如丙酮丁醇梭菌为丁酸和丙酮,嗜酸耐热菌的主要代谢产物为愈创木酚和2,6-二溴苯酚等[9],这些特征性成分可以检测该种细菌的生长和污染状况的标记物,从而建立细菌快速检测平台。如烟酸甲酯可以作为检测和诊断结核分枝杆菌的非侵入性方法,2-壬酮可以在体外作为检测铜绿假单胞菌感染肺炎的标记物[4],葡萄穗霉在任何培养基上都会产生苯甲醚作为特征性成分[5]。本研究发现,2-氯-4-(4-甲氧基苯基)-6-(4-硝基苯基)嘧啶、二叔丁基过氧化氢、3-甲基-1-丁醇等也许可以作为判断副溶血弧菌生长的标记物,环十二烷和吲嗪等也许能作为判断大肠杆菌和金黄色葡萄球菌污染肉类食品的标记物,但这还需要进一步的研究和比对。
运用GC-MS-SPME检测致病菌的特征性MVOCs,可建立肉制品和水产品的在线安全检测平台,具有无损、快速、样品用量低等优点,并能在早期及时发现其对牛肉、鸡肉等的污染程度,避免食物中毒,挽回经济损失,因此具有较好的发展前景[10]。
[1]Zhang ZM Zhang,Li GK.A Review of Advances and New Developments in the Analysis of Biological Volatile Organic Compounds[J].Microchemical Journal,2010,95:127-139.
[2]Hock B.The Mycota(IX):Fungal Associations[M].Berlin,Heidelberg:Springer-Verlag Berlin and Heidelberg GmbH&Co.K,2000.
[3]Kai M,Haustein M,Molina F,et al.Piechulla Bacterial Volatiles and TheirAction Potential[J].ApplMicrobiol Biotechnol,2009,81:1001-1012.
[4]Betancourt DA,Krebs K,Moore SA,et al.Microbial Volatile Organic Compound Emissions from Stachybotrys ChartarumGrowing on Gypsum Wallboard and Ceiling tile[J].BMC Microbiology,2013,13:283-289.
[5]许传坤,莫明和,张克勤.固相微萃取-气质法测定土壤挥发性抑菌物质[J].微生物学通报,2004,31(5):14-19.
[6]杨康,岳田利,袁亚宏,等.利用顶空SPME-GC-MS联用技术检测苹果汁中嗜酸耐热菌代谢产物的研究[J].农产品加工,2007,94(3):8-12.
[7]梁华正,张燮,饶军,等.微生物挥发性代谢产物的产生途径及其质谱检测技术[J].中国生物工程杂志,2008,28(1):124-33.
[8]金伟平,黄志强,刘群群.顶空固相微萃取-气质联用法分析单增李斯特菌污染冷藏牛肉的挥发性物质[J].食品科学,2012,33(2):243-248.
[9]Lemfack MC,Nickel J,Dunkel M,et al.mVOC:a Database of Microbial Volatiles[J].Nucleic Acids Research,2014(42):744-748.
[10]李雅萍,贺丽苹,陈玉芬,等.SPME-GC/MS联用技术分析蜂胶中挥发性成分的研究[J].现代食品科技,2007,23(7):78-80.
