C型凝集素受体树突细胞特异性捕获细胞间黏附分子3非整合素细胞表达模型的构建及功能研究
2014-12-11张宇姚煦顾汉艳王宝玺刘军
张宇 姚煦 顾汉艳 王宝玺 刘军
C型凝集素受体树突细胞特异性捕获细胞间黏附分子3非整合素细胞表达模型的构建及功能研究
张宇 姚煦 顾汉艳 王宝玺 刘军
目的构建C型凝集素受体树突细胞特异性捕获细胞间黏附分子3非整合素(DC-SIGN)细胞表达模型,为后续进行DC-SIGN蛋白受体功能研究提供基础。方法PCR扩增获得DC-SIGN分子的cDNA,克隆入真核表达载体p巨细胞病毒启动子-绿色荧光蛋白重组质粒(PCMV-EGFP),EGFP位于DCSIGN N末端,转染人胚肾细胞癌HEK 293T细胞后,流式细胞仪检测DC-SIGN重组分子的表达,激光共聚焦显微镜检测DC-SIGN-EGFP融合蛋白的细胞定位情况,并进一步检测转染表达的DC-SIGN受体对过敏原抗原的识别和内吞过程。结果构建的荧光融合蛋白重组表达质粒,经PCR及Western印迹证明DC-SIGN表达成功;经流式细胞仪检测转染DC-SIGN融合质粒的HEK293T细胞的DC-SIGN受体表达量增多(约50%)。重组表达质粒转染293T细胞后,激光共聚焦显微镜检测显示,绿色荧光标记的DC-SIGN位于细胞膜上,可结合红色荧光素标记的过敏原抗原Derp2,并可将Derp2内吞入细胞内。 结论 构建的DC-SIGN-EGFP融合蛋白在293T细胞内表达后具有细胞表面受体分子的特征性分布,可被DC-SIGN特异性抗体识别并具有摄取过敏原功能,是研究DC-SIGN分子功能的理想细胞模型。
受体,有丝分裂原;重组融合蛋白质类;抗原,尘螨属;细胞系,肿瘤
树突细胞(DC)特异性捕获细胞间黏附分子3非整合素(dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin,DC-SIGN)是新近发现的限制性表达于DC和某些组织巨噬细胞上的凝集素样受体[1],由于胞外区糖识别域(CRD)可以特异性识别抗原的糖基结构,故其自然配体非常广泛[2]。作为致病原受体,它可以与人类免疫缺陷病毒(HIV)、巨细胞病毒(CMV)、结核分枝杆菌和血吸虫等靶向结合,且大多数致病原与该受体靶向结合后的事件均与病情进展密切相关[1,3-4]。鉴于DCSIGN的DC限制性表达的特性和作为抗原受体的功能特点,推测DC-SIGN同样是富含多糖的过敏原抗原的靶受体。为了解DC-SIGN对过敏原抗原结合能力及内吞和提呈功能,我们构建DC-SIGN荧光融合蛋白真核表达质粒,转染工程细胞系人胚肾细胞癌HEK293T细胞获得瞬时表达,并以激光共聚焦显微镜和流式细胞仪等技术鉴定荧光融合蛋白的表达和功能。
材料与方法
一、材料
大肠杆菌DH5α(日本TaKaRa公司),DC-SIGN+pMD18-T质粒(北京义翘神州技术有限公司),p巨细胞病毒启动子-绿色荧光蛋白重组质粒(PCMVEGFP,上海吉玛技术有限公司),HEK 293T细胞株(美国模式菌种收集中心ATCC),Ex Taq酶、Pyrobest DNA Polymerase、T4 DNA 连接酶、HindⅢ和 BamHⅠ内切酶、质粒抽提试剂盒和DNA回收试剂盒(日本TaKaRa公司),BCA蛋白质定量试剂盒(上海碧云天生物技术公司),转染试剂阳离子脂质体Lipofectamine2000(美国Invitrogen公司),小鼠抗人DC-SIGN(美国Abcam公司),Alexa Fluor-647荧光染料(美国Invitrogen公司)。其余试剂均为国产分析纯。
二、方法
1.PCR方法得到DC-SIGN序列片段:PCR反应体系参照日本TaKaRa公司Ex Taq酶说明书,设50 μl体系。 DC-SIGN:上游引物:5'-GATATAAGCT TGCCACCATGAGTGACTCCAAGGAACCAAGACTG CA-3',下游引物:5'-GTATCGGATCCCTACGCAGG AGGGGGGTTTGGGGTG-3'。PCR反应条件:95℃变性3 min,94℃30 s,55℃30 s,72℃30 s,30个循环;最后72℃延伸5 min。PCR反应完成后,利用10 g/L琼脂糖凝胶电泳并切胶回收DC-SIGN基因片段。
2.重组DC-SIGN分子的克隆及鉴定:按照TaKaRa公司T4 DNA连接酶的说明,将PCMVEGFP质粒和DC-SIGN基因片段用HindⅢ和BamHⅠ酶切,10 g/L琼脂糖凝胶电泳后回收DC-SIGN基因片段和载体PCMV-EGFP。用T4 DNA连接酶连接双酶切得到的DC-SIGN基因片段和线性化的载体,22℃连接2 h。连接产物转化DH5α感受态细菌,分别以卡那霉素筛选,挑取单克隆抗性菌落扩增,小量抽提质粒并做酶切鉴定在1 215 bp对应区域有条带为阳性克隆,质粒送上海生工生物工程技术服务有限公司测序。构建成功的质粒图谱见图1。
3.真核表达质粒转染HEK 293T细胞:按照阳离子脂质体Lipofectamine说明书将构建的两个真核表达质粒转染HEK293T细胞,以PCMV空载体为对照。用DMEM培养基(含10%胎牛血清,不含青、链霉素)将HEK293T细胞形成单细胞悬液,按照每孔5×105个细胞接种于12孔细胞培养板,37℃5%CO2培养24 h细胞贴壁并达80%~90%融合时,用3 ml D-Hanks液洗涤细胞2次,加入1 ml DMEM培养基。用不完全DMEM培养基配转染试剂Lipofectamine及重组质粒,每孔加入 2 μl Lipofectamine 于 50 μl DMEM,0.89 μg质粒 DNA 于50 μl DMEM,质粒与脂质体终浓度比为 1 μg ∶2.25 μl。将两试剂室温混合20 min,将转染混合物逐滴加入已铺好细胞的12孔板中混匀后,5%CO237℃培养过夜,转染48 h观察结果。
4.激光共聚焦显微镜检测重组DC-SIGNEGFP融合蛋白的表达:将转染48 h的HEK293T细胞收集,PBS洗1次,按DC-SIGN磁珠分选(德国Miltenyi Biotic公司)说明书步骤,分离表达CD209受体的HEK293T细胞,将其继续培养12 h。4%多聚甲醛固定30 min;4',6-二眯基-2-苯基吲哚(DAPI)避光染色10 min后激光共聚焦显微镜检测荧光融合蛋白的表达。

图1 重组PCMV-EGFP-DC-SIGN质粒图谱 PCMV-EGFP:p巨细胞病毒启动子-绿色荧光蛋白质粒;DC-SIGN:树突细胞特异性捕获细胞间黏附分子3非整合素
5.PCR和Western印迹检测DC-SIGN基因及蛋白的表达:HEK293T细胞转染48 h后,收集细胞,用TRIzol试剂提取总mRNA,反转为cDNA后,用小片段DC-SIGN产物验证DC-SIGN表达。小片段DC-SIGN:上游引物5'-AAGTAACCGCTTCACCT GGATGG-3',下游引物5'-GGCAAGATTACATTTGT CGTCGTT-3';内参甘油醛-3-磷酸脱氢酶(GAPDH):上游引物5'-AGAAGGCTGGGGCTCAT TTG-3',下游引物5'-AGGGGCCATCCACAGTCTT C-3'。 PCR反应条件:95℃变性3 min;94℃30 s,55℃30 s,72℃30 s,30个循环;最后72℃延伸5 min。PCR反应完成后,利用10 g/L琼脂糖凝胶电泳观察扩增条带。另一部分细胞用PBS洗涤2次,用RIPA裂解液以及蛋白酶抑制剂和1 mmol/L苯甲基磺酰氟(PMSF,美国Sigma公司)抽提总蛋白,按BCA蛋白质定量试剂盒确定样品蛋白浓度。将蛋白依次上样后,转移PVDF膜,膜在2%BSA溶液中室温孵育1 h以封闭非特异性结合,应用终浓度为1.5 mg/L小鼠抗人DC-SIGN一抗孵育1.5 h,TBST缓冲液洗涤后加入过氧化物酶标记的羊抗鼠IgG(1∶500)与一抗结合,室温孵育1 h,增强化学发光法(ECL)试剂作用后ChemiDocXRS系统显影拍照。分析DCSIGN蛋白表达情况。
6.激光共聚焦显微镜检测融合蛋白对户尘螨过敏原的摄取:收获转染后48 h的HEK293T细胞。根据说明书步骤用新型荧光染料Alexa Fluor-647(Molecular Probes)标记nDer p 2天然纯化过敏原(美国Indoor Biotechnologies公司),标记后蛋白终浓度为0.6 g/L。加入20 mg/L Alexa Fluor-647标记的nDer p 2过敏原在37℃分别孵育15 min和45 min;用4%多聚甲醛固定25 min,PBS洗3次,加入DAPI核染色剂避光孵育10 min,用激光共聚焦显微镜检测荧光融合蛋白的表达。
结 果
一、EGFP-DC-SIGN融合基因表达载体的构建
PCR方法得到带有HindⅢ和BamHⅠ酶切位点的1 215 bp的DC-SIGN全长编码框,酶切后连接入PCMV-EGFP真核表达载体,构建出荧光蛋白位于DC-SIGN蛋白N末端的融合蛋白表达质粒PCMV-EGFP-DC-SIGN。将构建的重组质粒PCMVEGFP-DC-SIGN用HindⅢ和BamHⅠ酶切,电泳后得到2条片段,位置与理论值一致(1条为1 200 bp,1条为线性载体片段4 700 bp),说明克隆成功。将质粒送life公司测序,测序结果与DC-SIGN序列一致。
二、DC-SIGN荧光融合蛋白的表达
在HEK-293T细胞表达Lipofectamine2000阳离子脂质体转染重组质粒48 h后,激光扫描共聚焦显微镜检测到有绿色荧光表达,提示EGFP-DCSIGN融合蛋白表达质粒在HEK293T细胞中表达(图2)。小片段DC-SIGN扩增产物证实了DC-SIGN的表达(图3)。PCR反应完成后,琼脂糖凝胶电泳观察到280 bp处出现扩增条带。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析显示,在相对分子质量44 000处有条带,证明DC-SIGN有表达。流式细胞仪检测显示,转染EGFP-DC-SIGN融合蛋白表达质粒后,HEK293T细胞DC-SIGN表达率为78.89%,较未转染细胞(29.00%)上升近50%,表达(荧光)强度上升54.6%(1 063比483)。
三、DC-SIGN融合蛋白对户尘螨过敏原的摄取能力
见图4。在过敏原加入HEK293T细胞后15 min,有荧光素标记的过敏原结合于膜表面的DC-SIGNEGFP融合蛋白上。培养时间增至45 min时,荧光素标记的过敏原逐渐分布至细胞内部。当细胞预先用封闭性抗体DC-SIGN孵育30 min后,在45 min内未见过敏原结合及内吞。

图2 激光扫描共聚焦显微镜检测HEK293T细胞转染PCMV-EGFP-DC-SIGN重组质粒 2a:48 h后,细胞膜上绿色荧光(×400);2b:DAPI染色细胞核呈蓝色(×200);2c,2d:HEK293T细胞膜上有绿色荧光蛋白表达(×200) PCMV-EGFP:p巨细胞病毒启动子-绿色荧光蛋白质粒;DC-SIGN:树突细胞特异性捕获细胞间黏附分子3非整合素
讨 论
DC是专职性抗原提呈细胞,是机体免疫应答的始动者,其表面表达的多种模式识别受体备受关注。其中,特异性识别富含糖基结构抗原的C型凝集素受体是DC表面的一大类重要的模式识别受体[5]。研究发现,DC-SIGN在介导病原微生物致病和肿瘤免疫逃逸等方面发挥作用[5-6]。DC-SIGN属Ⅱ型跨膜蛋白,其C末端位于胞外区,而N末端位于胞内区,胞外区CRD蛋白表面的两个环形突起形成2个Ca2+结合位点:一个在CRD构型及协调其结合糖类配体中发挥重要作用;另一个在糖类配体结构的空间定位上起关键作用。CRD可识别结合含甘露糖以及含岩藻糖成分病原体或过敏原。胞质结构域主要包括一些内化基序[7]。体外结合试验显示,DC-SIGN受体可与多种富含多糖结构的过敏原抗原特异性结合。但是体外结合试验不能代表活体细胞真实情况,本实验进行DC-SIGN细胞表达模型的构建,旨在为后续进行功能研究提供细胞模型。
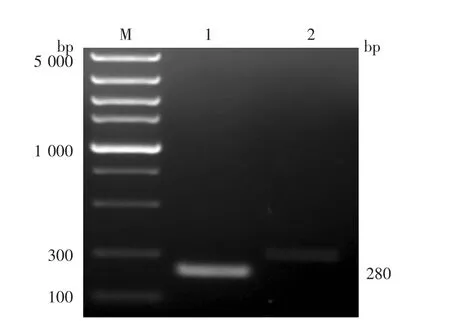
图3 PCR检测转染后HEK293T细胞中树突细胞特异性捕获细胞间黏附分子3非整合素(DC-SIGN)的表达 M:标准参照物;1:DC-SIGN小片段验证产物,约280 bp;2:甘油醛-3-磷酸脱氢酶内参照

图4 树突细胞特异性捕获细胞间黏附分子3非整合素(DCSIGN)受体对Alexa Fluor-647标记的nDer p 2过敏原的结合和内吞(×800) 4a:4b~4d的重叠图;4e:4f~4h的重叠图。蓝色荧光为4',6-二眯基-2-苯基吲哚染色标记定位细胞核,绿色荧光代表DCSIGN受体表达于细胞膜表面,红色荧光代表Der p 2过敏原
构建荧光融合表达蛋白是进行分子细胞内示踪的常见方法,但必须使重组质粒获得表达后仍然具有天然分子分布特征和生物学功能。文献报道[8],将荧光蛋白EGFP置于DC-SIGN的C末端可能会影响DC-SIGN对配体的识别,故我们将EGFP置于DC-SIGN的N末端构建荧光融合蛋白重组表达质粒,经PCR及Western印迹检测证明DC-SIGN表达成功;经流式细胞仪检测DC-SIGN受体表达增高。HEK293T细胞系是常见的工程细胞,微弱或不表达Toll样受体,少量表达C型凝集素受体,故我们选择HEK293T细胞系为转染细胞。转染后发现,DC-SIGN的表达水平增加50%,可用来作为DCSIGN细胞模型来进行后续功能研究。
本研究证实,融合蛋白表达后绿色荧光主要位于细胞膜上,流式细胞仪检测转染DC-SIGN融合质粒的HEK293T细胞DC-SIGN受体表达量增多,表达融合DC-SIGN蛋白在15 min时可结合红色荧光标记的Derp2抗原,后者与融合蛋白的绿色荧光有较好的共聚现象,45 min观察时红色荧光已经内吞进入胞内,红色荧光与核染色的蓝色荧光出现共聚现象。
[1]Geijtenbeek TB,Den Dunnen J,Gringhuis SI,et al.Pathogen recognition by DC-SIGN shapes adaptive immunity[J].Future Microbiol,2009,4(7):879-890.
[2]Lee RT,Hsu TL,Huang SK,et al.Survey of immune-related,mannose/fucose-binding C-type lectin receptors reveals widely divergent sugar-binding specificities[J].Glycobiology,2011,21(4):512-520.
[3]de Jong MA,de Witte L,Bolmstedt A,et al.Dendritic cells mediate herpes simplex virus infection and transmission through the C-type lectin DC-SIGN[J].J Gen Virol,2008,89(10):2398-2409.
[4]Gringhuis SI,den Dunnen J,Litjens M,et al.Carbohydratespecific signaling through theDC-SIGN signalosometailors immunity to Mycobacterium tuberculosis,HIV-1 and Helicobacter pylori[J].Nat Immunol,2009,10(10):1081-1088.
[5]Geijtenbeek TB,Van Vliet SJ,Engering A,et al.Self-and nonself-recognition by C-type lectins on dendritic cells[J].Annu Rev Immunol,2004,22(4):33-54.
[6]Hsu SC,Chen CH,Tsai SH,et al.Functional interaction of common allergens and a C-type lectin receptor,dendritic cellspecific ICAM3-grabbing non-integrin(DC-SIGN),on human dendritic cells[J].J Biol Chem,2010,285(11):7903-7910.
[7] 张宇,姚煦.与皮肤过敏性疾病相关的C凝集素受体介导的信号传导通路研究现状[J].国际皮肤性病学杂志,2011,37(4):249-251.
[8]王靖雪,张小萍,贾正才,等.DC-SIGN荧光融合蛋白的构建、表达和生物学功能初探[J].免疫学杂志,2006,22(4):370-373.
2013-09-02)
(本文编辑:尚淑贤)
A cellular model for the expression of the C-type lectin dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin:construction and functional analysis
Zhang Yu*,Yao Xu,Gu Hanyan,Wang Baoxi,Liu Jun.*Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
s:Yao Xu,Email:dryao_xu@126.com;Liu Jun,Email:drliu_jun@126.com
ObjectiveTo establish a cellular model for the expression of the C-type lectin dendritic cellspecific intercellular adhesion molecule-3-grabbing non-integrin (DC-SIGN),and to provide a basis for the functional analysis of DC-SIGN.MethodsThe cDNA of DC-SIGN was obtained via PCR,and cloned into the eukaryotic expression vector porcine cytomegalovirus-enhanced green fluorescent protein(PCMV-EGFP)with EGFP at the N terminal of DC-SIGN.Then,the recombinant PCMV-EGFP-DC-SIGN plasmid was transfected into HEK293T cells followed by the detection of DC-SIGN expression using PCR,Western blot and flow cytometry.Confocal microscopy was performed to localize the expression of DC-SIGN-EGFP and visualize the recognization and internalization of the Derp2 allergen by DC-SIGN.ResultsThe recombinant fluorescent fusion protein-expressing plasmid was successfully constructed.Both PCR and Western blot confirmed the expression of DC-SIGN.Flow cytometry showed that the expression of DC-SIGN was increased by approximately 50%in HEK293T cells transfected with the recombinant expression plasmid compared with those untransfected.As confocal microscopy showed,the green fluorescence-labelled DC-SIGN was located on the cell membrane,which could bind to the red fluorescence-labelled antigen Derp2 and internalize it into the cells.ConclusionsThe recombinant DC-SIGNEGFP fusion protein is characteristically located on the surface of 293T cells,which can be recognized by the DCSIGN-specific antibody and is capable of internalizing the allergen Derp2,and may serve as an ideal cell model for further studies on molecular function of DC-SIGN.
Receptors,mitogen;Recombinant fusion proteins;Antigens,dermatophagoides;Cell line,tumor
10.3760/cma.j.issn.0412-4030.2014.07.002
国家自然科学基金(81171501);江苏省自然科学基金(BK2011127)
210042南京,中国医学科学院北京协和医学院皮肤病研究所(张宇、姚煦、顾汉艳、王宝玺);南京大学医学院附属鼓楼医院皮肤科(刘军)
姚煦,Email:dryao_xu@126.com;刘军,Email:drliu_jun@126.com
