小RNA转染人外周血原代T淋巴细胞的转染试剂筛选
2014-11-30张群庞国进刘天会王萍马雪梅尤红丛敏
张群,庞国进,刘天会,王萍,马雪梅,尤红,丛敏
mRNA 发生特异性降解,导致靶基因表达抑制或沉默,引起相应的功能表型缺失,属于转录后的基因沉默机制[1-2],在各个领域的特定基因沉默研究中应用广泛[3]。双链 RNA 即小干扰 RNA(small interfering RNA,siRNA),通过引入双链 RNA 引发特定靶基因沉默,比基因敲除技术更方便、快捷地显示出基因的功能,已成为分子生物学领域最热门的研究课题之一[4-5]。
T 淋巴细胞是发挥机体免疫功能最重要的一大细胞群,具有促进或者调节机体细胞免疫及体液免疫的功能。通过 siRNA 的方法干扰人外周血原代 T 淋巴细胞特定基因的表达,从而抑制 T 淋巴细胞相应的功能或表型,对于研究 T 淋巴细胞特定基因的功能以及对 T 淋巴细胞功能的临床干预等具有重要意义。但是,人外周血 T 淋巴细胞属于原代悬浮细胞,化学合成的 siRNA 转染进入细胞的转染效率较低[6]。已有研究报道可采用Lipofectamine 2000 和 Lipofectamine RNAiMAX将化学合成的 siRNA 转染进入原代细胞或悬浮细胞[7-9]。FuGENE6、Hiperfect 和 EntransterTM-R 依其试剂盒说明书也可进行原代细胞 siRNA 的转染。为探讨不同转染试剂的转染效率,我们采用上述 5 种转染试剂介导荧光标记的对照 RNA 转染人外周血 T 淋巴细胞,筛选出介导 RNA 转染人外周血 T 淋巴细胞效率较高的转染试剂EntransterTM-R,证明其能够有效介导人工合成RNA 转染人外周血原代 T 淋巴细胞,可作为今后进行特定基因的 siRNA 转染原代 T 淋巴细胞的实验依据。
1 对象与方法
1.1 研究对象和材料
1.1.1 对象 本研究共采集 10 例健康志愿者,由同例志愿者的 T 淋巴细胞完成同组实验,所有实验均通过医院伦理委员会批准并取得献血者的知情同意书。
1.1.2 主要试剂 RPMI 1640 培养基和胎牛血清均购自美国 Gibco 公司;淋巴细胞分离液(Ficoll液)购自美国 GE Health 公司;人 T 细胞富集液购自美国 Stem Cell 公司;CD3 抗体购自美国BD 公司;荧光标记的 siRNA BLOCK-iT™ Alexa Fluor®Red Fluorescent Oligo(对照 RNA),转染试剂 Lipofectamine 2000、RNAiMAX 均购自美国 Invitrogen 公司;转染试剂 FuGENE6 购自美国Promega 公司;Hiperfect 购自德国 Qiagen 公司;转染试剂 EntransterTM-R 购自英格恩生物公司。
1.2 方法
1.2.1 人外周血原代 T 淋巴细胞的分离 健康成年人外周血,肝素抗凝,加人 T 细胞富集液后用Ficoll 液分离获得 T 淋巴细胞。取 1×106个细胞重悬于 100 μl PBS,加 CD3 抗体 5 μl,室温孵育20 min,PBS 洗涤后采用流式细胞仪检测 T 淋巴细胞纯度。其余细胞重悬于 RPMI 1640 培养基[含10%(体积分数)胎牛血清]中,以 2×105个/孔的浓度种于 24 孔板,于 37 ℃,5%(体积分数)CO2培养箱中培养 24 h 后用 RNA 试剂转染。
1.2.2 5种不同转染试剂转染效率评价 各个转染试剂组分别设单加转染试剂组(对照组)和加转染试剂及荧光标记 RNA 组(实验组)。实验组分别按照 Lipofectamine 2000、Lipofectamine RNAiMAX、FuGENE6、Hiperfect 以及 EntransterTM-R 转染试剂盒操作指南进行 T 淋巴细胞转染,对照 RNA浓度为 100 nmol/L,转染试剂按照试剂盒操作指南推荐剂量进行转染。转染 6 h 后洗涤细胞并重悬于RPMI 1640 培养基(含 10% 胎牛血清),在 37 ℃,5% CO2培养箱中继续培养。转染后 24 h 在荧光显微镜下观察转染情况并收集细胞进行流式检测,筛选出转染效率较高的转染试剂。
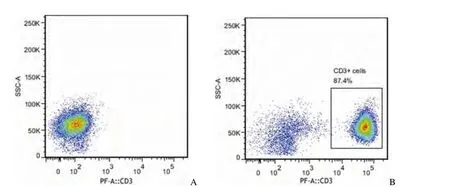
图1 经人 T 细胞富集液试剂盒分离的细胞中 CD3+T 细胞的纯度(A:细胞经 PE-同型抗体标记后流式检测图;B:细胞经 anti-CD3 Ab-PE 标记后流式检测图)Figure1 The purity of CD3+T cells isolated by human T cell enrichment cocktail (A: PE-isotype labeled cells; B: Anti-CD3 antibody-PE labeled cells)
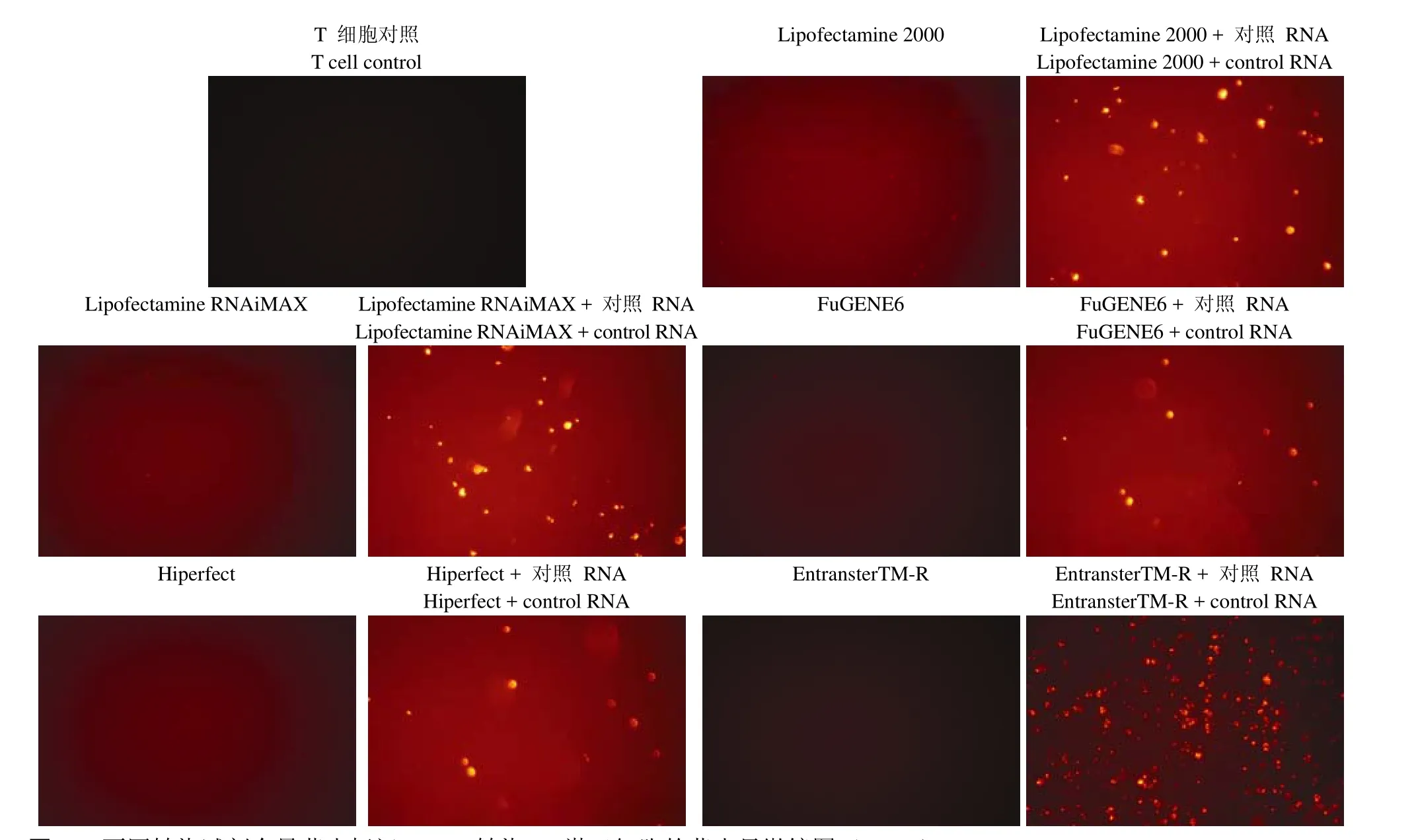
图2 不同转染试剂介导荧光标记 RNA 转染 T 淋巴细胞的荧光显微镜图(× 200)Figure2 T-lymphocytes tranfected by fluorescently labeled RNA using different transfection reagents (× 200)
采用 EntransterTM-R 介导对照 RNA 转染人T 淋巴细胞,对照 RNA 浓度与 EntransterTM-R 的配比分别为 100 nmol/L、2 μl 和 50 nmol/L、1 μl。转染 6 h 后洗涤细胞并重悬于 RPMI 1640 培养基(含 10% 胎牛血清),在 37 ℃,5% CO2培养箱中继续培养。转染后 24 h 在荧光显微镜下观察转染情况并收集细胞进行流式检测,比较两种转染条件下细胞状态和转染效率的差异。
采用 EntransterTM-R 介导对照 RNA 转染人T 淋巴细胞,对照 RNA 浓度为 100 nmol/L,EntransterTM-R 2 μl。转染 6 h 后洗涤细胞并重悬于RPMI 1640 培养基(含 10% 胎牛血清),在 37 ℃,5% CO2培养箱中继续培养。分别于转染后 24、48、72 h 收集细胞进行流式检测。
1.3 统计学处理
采用 SPSS17.0 软件进行统计分析,多组间比较采用 One-Way ANOVA,多组间两两比较采用LSD-t 检验,P < 0.05 为差异有统计学意义。
2 结果
2.1 人外周血 T 淋巴细胞分离鉴定
采用人 T 细胞富集液分离人外周血 T 淋巴细胞,流式检测 T 淋巴细胞纯度较高,达到 87.4%(图 1)。
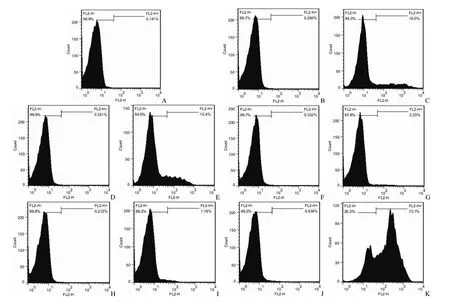
图3 不同转染试剂介导荧光标记 RNA 转染 T 淋巴细胞的流式检测图(A:T 细胞对照;B:Lipofectamine 2000 对照;C:Lipofectamine 2000 转染对照 RNA;D:Lipofectamine RNAiMAX 对照;E:Lipofectamine RNAiMAX 转染对照 RNA;F:FuGENE6 对照;G:FuGENE6 转染对照 RNA;H:Hiperfect 对照;I:Hiperfect 转染对照 RNA;J:EntransterTM-R 对照;K:EntransterTM-R 转染对照 RNA)Figure3 The transfection efficiency of fluorescently labeled RNA in T-lymphocytes by different transfection reagents detected by flow cytometry (A: T cell control; B: Lipofectamine 2000 control; C: Control RNA transfected by Lipofectamine 2000; D:Lipofectamine RNAiMAX control; E: Control RNA transfected by Lipofectamine RNAiMAX; F: FuGENE6 control; G: Control RNA transfected by FuGENE6; H: Hiperfect control; I: Control RNA transfected by Hiperfect; J: EntransterTM-R control; K: Control RNA transfected by EntransterTM-R)
2.2 5 种转染试剂的转染效率
采用 5 种转染试剂介导对照 RNA(100 nmol/L)转染人外周血原代 T 淋巴细胞,转染后 24 h 在荧光显微镜下观察,Lipofectamine 2000、Lipofectamine RNAiMAX、FuGENE6、Hiperfect 组带有荧光标记的细胞较少,收集细胞进行流式检测,转染效率分别为(14.81 ± 1.03)%、(14.33 ± 1.24)%、(2.10 ±0.16)%、(1.69 ± 0.08)%;EntransterTM-R 组带有红色荧光标记的细胞较多,流式检测转染效率为(72.24 ± 1.26)%,分别与其他 4 种转染试剂的转染效率进行比较,P < 0.05,差异有统计学意义(图 2~4)。
2.3 EntransterTM-R 转染的最佳条件
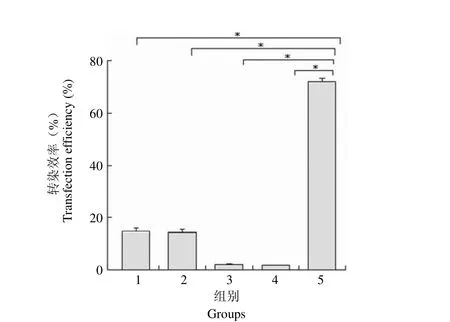
图4 不同转染试剂介导荧光标记 RNA 转染 T 淋巴细胞的转染效率Figure4 The transfection efficiency of fluorescently labeled RNA in T-lymphocytes by different transfection reagents
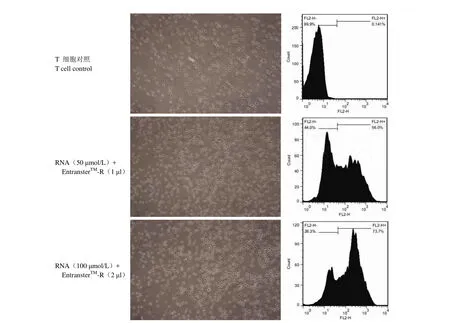
图5 EntransterTM-R 介导不同浓度荧光标记 RNA 转染的显微镜图(× 200)和流式检测图Figure5 Microscopic appearance and transfection efficiency detected by flow cytometry of 50 and 100 nmol/L fluorescently labeled RNA in T-lymphocytes by EntransterTM-R (× 200)
分别采用对照 RNA 浓度与 EntransterTM-R的配比为 100 nmol/L、2 μl 和 50 nmol/L、1 μl转染人外周血原代 T 淋巴细胞,24 h 后显微镜下观察两种转染条件下的细胞状态相差不大,均较为良好;流式检测转染效率分别为 73.7% 和56.0%(图 5)。随后,我们采用对照 RNA 浓度100 nmol/L、EntransterTM-R 2 μl 的条件转染人外周血原代 T 淋巴细胞,分别于转染后 24、48、72 h 收集细胞进行流式检测,荧光标记阳性细胞比例分别为 73.3%、62.0%、56.6%(图 6)。说明EntransterTM-R 介导荧光标记对照 RNA 转染人外周血原代 T 淋巴细胞的转染效率较高,而且转染后随时间延长荧光标记阳性细胞比例虽然有所下降,但是 72 h 后仍可以保持较高水平。
3 讨论
RNAi 是生物进化过程中一种广泛存在而且保守的机制[10]。在植物、昆虫、原生动物以及哺乳动物等几乎所有的真核细胞中,都发现了自然存在的RNAi 现象。RNAi 能够引起转录后基因沉默,是机体的一种天然防御本能。采用 20 多个核苷酸组成的短的双链 RNA(siRNA)代替传统反义核酸进行转录后基因沉默的 RNAi 技术已经迅速而广泛地应用到基因功能、基因表达调控机制研究等热门领域[11-15]。
siRNA 因其带有较高的负电荷,不能自动跨过细胞膜进入细胞内,限制了其进一步的应用[16-17]。因此,有研究设计并合成了用于携带 siRNA 进入细胞的转染试剂,例如脂质体、胆固醇和多肽类等[18]。然而,这些转染试剂主要用于细胞系细胞和贴壁细胞的转染,转染原代细胞尤其原代悬浮细胞的研究较少。而原代培养因其细胞离体时间短,生物学特性和遗传学特性与体内更为接近,更适合于细胞功能、致病机制及药物治疗等的实验性研究。尽管转染效率与转染试剂、细胞种类、生长状态、转染方法及 siRNA 浓度等条件密切相关[19],但在其他条件一致的情况下,为确保转染的高效性,需要选择一种可靠的转染试剂,使之对人外周血原代T 淋巴细胞能够发挥最佳效果。因此选择合适的转染试剂介导化学合成 RNA 进入人外周血原代T 淋巴细胞是 RNA 干扰的关键步骤。
本实验从人外周血中分离培养原代 T 淋巴细胞,以其作为实验材料,通过观察不同转染试剂介导的荧光标记的长度为 21~23 个核苷酸的对照RNA 的转染效率,筛选出可用于后续转染 siRNA的最佳转染试剂,将为 T 淋巴细胞特定基因功能的研究提供更加理想的辅助手段。
以往有关原代 T 细胞转染的相关研究较少,张恒辉等[7]将不同浓度的 siRNA 经 Lipofectamine 2000 转染人外周血新鲜分离的调节性 T 细胞,发现在 20 nmol/L 浓度下 siRNA 转染效率可达到41.7%;孙磊等[8]对人外周血分离的调节性 T 细胞扩增、传代、培养 2~3 周后的细胞经 Lipofectamine 2000 进行 siRNA(150 nmol/L)转染,FACS 检测最高可获得 68.1% 的转染效率。李兴花等[9]将带绿色荧光的 siRNA 经 Lipofectamine RNAiMAX 转染人外周血分选的 CD4+CD25-T 淋巴细胞,转染效率最高为(50.8 ± 0.61)%;王玉洁等[20]研究表明Lipofectamine RNAiMAX 是最适合介导化学合成siRNA 转染原代肝癌细胞的转染试剂。本实验在其他条件稳定的基础上,选择已经用于介导 siRNA转染多种细胞的下列 5 种转染试剂:Lipofectamine 2000、Lipofectamine RNAiMAX、FuGENE6、Hiperfect 以及 EntransterTM-R,24 h 后在荧光显微镜下观察带有荧光标记的细胞并通过流式细胞仪检测荧光标记细胞所占总细胞的比率,以评价 5 种试剂的转染效率。结果显示 Lipofectamine 2000、Lipofectamine RNAiMAX、FuGENE6、Hiperfect 的转染效率均较低,低于 20%,与以往文献[7-9]报道结果不一致,考虑原因可能是研究细胞不完全相同,尤其是文献[8]中的人外周血分离调节性 T 淋巴细胞为经扩增、传代、培养 2~3 周后的细胞,细胞特性不同于本研究中的人原代 T 淋巴细胞。EntransterTM-R 是一种 siRNA 专用转染试剂,由纳米高分子聚合物组成,其分子内含有许多氨基,在生理 pH 下会发生质子化,这些质子化的氨基可以中和 siRNA 表面的负电荷,可转染原代细胞、悬浮细胞等传统难转染细胞。在本实验中,EntransterTM-R 对新鲜分离的原代 T 细胞的转染效率较高,能够达到 70% 以上。
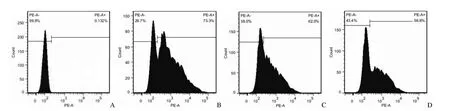
图6 EntransterTM-R 介导荧光标记 RNA 转染 T 淋巴细胞 24、48、72 h 后荧光阳性细胞率的变化(A:T 细胞对照;B:24 h;C:48 h;D:72 h)Figure6 Percentage of fluorescence positive cells after 24, 48, 72 h transfection by EntransterTM-R (A: T cell control; B: 24 h; C:48 h; D: 72 h)
本实验发现在对照 RNA 浓度与 EntransterTM-R的配比为 100 nmol/L、2 μl 和 50 nmol/L、1 μl 两种转染条件下,T 淋巴细胞状态均较为良好,而前者(73.7%)转染效率显著高于后者(56.0%),因此,确定采用化学合成的 RNA 浓度 100 nmol/L、EntransterTM-R 2 μl 的条件来介导 T 淋巴细胞转染;不仅具有较高的转染效率,同时并不具有更高的细胞毒性,而较低的细胞毒性对 RNAi 实验尤其重要。此外,本实验通过检测 RNA 浓度 100 nmol/L、EntransterTM-R 2 μl 的条件转染 T 淋巴细胞后24、48、72 h 的荧光标记阳性细胞比例,发现转染后随时间延长荧光标记阳性细胞比例虽然有所下降,但是 72 h 后仍可以保持较高水平(56.6%)。
因此,EntransterTM-R 能够有效介导人工合成RNA 转染人外周血原代 T 淋巴细胞,可以作为后续 siRNA 转染原代 T 淋巴细胞的有效转染试剂。
[1] Fire A, Xu S, Montgomery MK, et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans.Nature, 1998, 391(6669):806-811.
[2] Hammond SM, Bernstein E, Beach D, et al.An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells.Nature, 2000, 404(6775):293-296.
[3] Wang SY, Liu YY, Mu R, et al.New advances in RNA interference technology.Chin Med Biotechnol, 2009, 4(5):377-380.(in Chinese) 王世瑶, 刘燕鹰, 穆荣, 等.RNA干扰技术新进展.中国医药生物技术, 2009, 4(5):377-380.
[4] Tuschl T, Borkhardt A.Small interfering RNAs: a revolutionary tool for the analysis of gene function and gene therapy.Mol Interv, 2002,2(3):158-167.
[5] Caplen NJ, Parrish S, Imani F, et al.Specific inhibition of gene expression by small double-stranded RNAs in invertebrate and vertebrate systems.Proc Natl Acad Sci U S A, 2001, 98(17):9742-9747.
[6] Elbashir SM, Harborth J, Weber K, et al.Analysis of gene function in somatic mammalian cells using small interfering RNAs.Methods,2002, 26(2):199-213.
[7] Zhang HH, Fei R, Xie XW, et al.Specific suppression in regulatory T cells by Foxp3 siRNA contributes to enhance the in vitro anti-tumor immune response in hepatocellular carcinoma patients.J Peking Univ (Health Sci), 2009, 41(3):313-318.(in Chinese)张恒辉, 费然, 谢兴旺, 等.Foxp3 siRNA 特异性抑制肝癌患者调节性 T细胞进而增强抗肿瘤免疫应答的体外实验研究.北京大学学报(医学版), 2009, 41(3):313-318.
[8] Sun L, Yi SN, Chen L.Effects of Foxp3 knockdown on the functions of human regulatory T cells.Natl Med J China, 2011, 91(30):2124-2128.(in Chinese)孙磊, 易寿南, 陈丽.下调Foxp3基因表达对人调节性T细胞功能的影响.中华医学杂志, 2011, 91(30):2124-2128.
[9] Li XH, He M, Yu YH, et al.Expression of mixed-lineage leukemia 1 gene in human CD4+ CD25-T cells inhibited by specific small interfering RNA.J Appl Clin Pediatr, 2011, 26(21):1664-1667.(in Chinese)李兴花, 何敏, 于艳辉, 等.小干扰 RNA干扰人 CD4+CD25-T淋巴细胞MLL1基因的表达.实用儿科临床杂志, 2011, 26(21):1664-1667.
[10] McManus MT.Small RNAs and immunity.Immunity, 2004, 21(6):747-756.
[11] de Fougerolles A, Vornlocher HP, Maraganore J, et al.Interfering with disease: a progress report on siRNA-based therapeutics.Nat Rev Drug Discov, 2007, 6(6):443-453.
[12] Kim DH, Rossi JJ.Strategies for silencing human disease using RNA interference.Nat Rev Genet, 2007, 8(3):173-184.
[13] Wang QF, Li K, Li Z, et al.The biological effect of Tak1 knockdown in mouse peritoneal macrophage by Tak1 siRNA transfection.Chin Med Biotechnol, 2011, 6(1):36-39.(in Chinese)王钦富, 李坤, 李志, 等.靶向Tak1基因的siRNA干扰对小鼠腹腔巨噬细胞的生物学效应.中国医药生物技术, 2011, 6(1):36-39.
[14] Gan L, Li J, Guo K, et al.The effects of stathmin on cell proliferation and tumor-related genes expressions in HCCLM3 cells.Chin J Hepatol, 2011, 19(8):571-576.(in Chinese)甘淋, 李娟, 郭坤, 等.Stathmin对肝癌细胞HCCLM3增殖及其肿瘤相关基因表达的影响.中华肝脏病杂志, 2011, 19(8):571-576.
[15] Dong GC, Le J, Geriletul B.Effect of siRNA-interfered transmembrane protein 21 expression on γ-secretase activity in embryonic fibroblast cells of KO mice.Chin Med Biotechnol, 2008,3(2):126-130.(in Chinese)董贵成, 乐江, 博•格日勒图.siRNA干扰跨膜转运蛋白21的表达对KO小鼠胚胎成纤维细胞γ分泌酶活性的影响.中国医药生物技术, 2008, 3(2):126-130.
[16] Bumcrot D, Manoharan M, Koteliansky V, et al.RNAi therapeutics: a potential new class of pharmaceutical drugs.Nat Chem Biol, 2006,2(12):711-719.
[17] Behlke MA.Chemical modification of siRNAs for in vivo use.Oligonucleotides, 2008, 18(4):305-319.
[18] Whitehead KA, Langer R, Anderson DG.Knocking down barriers:advances in siRNA delivery.Nat Rev Drug Discov, 2009, 8(2):129-138.
[19] Eguchi A, Meade BR, Chang YC, et al.Efficient siRNA delivery into primary cells by a peptide transduction domain-dsRNA binding domain fusion protein.Nat Biotechnol, 2009, 27(6):567-571.
[20] Wang YJ, Wu SJ, Wu Q.Transfection agents screening for chemosynthesis siRNA transfection to primary liver cancer cells.J Clin Rehabili Tissue Eng Res, 2011, 15(2):245-248.(in Chinese)王玉洁, 吴韶菊, 吴芹.筛选介导化学合成siRNA转染原代肝癌细胞的最佳试剂.中国组织工程研究与临床康复, 2011, 15(2):245-248.
