单克隆抗体电荷异构体分离方法优化
2014-11-01程洪杰马珂秦国宏张道平张弢王旻
程洪杰,马珂,秦国宏,张道平,张弢,王旻
单克隆抗体电荷异构体分离方法优化
程洪杰,马珂,秦国宏,张道平,张弢,王旻
210009 南京,中国药科大学生命科学与技术学院(程洪杰、王旻);210042 南京,江苏先声药业有限公司(程洪杰、马珂、秦国宏、张道平、张弢)
单克隆抗体是复杂的四聚体糖蛋白,常呈现微观不均一性,即“异质性”,包括电荷、疏水、形态等相关的异构体[1]。这些异构体可能来自于抗体分子复杂的生物合成途径,如细胞系及培养工艺[2],也可能来自于纯化、制剂等制造过程以及贮存过程的任何阶段[1]。其中由于抗体分子所带电荷差异造成的异质性称为电荷异构体,一般分为酸性异构体和碱性异构体,产生原因主要与翻译后修饰有关。电荷异构体宏观表现为在等电聚焦电泳图上出现弥散或多个条带;离子交换色谱图主峰前后出现小峰。由于这些异构体可能会影响抗体的稳定性、药效、免疫原性或药代动力学,特征性地识别和分离电荷异构体是至关重要的。基因泰克公司曾对上市抗体及临床前抗体药物关于电荷变化产生的药效、药代等方面的影响做过一个总结,结果表明:①当电荷变异超过一个 pH 单位时,会影响药物的组织分布及药代动力学;②增加正电荷,会提高药物的组织停滞,降低血液清除;③降低正电荷,会减少药物的组织停滞,提高药物的全身清除[3]。因而分离电荷异构体,得到均一性质的抗体是一个关键的挑战,尤其在生物类似物开发过程中应尽可能控制异构体含量与原研药保持一致。
在众多分离手段中,离子交换层析被认为是最有前景的方法[4]。有研究表明,依赖 pH 变化的分离方式比依赖离子强度变化的分离方式效果更好[5-6]。近年来不断有研究者通过 pH 梯度洗脱方式分离电荷异构体。Pabst 等[7]通过控制缓冲液中 Tris、双 Tris 丙烷、组氨酸、乙醇胺的比例,而 Farnan 和 Moreno[8]通过调节缓冲液中哌嗪、咪唑和 Tris 的比例,均实现了 pH 梯度洗脱,成功分离出抗体的电荷异构体,但整个工艺较为复杂,pH 控制不稳定。近些年,置换色谱凭借其出色的分离能力,已成功被应用于分离抗体电荷异构体、寡糖、多肽、小分子化合物。但商品化的阳离子层析置换剂 Sachem Expell SP1 成本较高,且伴随着碱性异构体的洗脱过程亦有部分置换剂被洗脱[9],也带来一定的安全隐患,此外,置换序列的监测是一项耗时、难度较大的工作,这些均阻碍其应用到生产中。
本课题组经 CHO 细胞表达,Protein A 亲和层析、SP-FF 阳离子层析已制备纯度达 95% 以上的单克隆抗体 IgG1,但阳离子层析动态载量较小且洗脱样品酸性异构体含量偏高(≈ 20%),不符合质控标准(< 18%)。本研究通过层析介质筛选得到动态结合载量高、分辨率好的层析介质。依据酸性异构体 pI(7.23)小于目的组分 pI(7.34),参考 pH 梯度洗脱的原理,在原工艺上增加一步预洗步骤,特异性去除酸性异构体,从而降低最终样品的酸性异构体含量。
1 材料与方法
1.1 材料
1.1.1 单克隆抗体溶液 CHO 细胞发酵液经 Protein A 纯化,低 pH 值孵育,并用 Tris 中和至 pH 5.8,浓度约 9.13 mg/ml。经毛细管等电聚焦电泳测定,酸性异构体 pI = 7.23,目的组分 pI = 7.34,碱性异构体 pI = 7.47。
1.1.2 层析柱 Poros XS 购自美国Thermo Fisher Scientific 公司;Nuvia S购自美国Bio-Rad 公司;HiTrap SP-FF购自美国GE health 公司;Eshmuno S、Fractogel-EMD SO3-(M)、Fractogel-SE Hicap(M) 均购自德国Merck 公司;HPLC-SEC 为美国Sepax-technologies 公司产品,保护柱为Zenix SEC-300,50 mm × 7.8 mm,粒径3 μm;分析柱为300 mm × 7.8 mm ,粒径3 μm;HPLC-IEC 为美国Thermo Fisher Scientific 公司产品,分析柱为Propac WCX-10,250 mm × 4 mm。
1.1.3 试剂 Tris 购自美国Amresco 公司;NaH2PO4·H2O、Na2HPO4·12H2O、NaCl、HCl 等为国产分析纯试剂;纯水由美国Barnstead 公司超纯水仪制备。
1.1.4 仪器 ÄKTA purifier 蛋白纯化仪为美国GE Healthcare 公司生产,检测波长为280 nm;pH 计为瑞士MettlerToledo 公司产品;Agilent1260 型高效液相色谱仪为美国Agilent 公司产品;Genesys 10UV 紫外可见分光光度仪为美国Thermo Fisher Scientific 公司产品;台式高速离心机为德国Eppendorf 公司产品。
1.2 方法
1.2.1 介质动态载量测定 以20 mmol/L PB(pH 5.8)为上样缓冲液平衡层析柱,取Protein A 亲和后样品,20 mmol/L PB(pH 5.8)稀释至2 mg/ml,先流经旁路使紫外吸收值达到平台期后,样品进入层析柱,以穿透样品紫外吸收值达到平台期的10% 计算动态结合载量(DBC)。流速与各层析柱体积匹配,使保留时间为1 min。
DBC(mg/ml)=(VA× CO)/VC
VA表示穿透样品紫外吸收值为平台期的10% 的上样体积;CO表示样品蛋白浓度;VC表示总的柱床体积。
1.2.2 各介质分辨率的考察 取亲和样品用20 mmol/LPB 缓冲液(pH 5.8)稀释至7 mg/ml,以20 mmol/L PBpH 5.8为上样缓冲液,基于方法1.2.1的结果选择SP-FF、Poros XS、Nuvia S 三种层析介质,上样量为各介质动态载量的80%,保留时间1 min。20 mmol/L PB 平衡,0~ 30% 20 mmol/L PB(pH 5.8)、1 mol/L NaCl 线性洗脱20柱体积,保留时间3 min。洗脱峰分阶段收集,UV 100 ~ 1000 mAU 标记为“ELU-1”;1000 mAU ~ 最高值标记为“ELU-2”;UV 最高值下降至1000 mAU 标记为“ELU-3”;1000 mAU降至100 mAU 标记为“ELU-4”。各样品均进行HPLC- IEC/SEC 检测。
1.2.3 pH 对抗体质量的影响 取亲和样品,20 mmol/L PB(pH 5.8)稀释至7 mg/ml,以20 mmol/L PB(pH 5.8)为上样缓冲液平衡柱子,上样量为80% DBC,线性流速200 cm/h。以pH 分别为 6.2、6.5、6.8、7.2 的20 mmol/L PB 平衡后,0 ~ 30% 20 mmol/L PB、1 mol/L NaCl 线性洗脱20柱体积。洗脱峰分阶段收集,进行HPLC-IEC/SEC检测。
1.2.4 NaCl 浓度预洗去除酸性异构体的影响 取亲和样品,将pH 9.0 的1 mol/L Tris 调pH 至6.5,20 mmol/LPB(pH 6.5)稀释至7 mg/ml,以20 mmol/L PB(pH 6.5)为上样缓冲液,分别用1.5%、2%、2.5% 的 20 mmol/L PB(pH 6.8)、1 mol/L NaCl 进行预洗,紫外上升至 50 mAU 后收集预洗峰,0 ~ 30% 20 mmol/L PB(pH 6.5)、1 mol/L NaCl 线性洗脱20 柱体积,洗脱峰分阶段收集,进行HPLC-IEC/SEC 检测。
1.2.5 不同电导率 PB(pH 6.8)缓冲液预洗固定体积去除酸性异构体的影响 20 mmol/L PB(pH 6.8)与200 mmol/L PB(pH 6.8)混合分别配制预洗缓冲液2.5、3.0、3.5 mS/cm PB(pH 6.8),同时配制2% 20 mmol/L PB(pH 6.8)、1 mol/L NaCl。取亲和样品,1 mol/L Tris 9.0 调pH 至6.5,20 mmol/L PB(pH 6.5)稀释至7 mg/ml,以20 mmol/L PB(pH 6.5)为上样缓冲液,分别用上述预洗缓冲液预洗15 柱体积,紫外上升至 50 mAU 后收集预洗组分。20 mmol/L PB(pH 6.5),200 mmol/L NaCl 直接洗脱,收集洗脱峰。各样品进行HPLC-SEC/IEC 检测。
1.2.6 HPLC-SEC 检测蛋白多聚体与碎片含量[10]样品经超滤换液至20 mmol/L PB(pH 5.8)中,用纯化水稀释至2 mg/ml。150 mmol/L PB(pH 7.0)平衡色谱柱,流速1 ml/min。待基线平稳,进样10 μl,紫外检测波长214 nm,记录20 min。
1.2.7 HPLC-IEC 检测蛋白电荷分布[10]样品经超滤换液至20 mmol/L PB(pH 5.8)中,用纯化水稀释至4 mg/ml。流动相A 为20 mmol/L PB(pH 6.2),流动相B 为20 mmol/L PB(pH 6.2)、0.3 mol/L NaCl。流动相B 清洗色谱柱30 min。92% 流动相A、8% 流动相B 平衡色谱柱至基线平稳,流速0.8 ml/min,柱温为25 ℃。进样10 μl,紫外检测波长为214 nm,记录35 min。线性梯度洗脱:8% ~ 35% B,0~ 29 min;30 min 之后维持 50% B。
1.2.8 紫外吸收测定蛋白浓度 将待测样品用纯水稀释合适倍数,使在280 nm 处吸收值处于 0.20.8 范围内。
蛋白浓度(mg/ml)=(280nm× 稀释倍数)/消光系数
2 结果
2.1 介质动态载量测定
如表1 所示,Poros XS 与Nuvia S 均显示出较高的动态载量,均在50 mg/ml 以上,而其他几种介质载量比较小,故选择Poros XS 和Nuvia S 做为候选介质。
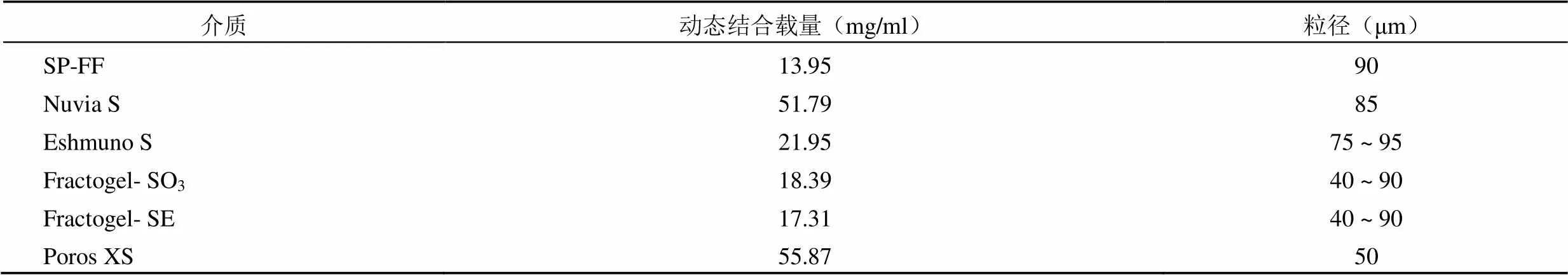
表 1 介质动态载量测定
2.2 各介质分辨率的考察
以原工艺中的SP-FF 作为对照,通过洗脱峰的分段收集,考察各介质分离电荷异构体的差异。三种介质均只有一个洗脱峰,各电荷异构体洗脱顺序与理论一致[11],酸性异构体由于带电荷少最先被洗脱下来,而碱性异构体在目的组分之后被洗脱(图 1~3),对照品HPLC-IEC 分析图谱见图1。相比于其他两种介质,Poros XS 的酸性异构体含量前后差异显著(图3),酸性异构体主要集中在出峰阶段,洗脱峰最后组分ELU-4 约有2.11 柱体积,约占整个洗脱峰的29.68%,酸性异构体已下降至8.64%,此外其相比于其他介质粒径更小,只有50 μm。Nuvia S 洗脱样品电荷分布也呈现类似情况(图4),但是其在洗脱峰结束阶段,体积约3.01 柱体积,占整个洗脱峰的36.13%,酸性异构体较多,仍保持18.82%。根据以上结果,Poros XS 展现出更好的分离效果,对于此单抗而言,分辨率更高,故以此介质开展后续探索。
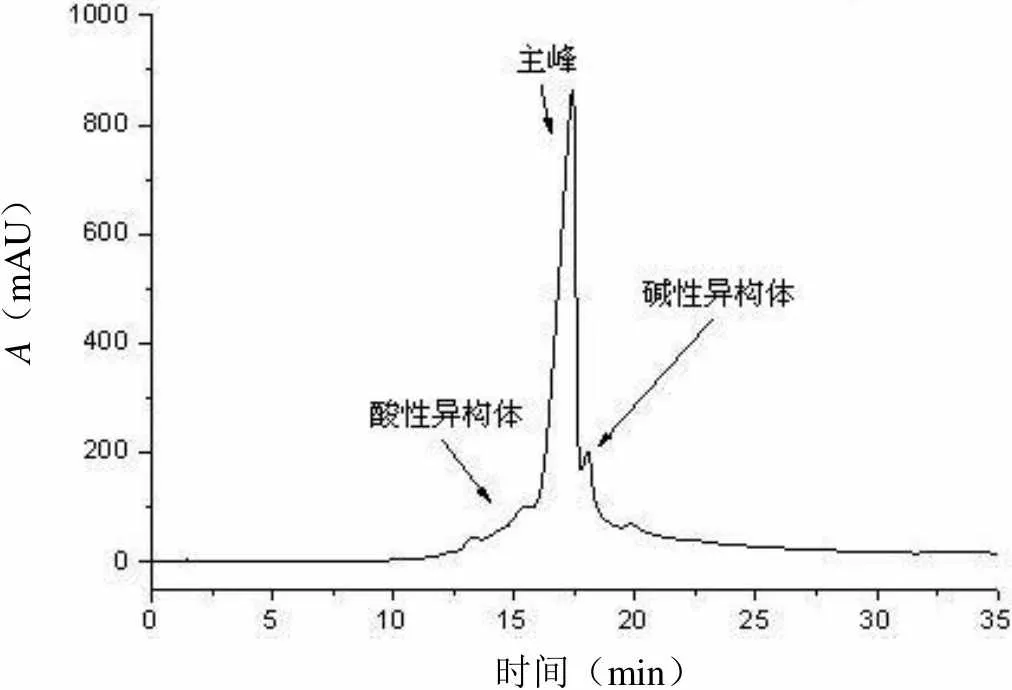
A(mAU) 时间(min)

A(mAU)酸性异构体比例(%) 柱体积
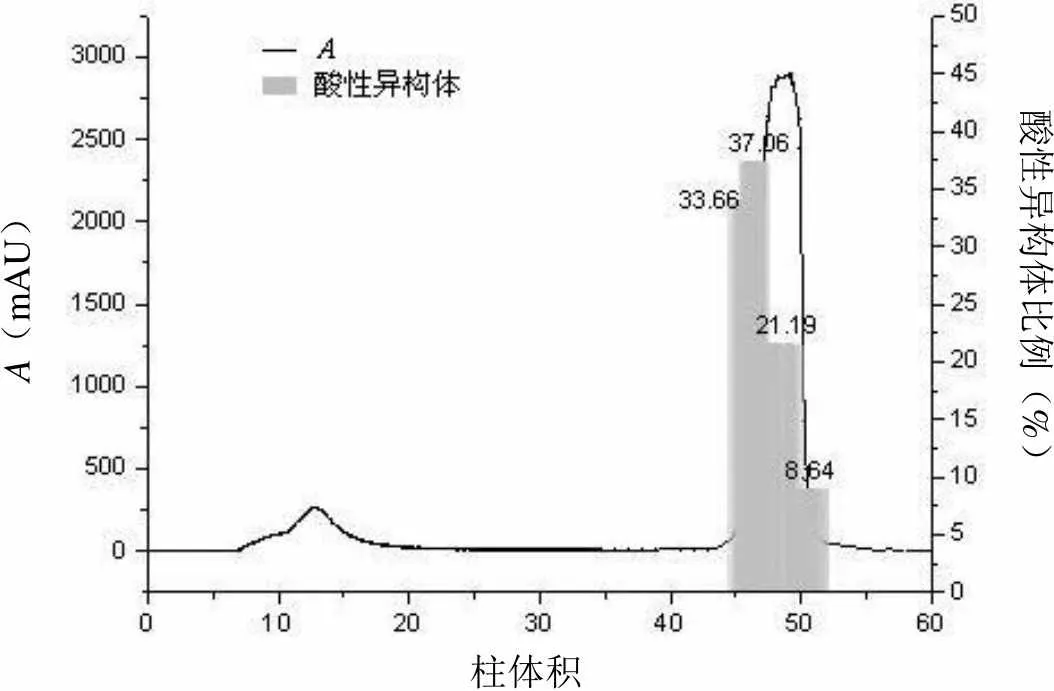
A(mAU)酸性异构体比例(%) 柱体积
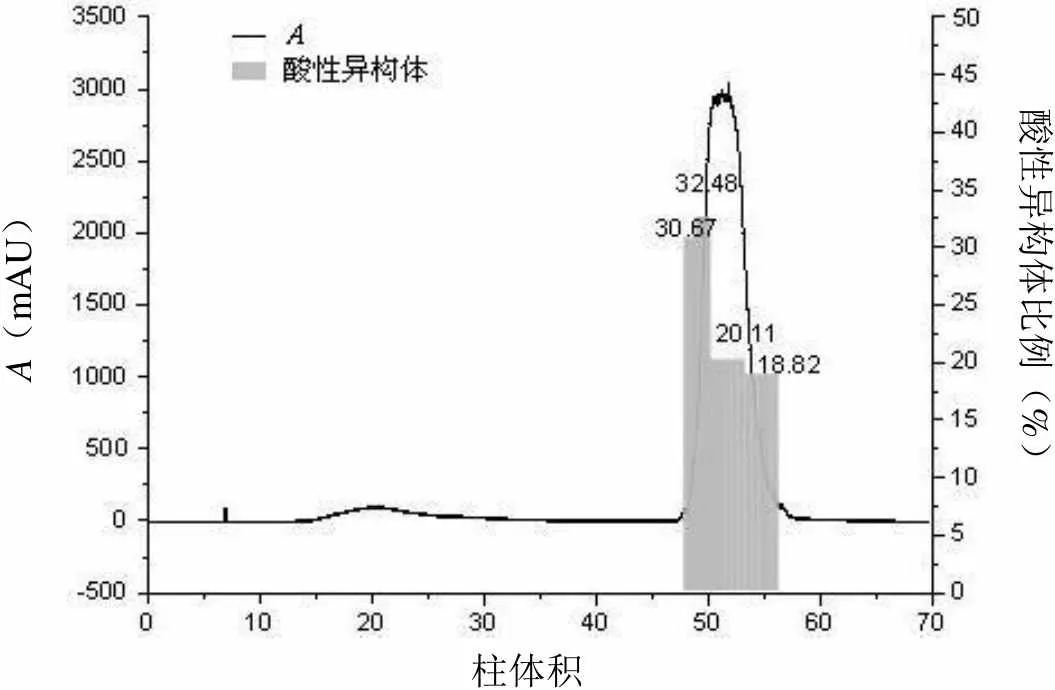
A(mAU)酸性异构体比例(%) 柱体积
2.3 pH 对抗体质量的影响
目前已知,洗脱液成分的小幅度变化以及 pH 值的波动均能影响保留时间、分辨率、洗脱峰的组成。研究表明在阳离子层析中伴随着盐离子浓度变化,pH 值也发生着复杂变化。因而利用盐离子梯度洗脱模式,样品的保留时间和分辨率不仅取决于可控的盐浓度,也受不可预知的 pH 值影响[12]。
通过不同 pH 下盐离子梯度洗脱,未能将酸性异构体单独分离出来。图 5 中数据表明洗脱溶液 pH 值越高,越接近于抗体目的组分等电点(pI = 7.34),酸性异构体与介质的结合力越弱,出峰阶段收集的组分(ELU-1)酸性异构体含量越多。其中用 pH 6.8 洗脱时,ELU-1 中酸性异构体含量远高于其余两个 pH。而 pH 值为 7.2 时,由于太过接近 pI,样品直接穿透。据文献报道,碎片主要是 Fab 片段或 desFab 片段,带电荷量少,显示出酸性异构体性质。多聚体带电荷量多,与阳离子介质电荷作用更强,常显示碱性异构体性质[9, 13]。图 5 中数据与理论一致,碎片在出峰阶段含量最多,多聚体主要集中在洗脱峰末尾。此外,pH 6.5 和 6.8 条件下,洗脱样品的多聚体和碎片总体含量明显低于 pH 6.2。当 pH ≤ 6.5,样品偏离等电点较大,较不稳定,易发生分解形成碎片,因而今后可将样品保存在 pH 6.5 平衡液中进行操作。同时,在洗脱前增加用 pH 6.8 缓冲液预洗步骤去除酸性异构体。洗脱用 pH 6.5 缓冲液,保证洗脱样品酸性异构体总含量较低。
2.4 不同 NaCl 浓度预洗对去除酸性异构体的影响
由上述实验可知紫外出峰时电导率约 4.3 mS/cm,换算成 20 mmol/L PB(pH 6.8)、1 mol/L NaCl 比例为 2%。从图 6 可看到,用 2%、2.5% 20 mmol/L PB(pH 6.8)、1 mol/L NaCl 预洗去除的主要是酸性异构体,占 60% 以上。洗脱阶段收集的组分相比样品,酸性异构体百分含量明显下降。表明提高缓冲液 pH 并适当添加 NaCl 进行预洗确实能有效去除酸性异构体。但是预洗过程中,紫外上升至某一值后维持平台期,无法下降,并未形成明显的酸性异构体峰。且随着 NaCl 比例上升,预洗样品中目的组分比例也逐渐上升,影响了回收率。在该条件下,酸性异构体与目的组分电荷性质接近,预洗过程中与介质结合、解离呈现一个动态平衡的过程,相互影响,并不能使得酸性异构体与目的组分完全分离。但可以用预洗一定柱体积的方式去除部分酸性异构体。
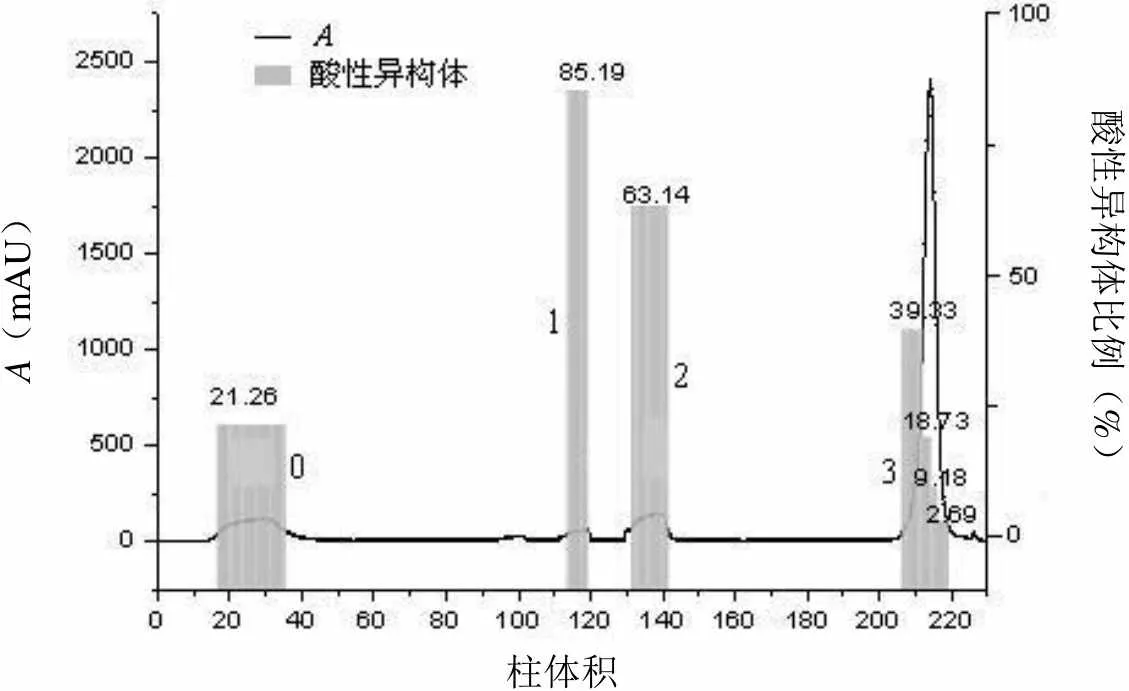
A(mAU)酸性异构体比例(%) 柱体积
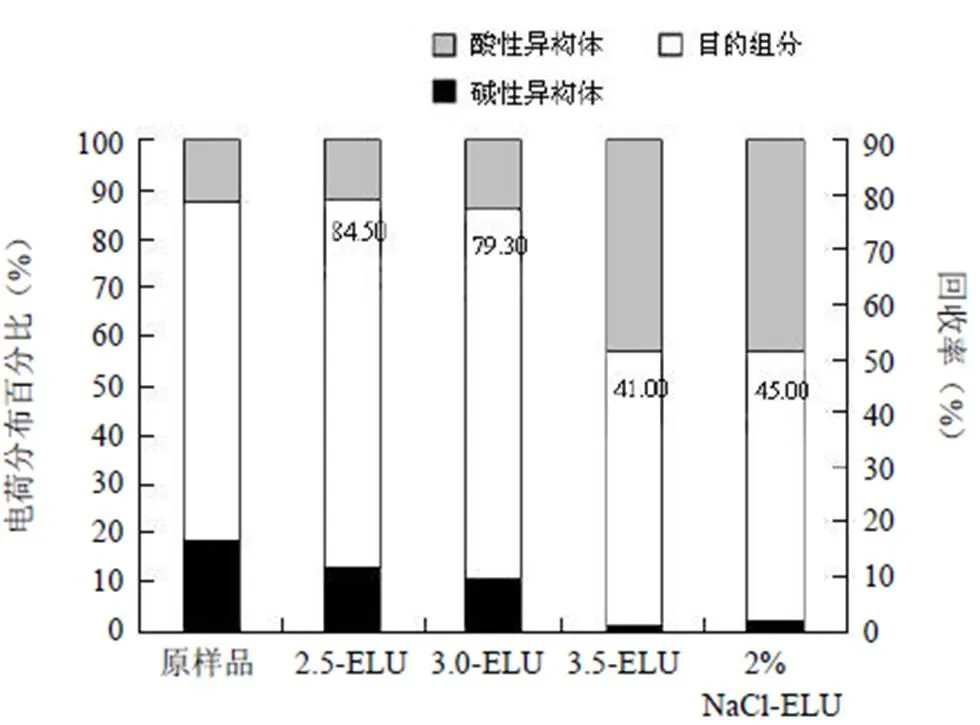
图 7 不同电导率的 PB(pH 6.8)预洗 15 柱体积后各洗脱峰电荷分布百分比
2.5 不同电导率 PB(pH 6.8)缓冲液预洗对去除酸性异构体的影响
不同的离子影响蛋白与介质结合能力,磷酸根比氯离子盐析作用更强。同时引入其他类型的盐离子,容易使pH 值发生变化[12]。通过探究不外加NaCl,利用不同浓度的PB 缓冲液预洗,也能有效去除酸性异构体。图7 数据表明预洗过程PB 缓冲液电导率越高,洗脱样品中酸性异构体百分含量越低,但回收率亦逐渐降低,这与之前的探索结果一致。4 个洗脱样品,纯度均在99% 以上。2.5 mS/cm或3.0 mS/cm 预洗后收集到的洗脱样品(2.5-ELU 表示2.5 mS/cm PB 预洗后洗脱的样品,3.0-ELU 表示3.0 mS/cm PB 预洗后洗脱的样品)与原样品对比,酸性异构体含量有明显下降,由原先约20% 下降至15% 左右,符合质控标准(< 18%),回收率在80% 左右。而利用3.5 mS/cm以及2% NaCl 预洗后收集到的洗脱组分[3.5-ELU 表示3.5 mS/cm PB 预洗后洗脱的样品,2% NaCl-ELU 表示2% 20 mmol/L PB(pH 6.8)、1 mol/L NaCl 预洗后洗脱的样品]酸性异构体比例下降十分显著,已降至2% 以下,从侧面反映了该条件下预洗去除酸性异构体效果非常好。但是回收率较低,低于50%。对比外加NaCl 和调节预洗缓冲液浓度以获得合适电导率两种方式进行预洗,即3.5-ELU 与2% NaCl,结果显示无明显区别,考虑到大规模生产的实用性与简便性,采用调节预洗缓冲液浓度达到相应电导率的方法更可取。同时通过线性梯度换算而来的200 mmol/ml NaCl也足以将目的蛋白洗脱下来。
3 讨论
随着质量源于设计(QbD)理念逐步在生物制药产业的深入,分离、鉴定异构体性质成为生物药物生产过程设计时必须考虑的因素。关键参数(CQA)的确立也有赖于这些异构体对于药物安全性、药效等方面的信息[14]。前期的研究表明,酸性异构体含量过多会降低单抗的药效学活性,因而控制酸性异构体含量,使之保持在 18% 以下,成为整个产品生产过程中的关键参数之一。
单克隆抗体纯化过程,最为经典也是最常采用的为亲和层析-阳离子/阴离子层析-阴离子/阳离子层析。其中阳离子交换层析为吸附模式,一般用于去除 HCP、多聚体等杂质,近年来,控制电荷异构体含量愈发重要,研究者也开始利用阳离子层析分离电荷异构体。但是电荷异构体由于理化性质与目的组分接近,其中酸性异构体一般是目的组分经唾液酸化、二硫键还原、非还原共价结合、糖基化、脱酰胺化等过程后产生的复合形态[9],单纯通过常用盐浓度调节洗脱液难以达到理想的分离效果。
本文借鉴了 pH 梯度洗脱的原理,根据酸性异构体pI 小于目的组分 pI,酸性异构体与阳离子介质结合相对较弱的特点,在已结合状态下提高缓冲液 pH 和电导率将大部分酸性异构体先洗脱下来,建立一条新的阳离子层析纯化工艺。考察了 pH、盐浓度、平衡液电导率对于酸性异构体去除效果的影响,并进行条件优化,兼顾碎片与多聚含量,最终确定以 20 mmol/L PB(pH 6.5)为上样缓冲液,用 25 mmol/L PB(pH 6.8)(3.0 mS/cm)预洗 15 个柱体积,用 20 mmol/L PB(pH 6.5),200 mmol/L NaCl 洗脱的方案,最终回收率可达80%以上,纯度 99% 以上,酸性异构体含量降低至 15%,低于 18%,符合质控标准。此方法相比于文献中用的 pH 梯度洗脱、等电聚焦层析、置换色谱,未引入其他缓冲液成分,更为简单实用,适合产业化。纯化过程对一些参数进行精细调节,从而控制酸碱性异构体的比例,对于生物类似物的开发有重要的参考意义。
[1] Liu H, Gaza-Bulseco G, Faldu D, et al. Heterogeneity of monoclonal antibodies. J Pharm Sci, 2008, 97(7):2426-2447.
[2] Karra S, Sager B, Karim MN. Multi-Scale modeling of heterogeneities in mammalian cell culture processes. Ind Eng Chem Res, 2010, 49(17): 7990-8006.
[3] Boswell CA, Tesar DB, Mukhyala K. Effects of charge on antibody tissue distribution and pharmacokinetics. Bioconj Chem, 2010, 21(12): 2153-2163.
[4] Vlasak J, Ionescu R. Heterogeneity of monoclonal antibodies revealed by charge-sensitive methods. Curr Pharm Biotechnol, 2008, 9(6):468- 481.
[5] Kang X, Frey DD. Chromatofocusing using micropellicular column packings with computer-aided design of the elution buffer composition. Anal Chem, 2002, 74(5):1038-1045.
[6] Kang X, Frey DD. High-performance cation-exchange chromatofocusing of proteins. J Chromatogr A, 2003, 991(1):117-128.
[7] Pabst TM, Carta G, Ramasubramanyan N, et al. Separation of protein charge variants with induced pH gradients using anion exchange chromatographic columns. Biotechnol Prog, 2008, 24(5):1096-1106.
[8] Farnan D, Moreno GT. Multiproduct high-resolution monoclonal antibody charge variant separations by ph gradient ion-exchange chromatography. Anal Chem, 2009, 81(21):8846-8857.
[9] Khawli LA, Goswami S, Hutchinson R, et al. Charge variants in IgG1: Isolation, characterization, in vitro binding properties and pharmacokinetics in rats. MAbs, 2010, 2(6):613-624.
[10] Pei CY, Yang LX. The analysis of purity of anti-EGFR monoclonal antibody. J Zhoukou Normal Univ, 2013, 30(2):56-58. (in Chinese)
裴朝玉, 杨丽霞. 抗EGFR单克隆抗体药物纯度分析. 周口师范学院学报, 2013, 30(2):56-58.
[11] Johnson KA, Paisley-Flango K, Tangarone BS, et al. Cation exchange-HPLC and mass spectrometry reveal C-terminal amidation of an IgG1 heavy chain. Anal Biochem, 2007, 360(1):75-83.
[12] Rozhkova A. Quantitative analysis of monoclonal antibodies by cation-exchange chromatofocusing. J Chromatogr A, 2009, 1216(32): 5989-5994.
[13] Zhang T, Bourret J, Cano T. Isolation and characterization of therapeutic antibody charge variants using cation exchange displacement chromatography. J Chromatogr A, 2011, 1218(31):5079- 5086.
[14] Rathore AS, Winkle H. Quality by design for biopharmaceuticals. Nat Biotechnol, 2009, 27(1):26-34.
王旻,Email:minwang@cpu.edu.cn; 张弢,Email:zhangtao@ simcere.com
2014-03-05
10.3969/cmba.j.issn.1673-713X.2014.05.014
