脱矿牙本质基质材料对大鼠颅骨缺损修复的研究*
2014-11-23李伯翰刘洪臣
李伯翰 刘洪臣
口腔颌面部的肿瘤、外伤、发育性畸形均易造成颌骨缺损。骨缺损的修复技术主要有自体骨移植、异体(同种或异种)骨移植和人工骨材料移植。自体骨移植虽为目前骨缺损修复的金标准[1,2],但存在取骨区多种并发症、骨量有限、吸收不良等问题[3-5]。为此,很多学者为寻找一种优良的骨替代材料进行了大量的研究。
近年来研究较多的脱矿牙本质基质(demineralized dentin matrix,DDM)是一种具有骨诱导性的骨替代材料[6-9]。本实验选用的材料主要成分为DDM-熟石膏(Ca[SO4]-0.5H2O)复合构建新的组织工程骨,用于修复骨缺损,探讨此种新型植骨材料的骨缺损修复作用,希望为临床治疗骨缺损提供一种新型的人工骨材料。
1.材料与方法
1.1 实验动物及主要试剂、仪器 实验动物:6-8周龄雄性SD大鼠14只(SPF/VAF,解放军总医院动物实验中心),体重160-180 g。荧光显微镜、倒置显微镜(Leica公司,德国)。
1.2 脱矿牙本质基质牙粉制备 取8周龄SD大鼠两只的上下前牙,用预冷的生理盐水反复冲洗后,刮除软组织,机械法去除牙釉质和牙骨质以及内部牙髓组织,用三氯甲烷-甲醇脱脂24h,然后将脱矿、脱脂的牙齿粉碎过筛制成200-280μm的微粒,用预冷生理盐水反复冲洗,放入pH为8.0的5g/L的EDTA液中处理10min,生理盐水冲洗12h去除EDTA后,环氧乙烷消毒,备用。纯二水硫酸钙经加热1300℃,30 min锻烧而得熟石膏。以脱矿牙本质基质和熟石膏按2:1的重量比混合后环氧乙烷消毒保管[10-12]。
1.3 手术方法 用乙醚进行全麻后,腹腔内注入戊巴比妥钠25mg/kg完全麻醉SD大鼠,麻醉后固定于手术台上,头颅部备皮和碘伏消毒后为了减少术中出血注射20/0盐酸利多卡因(含1:10万复方肾上腺素),切开头颅骨正中央部并露出骨面。用台式慢速牙科电钻低速钻孔(3000r/min)直径约为8mm。实验组:立即将己准备好的脱矿牙本质基质牙粉末和熟石膏以2:1的质量比用生理盐水混合后埋植到缺损部。缝合骨膜及上部组织。对照组:无治疗修复,手术后立即缝合。待苏醒后送回饲养室,分别于术后第4和8周(实验组和对照组各3只)时分组处死动物。各实验动物用吸入过量乙醚的方式处死后切开头部,在70kvp、15ml、0.4sec的条件下摄X线片,之后采集标本(包括周围自体骨),10%的福尔马林固定,脱钙,用石蜡包埋后以4-6μm的厚度制作组织标本。用H-E染色法染色后在光学显微镜下观察。
1.4 观察指标 (1)肉眼观察术后大鼠活动、进食、伤口愈合情况。(2)分别于术后4和8 w,将大鼠麻醉后摄大鼠颅骨X线片,条件为40kV,1.6 mAs观察颅骨缺损修复情况;然后在麻醉状态下注入空气处死,取标本行肉眼观察及HE染色组织学观察骨缺损的修复水平。
2.结果
2.1 实验动物观察 术后动物体温、饮食正常,外界环境刺激敏感,切口无红肿、渗液等炎性反应。
2.2 影像学检查 实验组各时间段均可见云雾样改变,缺损边缘隐约可见少量骨痂;8W时云雾模糊影较大,缺损处有骨形成充满骨痂。空白组在各时间点,骨折缺损处见有瘢痕愈合,未见骨性愈合,未见明显新生骨(图1)。

图1 颅骨缺损后修复影像学检查
2.3 大体观察 各组植入的修复材料在骨创区均无移位,材料于骨组织交界周围未见变性、坏死、化脓、积液等不良迹象。4 w时,实验组出现骨质较薄的骨痂样硬组织,标本表面较为光滑,渐变暗红色;对照组缺损区无明显新骨长入,仅有少量结蹄组织覆盖。8 w时,实验组骨创区呈现乳白色,可见血管,新生出皮质骨与骨折端皮质连续,骨修复完成;对照组仍有明显的骨缺损,骨缺损区被周围结缔组织覆盖,未见明显骨痂。
2.4 组织学观察 4周时,实验组和对照组脱钙后均可见空腔,植入材料和缺损处链接紧密。各组材料均可见微血管和成纤维细胞浸润,对照组的血管和细胞数量少于实验组。8周时,实验组较多骨样组织形成,表现为软骨成骨和纤维成骨特征。对照组,变化不大,少许局灶性骨样组织形成。值得关注的是,对照组成骨主要表现是从缺损边缘向中间发展,而实验组的成骨活动是在材料与缺损边缘交界处,且更为活跃(图2)。
3.讨论
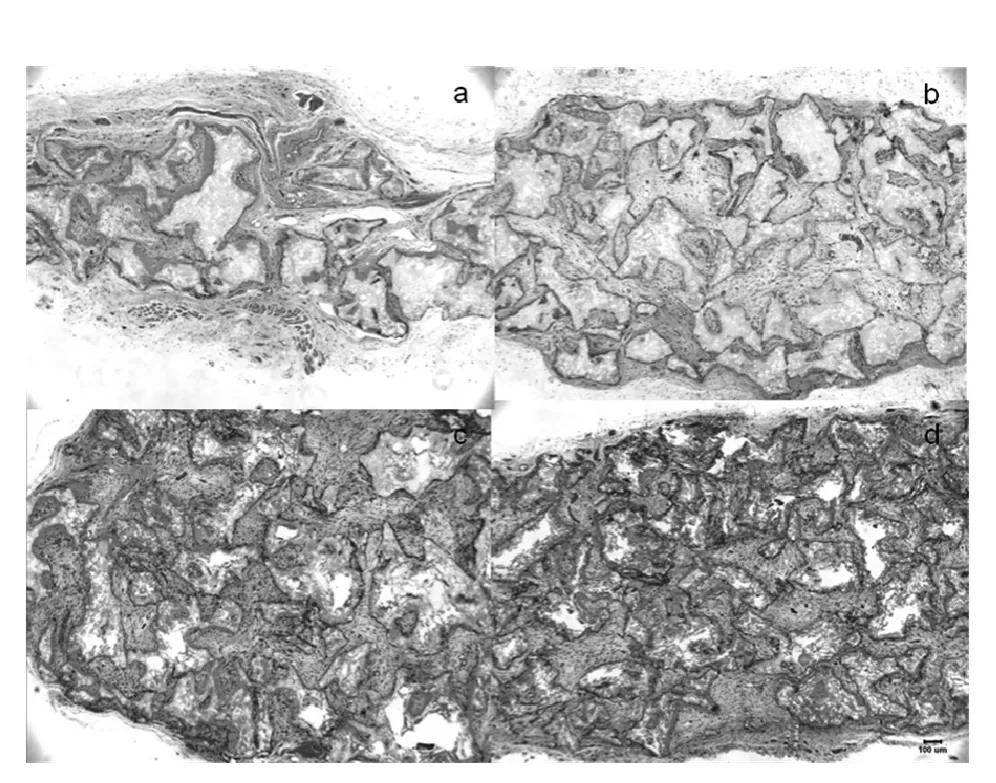
图2 组组织学变化(HE染色,×400)
骨组织工程中,选择具有细胞外基质作用的生物材料是很重要的,直接关系到组织再生成功与失败[13-15]。脱矿牙本质基质,按形态分也有3种,即颗粒状、凝胶状和薄膜状。,其制备和作用机理在杂志“脱矿牙本质基质骨诱导作用的研究”有关报道为以临床拔除的各类牙为原料,经过粉碎、脱脂、脱钙、病毒核酸灭活和消毒等过程获得,此DDM的颗粒大小为100-200μm3。DDM无论在骨缺损区、根尖周区或软骨区都具有良好的骨诱导作用,但是DDM的骨诱导机制目前原因并不十分明确。DDM为天然细胞外基质材料,内部含有丰富的有助于细胞生长的蛋白和细胞因子,包括DMP-1,牙本质涎蛋白(dentin sialoprotein,DSP),骨涎蛋白,骨桥蛋白,转化生长因子-p1、I型胶原,核心蛋白多糖和二聚糖等牙齿基质成分,能够为细胞提供相似天然的牙齿发育微环境[15-18]。本实验发现4周后DDM材料和缺损处上游戏包正常贴附、生长、繁殖,证明该生物材料有良好的细胞相容性。
人类骨的无机成分最主要为羟基磷灰石(HA),我们选用的脱矿牙本质基质牙粉材料的主要材料也同样为羟基磷灰石。但是羟基磷灰石质碎,吸收差,不易降解。目前国内外用羟基磷灰石和熟石膏复合物修复骨缺损的动物实验一致认为:经基磷灰石和熟石膏复合物不引起组织炎性反应和异物反应;羟基磷灰石和熟石膏复合物诱导新骨形成的速度快于单纯羟基磷灰石;新骨与轻基磷灰石的结合是理想的骨整合[19]。
为弥补脱矿牙本质基质牙粉末易离散,早期固位不佳的缺点,本实验把熟石膏与脱矿牙本质基质牙粉末混合后移植,以此提高材料的初期稳定性,随材料稳定性的提高,骨传导能力也可能比单独移植脱矿牙本质基质牙粉末时相比优越。熟石膏所特有的粘附性,作为脱矿牙本质基质牙粉末的粘接成形剂,以保证达到良好的形态和固位,减少颗粒的移动构成一种有效的输送体系。
本实验观察结果随着时间的变化,移植的脱矿牙本质基质牙粉末分解成小颗粒,其大小逐渐变小,移植物初期四方形边缘逐渐变为圆钝,因此可推断脱矿牙本质基质牙粉末是可吸收的,第5周时可观察到脱矿牙本质基质牙粉末周围被膜化和骨缺损部位的新骨形成,并且可见到新生毛细血管;第8周时受区骨边缘可观察到新骨与脱矿牙本质基质牙粉末的直接愈合,新骨渗透到脱矿牙本质基质牙粉末的颗粒之间,也观察到吞噬脱矿牙本质基质牙粉末的巨噬细胞。
综上所述,本实验所用的移植材料随时间的变化逐渐被吸收,并具有周围新骨可渗透的骨传导能力。熟石膏在以往的研究中被认为是对人体无害的、可吸收的、但无骨传导能力的材料。在本实验中熟石膏大部分被消失,因此不能进行正确的组织学评价,但能观察到与移植初期相比,随时间的变化逐渐被吸收,8周时几乎看不到剩余的熟石膏。第3周时,可观察到结缔组织内的慢性炎性细胞浸润,但第5周时炎性细胞明显减少,凡乎看不到炎性细胞浸润。
本实验中使用的脱矿牙本质基质牙粉末是同种异体的牙齿,它是在1200℃以上的高温处理的方法从牙齿中提取无机物的,因此考虑它无免疫原性,但今后仍需进行免疫学相关研究。
[1]San Julian M,Valenti A.Bone transplant[J].An Sist Sanit Navar,2006,29(2):125-136
[2]Goldberg VM,Stevenson S.Natural history of autografts and a-llografts[J].Clin Orthop Relat Res,1987,(225):7-16
[3]Le Geros RZ.Properties of osteoconductive biomaterials:calcium phosphates[J].Clin Orthop Relat Res,2002,(395):81-98
[4]张 明,杨智贤,石展英,等.自体骨泥混入骨膜碎片植骨与单纯自体骨泥植骨修复骨缺损的效果对比实验[J].中国临床康复,2006,9(30):76-79
[5]王丁丁,曾 戎,杨敏儿,等.缓释型重组人骨形态发生蛋白2/壳聚糖生物骨修复材料诱导骨形成[J].中国组织工程研究与临床康复,2011,15(25):4583-4586
[6]鲍济波,谢志刚.脱矿牙本质基质骨诱导作用的研究[J].国际口腔医学杂志,2011,38(3):329-331
[7]谢 迎,刘 斌,岑远坤,等.种植体固定的钛网复合脱钙牙基质增高牙槽嵴的研究[J].中国修复重建外科杂志,2008,4(22):476-180
[8]岑远坤,李 文,廖运茂,等.脱钙牙本质基质及其复合物整复节段性骨缺损的组织学观察华[J].西口腔医学杂志,1998,8(16):263-165
[9]Li J,Yang J,Zhong X,et al Demineralized dentin matrix composite collagen material for bone tissue regeneration[J].J Biomater Sci Polym Ed,2013,24(13):1519-1528
[10]Reis-Filho CR,Silva ER,Martins AB,et al.Demineralised human dentine matrix stimulates the expression of VEGF and accelerates the bone repair in tooth sockets of rats[J].Arch Oral Biol,2012,57(5):469-476
[11]Yagihashi K,Miyazawa K,Togari K,et al.Demineralized dentin matrix acts as a scaffold for repair of articular cartilage defects[J].Calcif Tissue Int,2009,(3):210-220
[12]Gomes MF,Destro MF,Banzi EC,et al.Optical density of bone repair after implantation of homogenous demineralized dentin matrix in diabetic rabbits[J].Braz Oral Res,2008,22(3):275-280
[13]李伯翰,刘洪臣,鄂玲玲.蛋白质组学在骨质疏松症大鼠颌骨组织差异蛋白筛选和鉴定中的应用[J].中华老年口腔医学杂志,2012,2(10):111-114
[14]Gomes MF,Destro MF,Banzi EC,et al.Optical density of bone repair after implantation of homogenous demineralized dentin matrix in diabetic rabbits[J].Braz Oral Res,2008,22(3):275-280
[15]Mora-Rincones OA,Corona-Rodríguez JC,Díaz-Carvajal AL,et al.Aplication of demineralized human bone matrix in the surgical dental fusion treatment.Report of a case[J].Invest Clin,2008,49(2):239-249
[16]Guo W,He Y,Zhang x,et a1.The use of dentin matrix scaffold and dental follicle cells for dentin regeneration[J].Biomaterials,2009,30(35):6708-6723
[17]Bakhshalian N,Jalayer T,Shahoon H,et al.Osteopromotive property of allogenic demineralized dentin matrix:a pilot study[J].J West Soc Periodontol Periodontal Abstr,2013,61(2):35-38
[18]王永刚,张晓梅,谭家莉,等.脱矿牙本质基质对人牙髓干细胞体外增殖、牙向分化能力的影响[J].口腔医学,2012,32(3):230-239
[19]Zhang SM,Liu J,Zhou W,et al.Interfaeialfabrieation and Property of hydroxyap-atite/Polylactide resorbable bone fixation composites[J].Current Applied Physics,2005,5(5):516-518
