高氧对小鼠视网膜新生血管模型中根蛋白的影响△
2014-11-13王龙梅闫琳杨侠董晓光徐海峰
王龙梅 闫琳 杨侠 董晓光 徐海峰
病理性新生血管的形成是早产儿视网膜病变、视网膜血管阻塞性眼病、糖尿病视网膜病变等一系列视网膜血管性疾病的主要特征[1],这些异常新生血管主要在视网膜表面生长,引起视功能损伤和视力严重下降[2]。视网膜新生血管的形成过程极为复杂,参与的因子众多[3-5]。但从细胞增生的角度来讲,血管内皮细胞增生是新生血管形成的细胞学基础,这一点与肿瘤的发生十分类似,均与细胞异常增生有关。研究发现,根蛋白(Radixin)是细胞膜骨架连接蛋白,它参与了肿瘤细胞的增生、迁移、浸润过程[6-7],同时它还参与了血管内皮屏障功能改变过程[8-10]。由此推测,Radixin有可能参与视网膜新生血管的发生,然而目前相关研究甚少。因此本实验中我们对小鼠视网膜新生血管形成过程中Radixin的表达情况进行研究,以期为临床治疗新生血管性视网膜疾病提供新的方向。
1 材料与方法
1.1 实验动物 将健康性成熟SPF级C57BL/6J小鼠(维通利华,北京)按雌雄比例3∶1合笼饲养于山东省眼科研究所实验动物中心,待母鼠怀孕后分出单独一笼饲养,取其所生幼鼠制作动物模型。
1.2 主要仪器与试剂 异硫氰酸荧光素标记的右旋糖酐(FD-2000S)(Sigma,美国),山羊抗小鼠 Radixin一抗(Santa Cruz,美国),免疫组织化学试剂盒(福州迈新),RNA 提取试剂盒(Macherey-nagel,德国),反转录试剂盒(Takara,大连),Real time-PCR 试剂盒(天根,北京),探针引物(金斯瑞,南京),BCA蛋白浓度测定试剂盒(碧云天,上海),ECL显影试剂盒(Thermo scientific,美国),辣根过氧化物酶标记兔抗羊二抗(Santa Cruz,美国)。LB-CYl2C数字测氧仪(路博伟业,青岛),荧光显微镜(Nikon,日本),7500型荧光定量PCR仪(ABI,美国)。
1.3 方法
1.3.1 实验分组 将生后7 d的小鼠随机分为 2组,每组72只,分别为:(1)高氧诱导组:小鼠在生后7 d进入高氧环境,饲养5 d后回到正常氧环境中饲养;(2)正常对照组:小鼠一直置于正常氧环境中饲养。两组小鼠分别于生后 12 d、13 d、17 d、21 d、30 d即氧诱导视网膜新生血管动物模型造模成功后的0 d、1 d、5 d、9 d、18 d 处死小鼠。
1.3.2 动物模型的构建 将生后7 d的小鼠与母鼠同笼放入氧箱中,调整氧箱内氧气体积分数为75%±2%,温度为(23±2)℃。LB-CY12C数字测氧仪每日监测3~4次,保证氧箱内含氧体积分数稳定。饲养5 d后返回正常氧环境中继续与母鼠共同饲养。待小鼠出氧箱时行血管灌注造影视网膜铺片,以视网膜后极部形成大片无灌注区作为造模成功的标准。
1.3.3 FD-2000S血管灌注造影视网膜铺片 两组分别于生后 12 d、13 d、17 d、21 d、30 d 各取 2 只小鼠,腹腔注射麻醉后于手术显微镜下自上腔静脉灌注适量FD-2000S,保持正常血液循环5 min。颈部脱臼处死小鼠,摘取眼球,40 g·L-1多聚甲醛溶液固定15 min,手术显微镜下沿角巩膜缘剪开,去除角膜、虹膜、晶状体,完整分离视网膜。将视网膜放射状剪开,玻璃体面向上平铺于载玻片上,甘油封片后置于荧光显微镜下,应用488 nm波长蓝光激发,行形态学观察并照相。
1.3.4 视网膜组织病理学检查 两组分别于生后12 d、13 d、17 d、21 d、30 d 各取 2 只小鼠,颈部脱臼处死,摘取眼球,40 g·L-1多聚甲醛溶液固定24 h,乙醇梯度脱水,石蜡包埋。全眼球矢状位连续切片(厚度4 μm)至眼环呈现不完整圆环时,每隔15张切片取2张贴片于一张载玻片上,HE染色光镜下观察形态并照相。
1.3.5 免疫组织化学染色检测Radixin的表达 两组分别于生后17 d各取2只小鼠,同1.3.4方法制作石蜡切片。将石蜡切片置于60℃温箱烤片过夜,二甲苯Ⅰ、Ⅱ、Ⅲ脱蜡各10 min。梯度酒精复水、高压修复抗原。体积分数3%H2O2封闭过氧化物酶,山羊血清封闭抗原后加入羊抗小鼠Radixin一抗(1∶200),阴性对照以 PBS代替一抗,37℃水浴锅孵育60 min;PBS洗后滴加增强剂及二抗,37℃水浴锅孵育30 min,PBS洗后DAB显色,苏木素复染,中性树胶封片,显微镜下观察并照相。
1.3.6 Taqman 法 Real time-PCR 检测 Radixin mRNA的表达 两组分别于生后12 d、13 d、17 d、21 d、30 d各取5只小鼠,取出视网膜(方法同1.3.3),提取视网膜总RNA,逆转录得cDNA,进行Real time-PCR扩增。Radixin引物和探针序列:上游:5’-GAAGAATGAACGCGTGAAG-3’, 下 游:5’-CTCAGCGTGAAGAACATCGT-3’,探针:5’-TCTGAACTCAATGCCTGGAGCTGC-3’,引物间跨度 103 bp;GAPDH引物和探针序列:上游:5’-ACAACTTTGGCATTGTGGAA-3’,下游:5’-GATGCAGGGATGATGTTCTG-3’,探针:5’-CATGCCATCACTGCCACCCA-3’,引物间跨度133 bp。反应条件:预变性95℃ 10 s;PCR反应:95℃ 15 s,60℃ 60 s,40个循环。
1.3.7 Western-blot检测Radixin蛋白的表达 两组分别于生后 12 d、13 d、17 d、21 d、30 d 各取 5 只小鼠,提取视网膜总蛋白质,BCA蛋白浓度测定试剂盒测蛋白浓度并定量至 30 μg,100 g·L-1SDS-聚丙烯酰胺凝胶电泳。电泳结束后,4℃、100 mA电转膜3 h将蛋白转移至硝酸纤维素膜上。50 g·L-1脱脂奶粉室温封闭1 h,加入羊抗小鼠Radixin一抗(1∶500)4℃孵育过夜,磷酸盐缓冲液洗膜后将硝酸纤维素膜与辣根过氧化物酶标记兔抗羊二抗(1∶3000),室温孵育1 h,ECL显影试剂盒显影并成像。Gel-Del凝胶成像系统照相,Image J2x软件测量目的蛋白条带的灰度值,与内参GAPDH灰度值比较。
1.4 统计学处理 采用SPSS 19.0软件进行数据分析,高氧诱导组和正常对照组小鼠不同时间点Radixin mRNA及蛋白的表达水平以表示,采用两因素析因设计资料方差分析进行比较。高氧诱导组和正常对照组相同时间点及组内各时间点间Radixin mRNA及蛋白的表达水平的多重比较应用单因素方差分析(LSD-t检验),以 P<0.05为差异有统计学意义。
2 结果
2.1 视网膜铺片血管形态观察 高氧诱导组小鼠在生后12 d视网膜动脉高度收缩,大面积无血管区形成,仅在周边部形成小面积的血管网(图1A);生后13 d视网膜可见大片无灌注区,中周部血管密度较生后12 d增高,小血管走行紊乱,少量新生血管芽及微血管瘤形成(图1B);生后17 d视网膜大分支血管迂曲扩张、渗漏明显,无灌注区面积减小,中周部血管进入无灌注区边缘,血管密度增加,但血管走行更为紊乱,可见渗出斑,大量新生血管芽及微血管瘤形成,达到血管增生反应高峰(图1C);生后21 d视网膜血管仍可见迂曲、渗漏,无灌注区几乎消失,血管走行仍紊乱,但新生血管芽较生后17 d减少(图1D);生后30 d增生反应基本消退,血管走行大致正常,分布也较均匀,仅残留部分大分支血管扭曲渗漏改变(图1E)。正常对照组小鼠生后12 d视网膜血管已分布完全,密度均匀,走形自然,纹路清晰(图1F)。

Figure 1 Stretched preparation of retinas after FD-2000S intravascular injection(×40).A:OIR group at 12 days;B:OIR group at 13 days;C:OIR group at 17 days;D:OIR group at 21 days;E:OIR group at 30 days;F:Normal control group at 12 days FD-2000S血管灌注视网膜铺片(×40)。A:高氧诱导组生后12 d视网膜;B:高氧诱导组生后13 d视网膜;C:高氧诱导组生后17 d视网膜;D:高氧诱导组生后21 d视网膜;E:高氧诱导组生后30 d视网膜;F:正常对照组生后12 d视网膜
2.2 视网膜组织病理学检测 高氧诱导组小鼠生后12 d视网膜较薄,未见突破内界膜的血管内皮细胞核(图2A);生后13 d视网膜内界膜变粗糙,偶见突破内界膜的血管内皮细胞核和血管管腔(图2B);生后17 d视网膜可见大量突破内界膜的血管内皮细胞核,内界膜粗糙(图2C);生后21 d视网膜仍可见大量突破内界膜的血管内皮细胞核,内界膜仍粗糙(图2D);生后30 d视网膜内界膜较平滑,未见突破内界膜的血管内皮细胞核(图2E)。正常对照组小鼠生后17 d视网膜内界膜较平整光滑,偶见穿过内界膜的血管内皮细胞核(图2F)。
2.3 免疫组织化学染色检测Radixin在视网膜组织中的表达 免疫组织化学染色结果显示,Radixin在两组中均有表达。高氧诱导组小鼠生后17 d在视网膜新生血管管壁、血管芽、内皮细胞及神经节细胞层均可见大量棕黄色颗粒,Radixin表达明显增强(图3A)。正常对照组小鼠生后17 d视网膜内界膜平滑,棕黄色颗粒较少,Radixin表达较弱(图3B)。

Figure 2 Histopathological examination of retina in mice(HE,×400).The arrows pointed out the proliferated vascular endothelial cells or vessels.A:OIR group at 12 days;B:OIR group at 13 days;C:OIR group at 17 days;D:OIR group at 21 days;E:OIR group at 30 days;F:Normal control group at 17 days 小鼠视网膜组织病理学检查(箭头处为增生的血管内皮细胞核或血管管腔;HE染色,×400)。A:高氧诱导组生后12 d视网膜;B:高氧诱导组生后13 d视网膜;C:高氧诱导组生后17 d视网膜;D:高氧诱导组生后21 d视网膜;E:高氧诱导组生后30 d视网膜;F:正常对照组生后17 d视网膜
2.4 Taqman法 Real-time PCR 检测 Radixin mRNA的表达 对两组小鼠不同时间点Radixin mRNA表达水平进行析因分析结果显示,不同组别和不同时间点间Radixin mRNA表达水平差异均有统计学意义(Fgroup=59.273,P=0.000;Ftime=538.071,P=0.000;Finteraction=297.126,P=0.000)。高氧诱导组小鼠视网膜各时间点间Radixin mRNA表达水平呈先升高后降低的趋势,于生后17 d达到高峰,表达变化趋势与视网膜新生血管生长趋势一致。高氧诱导组小鼠生后12 d、13 d Radixin mRNA表达水平较正常对照组同龄小鼠低,生后17 d、21 d Radixin mRNA的表达水平较正常对照组同龄小鼠明显增高,差异均有统计学意义(P12d=0.000,P13d=0.000,P17d=0.000,P21d=0.000)。高氧诱导组Radixin mRNA表达水平生后13 d较同组生后12 d增高,生后17 d较同组生后13 d和生后21 d均明显增高,差异均有统计学意义(P13dvs.12d=0.000,P17dvs.13d=0.000,P17dvs.21d=0.000)。正常对照组Radixin mRNA的表达总体稳定在较低水平,生后17 d表达稍高。两组生后30 d时Radixin mRNA表达水平差异无统计学意义(P30d=0.058;见表1)。
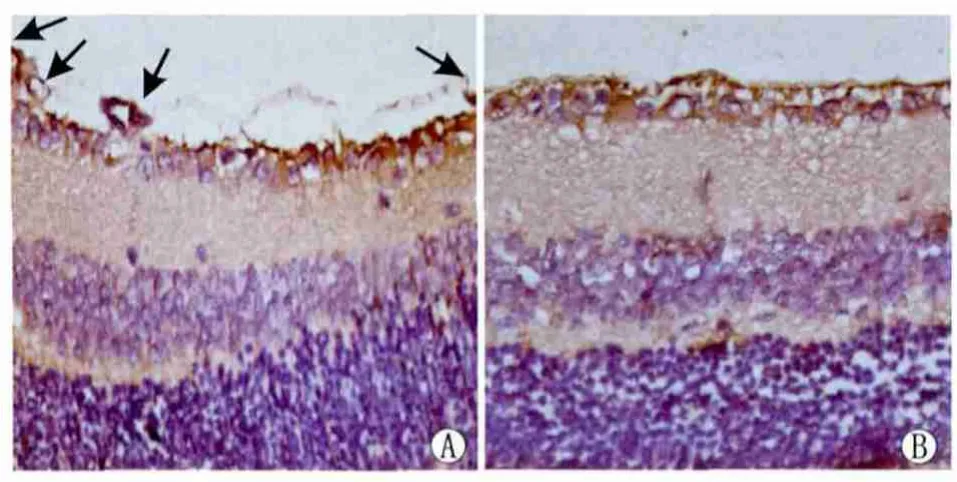
Figure 3 Immunohistochemical staining(×400).The arrows pointed out the proliferated vascular endothelial cells or vessels.A:OIR group at 17 days;B:Normal control group at 17 days 免疫组织化学染色结果(箭头处为增生的血管内皮细胞或管腔;×400)。A:高氧诱导组生后17 d视网膜;B:正常对照组生后17 d视网膜
2.5 Western-blot检测 Radixin蛋白表达水平
Western-blot检测结果见图4。对两组小鼠不同时间点Radixin蛋白表达水平析因分析结果显示,不同组别和不同时间点间Radixin蛋白表达水平差异均有统计学意义(Fgroup=419.307,P=0.000;Ftime=663.946,P=0.000;Finteraction=354.538,P=0.000)。高氧诱导组小鼠各时间点Radixin蛋白表达水平也呈先升高后降低的趋势,于生后17 d达到高峰,之后下降,但仍可在较高水平持续至生后21 d。高氧诱导组小鼠生后12 d、生后13 d Radixin蛋白表达水平低于正常对照组同龄小鼠,生后17 d、生后21 d表达水平明显高于正常对照组同龄小鼠,差异均有统计学意义(P12d=0.000,P13d=0.001,P17d=0.000,P21d=0.000)。高氧诱导组小鼠视网膜 Radixin蛋白表达水平生后13 d较生后12 d增高,生后17 d较生后13 d和生后21 d均明显增高,差异均有统计学意义(P13dvs.12d=0.000,P17dvs.13d=0.000,P17dvs.21d=0.000)。正常对照组各时间点Radixin蛋白表达总体稳定在较低水平,生后17 d表达稍高。两组生后30 d时Radixin蛋白表达水平差异无统计学意义(P30d=0.082;见表1)。
表1 两组不同时间点小鼠视网膜Radixin mRNA和Radixin蛋白表达水平Table 1 Expression levels of radixin mRNA and protein in two groups at different time points ()

表1 两组不同时间点小鼠视网膜Radixin mRNA和Radixin蛋白表达水平Table 1 Expression levels of radixin mRNA and protein in two groups at different time points ()
Group 12 days 13 days 17 days 21 days 30 days Radixin mRNA OIR 0.435±0.051 0.824±0.067 2.656±0.126 1.410±0.136 1.028±0.127 Control 1.000±0.033 1.144±0.106 1.333±0.119 1.184±0.104 0.965±0.064 Radixin protein OIR 0.625±0.037 0.706±0.018 1.855±0.039 1.265±0.013 0.826±0.023 Control 0.827±0.023 0.848±0.031 1.030±0.038 0.804±0.013 0.785±0.010

Figure 4 Expression levels of radixin protein in OIR group and normal control group 高氧诱导组和正常对照组 Radixin蛋白表达
3 讨论
视网膜新生血管性疾病是一类高致盲性眼病,新生血管大量增生会引起牵拉性视网膜脱离、玻璃体出血、视网膜裂孔等病变导致视力下降或丧失,严重影响患者的生活质量。目前研究该类疾病较成熟的动物模型是Smith等[11]建立的高氧诱导视网膜新生血管动物模型,该模型建模成功率较高,模型鼠视网膜新生血管增生于建模成功后5 d即小鼠生后17 d左右达到高峰[12],增生反应一直延续到小鼠生后21 d,以后逐渐消退,30 d时视网膜血管形态基本稳定,接近正常。在本实验中,我们成功建立了高氧诱导视网膜新生血管模型,选择小鼠造模成功后0 d、1 d、5 d、9 d、18 d(即生后 12 d、13 d、17 d、21 d、30 d)这5个视网膜血管形态变化较显著的时间点来观察视网膜组织中Radixin基因和蛋白的动态表达变化,研究Radixin与视网膜新生血管形成的关系。
Radixin是 ERM(Ezrin/Radixin/moesin)蛋白家族成员之一[13],它在多种真核细胞内表达。作为膜骨架连接蛋白,它可将肌动蛋白骨架与CD43、CD44、细胞黏附分子及多种细胞膜通道和受体相连接[14-15],参与了多种细胞生物活动。研究已表明,Radixin在肿瘤进展过程中起到了重要作用,参与了肿瘤细胞的增生、迁移、浸润过程[6-7],干扰 Radixin基因表达,会抑制前列腺癌和胰腺癌细胞的增生和迁移。同时亦有研究表明,Radixin还参与了血管内皮间屏障功能改变过程[8-10]。以上研究表明,Radixin至少与细胞增生、迁移有关,而血管内皮细胞的增生、迁移又是视网膜新生血管形成过程的重要环节,所以我们推测,Radixin参与了视网膜新生血管的形成。目前虽然相关研究甚少,但我们在前期的实验研究中已发现,高氧诱导视网膜新生血管模型鼠视网膜血管增生高峰期伴随着 Radixin的高表达[16],本实验结果也证实,在正常小鼠视网膜内Radixin的表达水平较低,而在高氧诱导组小鼠视网膜新生血管生成过程中Radixin的表达水平明显增高,同时视网膜新生血管增生高峰期Radixin基因和蛋白的表达水平也达最高,Radixin的表达变化趋势与视网膜新生血管增生和衰退趋势相一致。
虽然目前以血管内皮生长因子为靶目标治疗眼部新生血管性疾病取得了一定的效果,但是眼内新生血管的生成是多种因子相互作用的结果,如有研究表明氨基胍化合物(aminoguanidine)、NADPH氧化酶[4-5]等因子也参与了眼内新生血管形成过程。由此可知单纯阻断某单一因子或受体并不能彻底抑制新生血管的生长。本研究发现,Radixin在视网膜新生血管生成过程中高表达,在视网膜新生血管生成高峰期表达水平最高,鉴于Radixin的上述作用及表达情况,通过靶向干扰Radixin的基因表达或者抑制其活性对视网膜新生血管的形成和发展可能具有重要影响。Radixin有望成为临床治疗新生血管性视网膜疾病的新靶点,但其确切的作用机制尚需进一步研究证实。
1 Gariano RF,Gardner TW.Retinal angiogenesis in development and disease[J].Nature,2005,438(7070):960-966.
2 Zou H,Otani A,Oishi A,Yodoi Y,Kameda T,Kojima H,et al.Bone marrow-derived cells are differentially involved in pathological and physiological retinal angiogenesis in mice[J].Biochem Biophys Res Commun,2010,391(2):1268-1273.
3 Hu J,Song X,He YQ,Freeman C,Parish CR,Yuan L,et al.Heparanase and vascular endothelial growth factor expression is increased in hypoxia-induced retinal neovascularization[J].Invest Ophthalmol Vis Sci,2012,53(11):6810-6817.
4 Fu ZJ,Li SY,Kociok N,Wong D,Chung SK,Lo AC.Effects of aminoguanidine on retinal apoptosis in mice with oxygen-induced retinopathy[J].Int J Ophthalmol,2013,6(4):436-441.
5 Chan EC,van Wijngaarden P,Liu GS,Jiang F,Peshavariya H,Dusting GJ.Involvement of nox2 NADPH oxidase in retinal neovascularization[J].Invest Ophthalmol Vis Sci,2013,54(12):7061-7067.
6 Valderrama F,Thevapala S,Ridley AJ.Radixin regulates cell migration and cell-cell adhesion through Rac1[J].J Cell Sci,2012,125(14):3310-3319.
7 Chen SD,Song MM,Zhong ZQ,Li N,Wang PL,Cheng S,et al.Knockdown of radixin by RNA interference suppresses the growth of human pancreatic cancer cells in vitro and in vivo[J].Asian Pac J Cancer Prev,2012,13(3):753-759.
8 Adyshev DM,Moldobaeva NK,Elangovan VR,Garcia JG,Dudek SM.Differential involvement of ezrin/radixin/moesin proteins in sphingosine 1-phosphate-induced human pulmonary endothelial cell barrier enhancement[J].Cell Signal,2011,23(12):2086-2096.
9 Koss M,Pfeiffer GR 2nd,Wang Y,Thomas ST,Yerukhimovich M,Gaarde WA,et al.Ezrin/radixin/moesin proteins are phosphorylated by TNF-alpha and modulate permeability increases in human pulmonary microvascular endothelial cells[J].J Immunol,2006,176(2):1218-1227.
10 Guo X,Wang L,Chen B,Li Q,Wang J,Zhao M,et al.ERM protein moesin is phosphorylated by advanced glycation end products and modulates endothelial permeability[J].Am J Physiol Heart Circ Physiol,2009,297(1):238-246.
11 Smith LE,Wesolowski E,McLellan A,Kostyk SK,D’Amato R,Sullivan R,et al.Oxygen-induced retinopathy in the mouse[J].Invest Ophthalmol Vis Sci,1994,35(1):101-111
12 闫 妍,原公强,董晓光,陈蕊,郑丽.Evans蓝灌注血管造影对改良型高氧诱导小鼠视网膜新生血管形态观察[J].眼科新进展,2007,27(4):658-661
13 Diakowski W,Grzybek M,Sikorski AF.Protein 4.1,a component of the erythrocyte membrane skeleton and its related homologue proteins forming the protein 4.1/FERM superfamily[J].Folia Histochem Cytobiol,2006,44(4):231-248.
14 Bretscher A,Edwards K,Fehon RG.ERM proteins and merlin:integrators at the cell cortex[J].Nat Rev Mol Cell Biol,2002,3(8):586-599.
15 Tsukita S,Yonemura S.Cortical actin organization:lessons from ERM(ezrin/radixin/moesin)proteins[J].J Biol Chem,1999,274(49):34507-34510.
16 Yang X,Dong XG,Jia CK,Wang YQ.Profiling of genes associated with the murine model of oxygen induced retinopathy[J].Mol Vis,2013,19:775-788.
