miR-29a抑制KLF4对血管平滑肌细胞表型转化的影响
2014-11-05钱德慧晋军秦浙学刘曦黄岚
钱德慧,晋军,秦浙学,刘曦,黄岚
表型转化是血管平滑肌细胞(vascular smooth muscle cells,VSMCs)参与动脉粥样硬化发生发展和新生内膜增生的分子基础[1]。既往研究发现Krupple样因子4(Krupple-like factor 4,KLF4)是VSMCs由收缩表型向合成表型转化的关键转录因子[2]。血管损伤后,上调的KLF4可促进VSMCs向合成型转化,但KLF4本身的调节机制尚不清楚[3]。研究发现,非编码小RNA(microRNA,miRNA)在VSMCs表型转换中发挥了重要作用[4],笔者利用生物信息学预分析推测KLF4可能是miRNA-29a(miR-29a)的靶基因,miR-29a在KLF4调节的VSMCs表型转化中可能扮演重要角色。本研究采用荧光素酶报告基因系统及表达调控实验,验证KLF4是否为miR-29a的靶基因,进而探讨miR-29a在VSMCs表型转化中的作用,从miRNA角度研究KLF4的部分上游调控机制,为动脉粥样硬化发生发展机制的研究提供新的思路。
1 材料与方法
1.1 主要材料及试剂 2个月龄SPF级雄性SD大鼠,体重180~200g,由第三军医大学实验动物中心提供;空载体质粒psilencer4.1-CMV、大肠埃希菌DH5α为本实验室保存。胎牛血清(FBS)、DMEM/F12、G418购自美国Gibco公司;脂质体LipofectamineTM2000购自美国Invitrogen公司;荧光素酶(luciferase)报告基因系统购自Ambion公司;野生型及突变型KLF4荧光素报告基因由吉凯基因生物公司构建;抗大鼠KLF4、SM-MHC、SM-22α、calponin、GAPDH、β-tubulin抗体购自美国Santa Cruz公司;[3H]-TdR购自重庆西南医院核医学科。
1.2 方法
1.2.1 大鼠主动脉平滑肌细胞培养 颈椎脱臼法处死大鼠[5],取胸腹主动脉,剔除外膜及脂肪组织,将血管纵向剖开刮除内膜后剪成组织块,用吸管将组织块平铺于瓶底,37℃、5%CO2孵箱干贴壁4h后,加入含20% FBS及双抗的DMEM/F12培养基继续培养,并添加10ng/ml PDGF。以后每3d更换培养液1次。
1.2.2 miR-29a靶基因验证 按转染质粒不同分为4组:野生型KLF4+miR-29a表达质粒组、野生型KLF4+阴性表达质粒组、突变型KLF4+miR-29a表达质粒组和突变型KLF4+阴性表达质粒组。具体操作为:将包含KLF4的3'-UTR区克隆至pMIRREPORTER luciferase载体编码荧光素酶基因序列,构建野生型KLF4荧光素报告基因;同时采用点突变的方法使KLF4-3'-UTR中miR-29a的结合位点发生碱基突变,构建突变型KLF4荧光素报告基因。报告基因分别与miR-29a表达质粒(psilencer4.1-CMV-mir-29a)和阴性对照质粒(psilencer4.1-CMV-vector)用电穿孔法瞬时共转染至HEK293细胞,转染48h后收集细胞,运用荧光素酶报告基因检测系统,以海肾荧光素酶作为内参照,检测萤火虫荧光素酶的活性,以确定KLF4在3'-UTR区是否含有miR-29a的结合位点。
1.2.3 Western blotting检测SM-MHC、SM-22α、calponin蛋白表达 将原代培养的VSMCs分为3组:转染miR-29a表达质粒组、转染阴性表达质粒组及未转染质粒组。分别转染miR-29a表达质粒、阴性表达质粒和未转染质粒(均添加10ng/ml PDGF),48h后PBS洗涤细胞,以含PMSF裂解液冰上裂解30min。裂解后将细胞碎片和裂解液离心20min(4℃,16 000r/min),收集上清,取其中少量测蛋白浓度,其余分装冻存。取等量预处理的蛋白样品上样,SDS-PAGE电泳,电转至PVDF膜,5%脱脂奶粉-PBST室温封闭1h。KLF4检测:加入羊抗大鼠KLF4抗体、小鼠抗大鼠GAPDH(内参);VSMCs收缩表型蛋白检测:加入羊抗大鼠SM-MHC、SM-22α、calponin抗体及小鼠抗大鼠β-tubulin(内参)。4℃孵育过夜,再与HRP标记的兔抗羊IgG、抗鼠IgG 37℃孵育1h。按ECL发光试剂盒说明书操作,凝胶成像仪(美国Bio-Rad公司)曝光、照相。结果以目的蛋白与内参的相对表达量表示。
1.2.4 [3H]-TdR掺入法检测细胞增殖能力 分组及干预方法同1.2.3。去血清培养平滑肌细胞6h后,加入10μl [3H]-TdR,使其终浓度为37kBq/ml。24h后吸弃培养液,等量PBS洗涤。0.25%胰酶500μl消化,并将细胞悬液转移入小试管。用多头细胞收集器将细胞悬液收集于玻纤滤纸上。0.9%NaCl 3ml洗涤3次后,5%三氯醋酸2ml洗2次,固定细胞;无水乙醇1ml脱水。取烘干的玻纤滤纸置入闪烁杯中,加闪烁液,暗适应3h后上机检测。掺入量以每孔每分钟闪烁数(counts per min per well,cpm/well)表示。
1.3 统计学处理 采用SPSS 11.5软件进行数据分析,定量资料以表示。两组间均数比较采用t检验,三组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-29a靶基因的验证 与其余3组比较,共转染野生型KLF4荧光素报告基因+miR-29a表达质粒的实验组中,荧光素酶活性显著降低(图1),提示KLF4是接受miR-29a调控的靶基因。
2.2 miR-29a对KLF4蛋白表达的影响 体外培养48h后,转染miR-29a表达质粒组KLF4蛋白表达水平(0.36±0.02)显著低于未转染质粒组及转染阴性表达质粒组(分别为1.52±0.06、1.55±0.05,P<0.01,图2)。
2.3 miR-29a对VSMCs收缩表型蛋白表达的影响将体外培养的VSMCs(添加10ng/ml PDGF)转染miR-29a表达质粒后48h,与未转染及转染阴性表达质粒组相比,VSMCs收缩表型相关蛋白SM-MHC、SM-22α、calponin的表达均明显增高(P<0.01,图3)。
2.4 miR-29a对VSMCs增殖能力的影响 经[3H]-TdR掺入法检测,与未转染质粒组(18 145±985cpm/well)相比,转染miR-29a表达质粒后VSMCs的增殖能力(10 125±881cpm/well,n=6)明显降低(P<0.01),而转染阴性表达质粒组VSMCs的增殖能力(18 004±1013cpm/well)与未转染质粒组相比差异无统计学意义(P>0.05)。
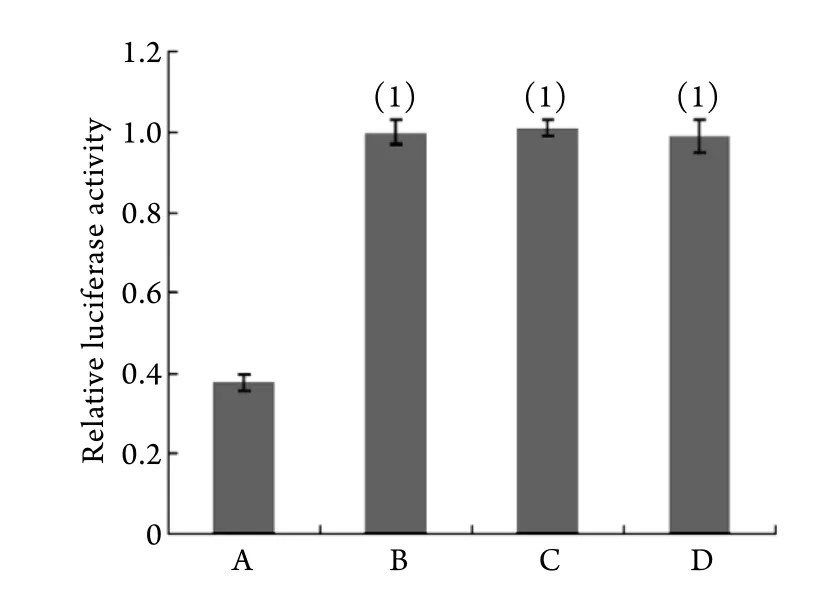
图1 各组相对荧光素酶活性Fig.1 Relative luciferase activity of each group

图2 miR-29a质粒转染对VSMCs中KLF4蛋白表达的影响(n=6)Fig.2 Effect of miR-29a plamid transfection on VSMCs KLF4 protein expression (n=6)
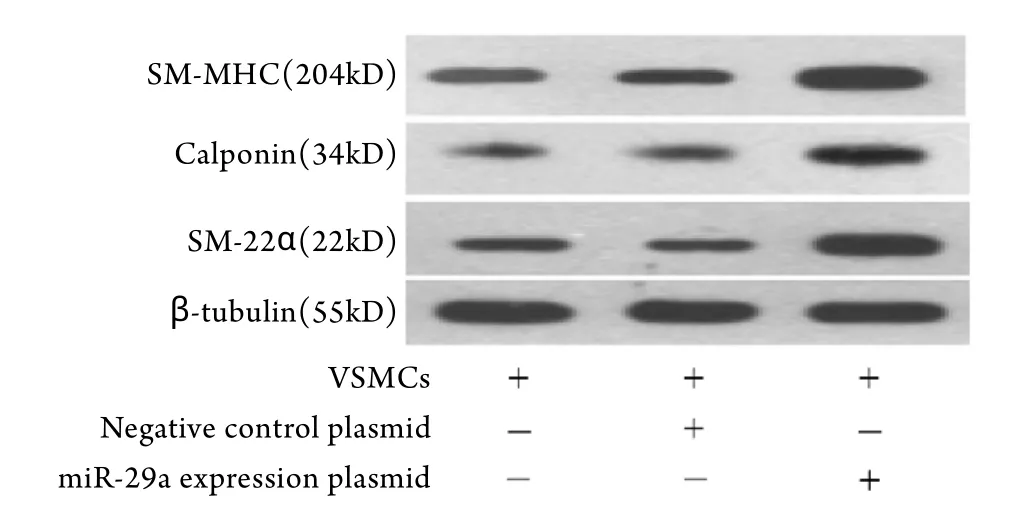
图3 miR-29a质粒转染对VSMCs收缩表型相关蛋白表达的影响Fig.3 Effect of miR-29a plasmid transfection on expression of VSMCs contractile phenotype associated protein
3 讨 论
miRNA是一类内源性小分子、单链、21~22nt长度的非编码RNA[6]。miRNA对基因表达主要发挥负性调控作用。其作用发挥依赖于自身“种子序列”与靶基因3'端非翻译区(3'-UTR)的结合,然后经由RNA介导的沉默复合体(RNA-inducing silence complex,RISC)来实现[7]。由于miRNA调控具有序列依赖性,因此结合生物信息学手段,可以预测调控KLF4的miRNAs。本研究同时采用3种预测数据库(www.targetscan.org,http://www.mirbase.org/index.shtml和http://cbio.mskcc.org/cgi-bin/mirnaviewer/mirnaviewer.pl)来预测可能调控KLF4的miRNAs,结果显示在3种数据库预测的miRNAs交集包括:miR-7,miR-34c,miR-32c,miR-128,miR-148/152,miR-29a,miR-29b,miR-29c。鉴于miRNA分布具有组织特异性[8],不同的miRNA在VSMCs的表达强度不同,而在上述miRNA分子中,仅miR-29a在VSMCs中具有较高表达[8-9]。因此,miR-29a是最有可能在VSMCs中调控KLF4的miRNA。本研究采用荧光素酶报告基因系统检测,结果显示,共转染野生型KLF4荧光素报告基因+miR-29a表达质粒的实验组中,荧光素酶活性显著降低,也证实了KLF4是接受miR-29a调控的靶基因。
基于上述发现,我们通过进一步转染表达质粒,发现miR-29a上调可抑制KLF4蛋白的表达,且促进SM-MHC、SM-22α、calponin蛋白的表达。既往研究表明,KLF4在球囊损伤侧的大鼠颈动脉后VSMCs中表达上调,而在未受损侧大鼠颈动脉VSMCs中低表达[10]。KLF4可抑制VSMCs收缩相关基因的表达,抑制其分化表型;高表达的KLF4有助于VSMCs由收缩表型向合成表型的转化。KLF4调控VSMCs表型转化的可能机制是:①KLF4可通过结合VSMCs收缩相关基因的启动子序列发挥负性调控作用。KLF4可结合CC(A/T-rich)GG区以及转化生长因子-β(TGF-β)控制元件,进而抑制TGF-β诱导的收缩功能相关基因的表达。②KLF4还可抑制SRF和myocardin等转录因子与收缩相关基因调控序列的结合而发挥负性调控作用。这也很好地解释了本研究中miR-29a在抑制KLF4的同时,还可促进VSMCs收缩表型蛋白的表达。
本研究还发现,miR-29a上调可降低VSMCs的增殖能力。VSMCs为非终末分化细胞,具有一定的可塑性。研究证实,多种刺激因子如细胞外基质[11]、炎症因子[12]、剪切力[13]、氧化产物、脂质等均会启动VSMCs表型转化开关,使之呈现出不同的表型特征。VSMCs表型转化主要是指其由收缩表型(contractile phenotype,亦即differentiation phenotype)向合成表型(synthetic phenotype,亦即dedifferentiation phenotype)转化。收缩表型的VSMCs高表达收缩功能相关蛋白,如SM-MHC、SM-22α及α-calponin等[14];合成型VSMCs低表达收缩功能相关蛋白,高表达细胞外基质蛋白。而向合成表型转化是VSMCs获得更强增殖和迁移能力的分子基础。
综上,本研究发现miR-29a可靶向抑制KLF4的表达,进而维持VSMCs的收缩表型,降低其增殖能力。但miR-29a在机体生理及病理状态的表达水平究竟如何,哪些因素在miR-29a的表达调节中发挥重要作用目前仍不清楚。针对上述问题进行深入探讨,可为动脉粥样硬化发生发展机制的研究提供重要的理论和实验依据。
[1]Gao P, Si LY, Xu Q, et al. Inhibitory effect of resveratrol on proliferation of vascular smooth muscle cells induced by angiotensin Ⅱ and its underlying mechanism[J]. Med J Chin PLA, 2013, 38(4): 269-273. [郜攀, 司良毅, 徐强, 等. 白藜芦醇对血管紧张素Ⅱ诱导的血管平滑肌细胞增殖的抑制作用及其机制观察[J]. 解放军医学杂志, 2013, 38(4): 269-273.]
[2]Zheng B, Han M, Wen JK. Role of Krüppel-like factor 4 in phenotypic switching and proliferation of vascular smooth muscle cells[J]. IUBMB Life, 2010, 62(2): 192-199.
[3]Shi JH, Zheng B, Chen S, et al. Retinoic acid receptor α mediates all-trans-retinoic acid-induced Klf4 gene expression by regulating Klf4 promoter activity in vascular smooth muscle cells[J]. J Biol Chem, 2012, 287(14): 10799-10811.
[4]Lovren F, Pan Y, Quan A, et al. MicroRNA-145 targeted therapy reduces atherosclerosis[J]. Circulation, 2012, 126(11): S81-S90.[5]Qian DH, Wu XJ, Jiang H, et al. Construction of an eukaryotic vector expressing Jagged1 gene and its effect on proliferation and apoptosis of vascular smooth muscle cells[J]. Acta Acad Med Militaris Tertiae, 2011, 33(11): 1095-1098. [钱德慧, 武晓静,姜洪, 等. Jagged1真核表达质粒构建及其对VSMCs增殖凋亡的影响[J]. 第三军医大学学报, 2011, 33(11): 1095-1098.]
[6]Zhang Y, Lv YJ, Yang BF. miRNA: a new target in treatment of heart diseases[J]. Chin J Pract Inter Med, 2010, 30(8): 677-680.[张妍, 吕延杰, 杨宝峰. miRNA——心脏疾病治疗的新靶点[J]. 中国实用内科杂志, 2010, 30(8): 677-680.]
[7]Wen XL, Sun HW, Ou XL, et al. Construction of mouse DUSP1 3'-UTR dual luciferase reporter system and its function identification[J]. Med J Chin PLA, 2013, 38(4): 265-268. [温晓梨, 孙宏卫, 欧小利, 等. 小鼠DUSP1 3'-UTR双荧光素酶报告基因表达系统的建立及功能鉴定[J]. 解放军医学杂志,2013, 38(4): 265-268.]
[8]Christodoulou F, Raible F, Tomer R, et al. Ancient animal microRNAs and the evolution of tissue identity[J]. Nature,2010, 463(7284): 1084-1088.
[9]Ji R, Cheng Y, Yue J, et al. MicroRNA expression signature andantisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation[J]. Circ Res,2007, 100(11): 1579-1588.
[10]Yoshida T, Kaestner KH, Owens GK. Conditional deletion of Kruppel-like factor 4 delays downregulation of smooth muscle cell differentiation markers but accelerates neointimal formation following vascular injury[J]. Circ Res, 2008, 102(12): 1548-1557.
[11]Orr AW, Lee MY, Lemmon JA, et al. Molecular mechanisms of collagen isotype-specific modulation of smooth muscle cell phenotype[J]. Arterioscler Thromb Vasc Biol, 2009, 29(2): 225-231.
[12]Thomas JA, Deaton RA, Hastings NE, et al. PDGF-DD, a novel mediator of smooth muscle cell phenotypic modulation, is upregulated in endothelial cells exposed to atherosclerosis-prone flow patterns[J]. Am J Physiol Heart Circ Physiol, 2009, 296(2):H442-H452.
[13]Tsai MC, Chen L, Zhou J, et al. Shear stress induces syntheticto-contractile phenotypic modulation in smooth muscle cells via peroxisome proliferator-activated receptor alpha/delta activations by prostacyclin released by sheared endothelial cells[J]. Circ Res, 2009, 105(5): 471-480.
[14]Han M, Dong LH, Zheng B, et al. Smooth muscle 22 alpha maintains the differentiated phenotype of vascular smooth muscle cells by inducing filamentous actin bundling[J]. Life Sci,2009, 84(13-14): 394-401.
