PCNA对口腔鳞癌细胞凋亡和增殖的影响
2014-11-05赵莉琳刘阳
赵莉琳,刘阳
口腔癌是临床常见的恶性肿瘤之一,全球每年新增口腔癌患者约10万人[1]。绝大多数口腔癌为口腔鳞癌(oral squamous cell carcinoma,OSCC),恶性程度较高,治疗主要以手术、放化疗相结合的综合治疗为主,患者的5年生存率仅为50%[2]。近年来,靶向药物设计从多个信号途径对肿瘤进行抑制,已成为研究的热点,因此,对口腔鳞癌进行深入研究,寻找更多的潜在靶点十分必要[3-4]。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)只存在于正常增殖细胞以及肿瘤细胞内,与细胞DNA合成密切相关,对细胞增殖起重要作用[5-6],是细胞异常增殖的关键蛋白。近年来,PCNA与肿瘤发生发展的关系逐渐成为研究热点[7]。PCNA基因在很多肿瘤中高表达,包括胃癌、肝癌、结肠癌、乳腺癌、膀胱癌以及肺癌等[8-10]。李向新等[11]对48例口腔鳞癌组织以及正常口腔黏膜中PCNA蛋白的表达水平进行检测发现,PCNA在48例口腔鳞癌中均有不同程度表达,而在正常口腔黏膜细胞中均为表达阴性,提示PCNA可能在口腔鳞癌的发生发展中起重要作用。阿达莱提等[12]也报道了同样的发现。本研究通过增强或者抑制PCNA在口腔鳞癌TCA8113细胞中的表达,探讨了PCNA基因在TCA8113细胞系凋亡和增殖中的作用。
1 材料与方法
1.1 材料与试剂 人口腔鳞癌细胞株TCA8113、低表达载体pSilencer、高表达载体pcDNA3.1由本室保存,RPMI 1640,胎牛血清、Trizol、Lipofectamine 2000、反转录试剂盒购自美国Invitrogen公司。Myc抗体购自北京全式金生物技术有限公司,兔抗鼠二抗购自北京中杉金桥公司。限制性内切酶、Taq酶等常用试剂购自日本TaKaRa公司或全式金生物技术有限公司。引物合成、测序在上海生工生物工程公司进行。四甲基偶氮唑蓝(MTT)购自美国Sigma公司,顺铂购于山东齐鲁制药厂,使用浓度为4μg/ml。实时荧光定量PCR试剂盒为全式金生物技术有限公司产品,凋亡检测试剂盒购自深圳晶美生物工程有限公司。
1.2 细胞培养 人口腔鳞癌TCA8113细胞株在37℃、5%CO2条件下,用含有10%胎牛血清、100U/ml青霉素、100μg/ml链霉素的RPMI 1640培养基常规培养。
1.3 质粒构建 质粒构建按常规操作。设计合成特异性PCNA引物,从cDNA模板中PCR克隆出PCNA基因CDS全长,经过酶切、连接,构建成功pcDNA3.1-PCNA高表达载体,重组载体融合Myc标签,可用Anti-Myc抗体检测。RNA干涉采用文献设计的小发夹RNA序列[13],shPCNA靶序列为:正义5'-CAGACAAGTAATGTCGATAAA-3',反义5'-TTTATCGACATTACTTGTCTG-3'。按要求合成序列,克隆入pSilencer载体,构建pSilencer-shPCNA干涉载体。所有实验用载体均经过测序验证。
1.4 Western blotting检测PCNA高表达 将构建的pcDNA3.1-PCNA重组载体转染TCA8113细胞,转染48h后收集细胞行Western blotting检测。按照要求制备样品,加入电泳缓冲液,配制聚丙烯酰胺凝胶(SDS-PAGE),上样电泳,转膜。取出PVDF膜后进行抗体孵育,采用化学发光底物检测。以pcDNA3.1空载体转染作为对照组。
1.5 实时荧光定量PCR 制备cDNA模板,按照试剂盒说明书进行实时荧光定量PCR检测。PCNA:正义5'-AAGCCGAAACCAGCTAGACTTTC-3',反义5'-TGGCGGAGTGGCAACAA-3';Actin:正义5'-AGGCCAACCGTGAAAAGATG-3',反义5'-ACCAGAGGCATACAGGGACAA-3'。将荧光染料SYBR Green与目的基因PCNA和内参Actin的引物混匀,放入实时PCR仪进行反应,测定PCNA mRNA表达的Ct值,计算mRNA的相对表达量[14]。
1.6 细胞凋亡检测 将pcDNA3.1-PCNA(高表达)或pSilencer-shPCNA(沉默)转染TCA8113细胞,48h后收集细胞,采用Annexin V/PI染色,流式细胞仪检测细胞凋亡。按照说明书进行操作,首先收集细胞并洗涤制备样品,将细胞与Annexin V试剂孵育,冰上反应30min,临检测前加入5μl碘化丙啶(propidium iodide,PI),立即上流式细胞仪检测。以pcDNA3.1空载体转染作为对照组,pcDNA3.1-PCNA或pSilencer-shPCNA转染为实验组,重复3次。同样另设对照组和实验组细胞,转染后加入4μg/ml顺铂处理,即可检测PCNA对顺铂诱导细胞凋亡的影响。
1.7 细胞增殖检测 将TCA8113细胞接种于96孔板,转染pcDNA3.1-PCNA重组载体或pcDNA3.1空载体(各设4孔),分别于转染24、48、72、96h后,每孔加入10μl MTT储液(10mg/ml),37℃培养4h,小心吸出孔内培养液,每孔加入150μl DMSO,酶标仪检测A490值。实验组存活率=(实验组A490/对照组A490)×100%。实验重复3次。pSilencer-shPCNA转染做类似处理。实验以pcDNA3.1空载体转染作为对照组,pcDNA3.1-PCNA或pSilencer-shPCNA转染为实验组。
1.8 统计学处理 采用SPSS 19.0软件进行统计分析,数据结果以s表示,同一时间点对照组和实验组细胞凋亡率(或存活率)比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 转染pcDNA3.1-PCNA载体后PCNA基因的表达情况 通过Anti-Myc抗体检测发现,转染pcDNA3.1空载体的对照组未检测到PCNA表达,转染pcDNA3.1-PCNA的实验组中检测到PCNA高表达(图1)。
2.2 转染pSilencer-shPCNA载体后PCNA基因mRNA的表达 TCA8113细胞转染pSilencershPCNA后48h,其mRNA水平(35.7%±10.0%)明显低于对照组(转染pSilencer空载体)的mRNA水平(93.3%±14.0%,P=0.006)。

图1 转染pcDNA3.1-PCNA高表达载体后PCNA基因的表达Fig.1 PCNA gene expression after transfection by hyper expressed pcDNA3.1-PCNA
2.3 PCNA基因高表达对TCA8113细胞增殖的影响MTT检测结果显示,随着时间延长,实验组或对照组细胞的存活率逐渐增高,对照组24、48、72、96h细胞存活率分别为45.1%±2.2%、52.1%±2.3%、60.2%±3.1%、69.4%±2.8%,实验组24、48、72、96h细胞存活率分别为49.7%±1.5%、64.2%±2.9%、68.8%±2.6%、74.4%±2.5%,除96h外,两组同一个时间点间比较差异均有统计学意义(P<0.05,图2)。
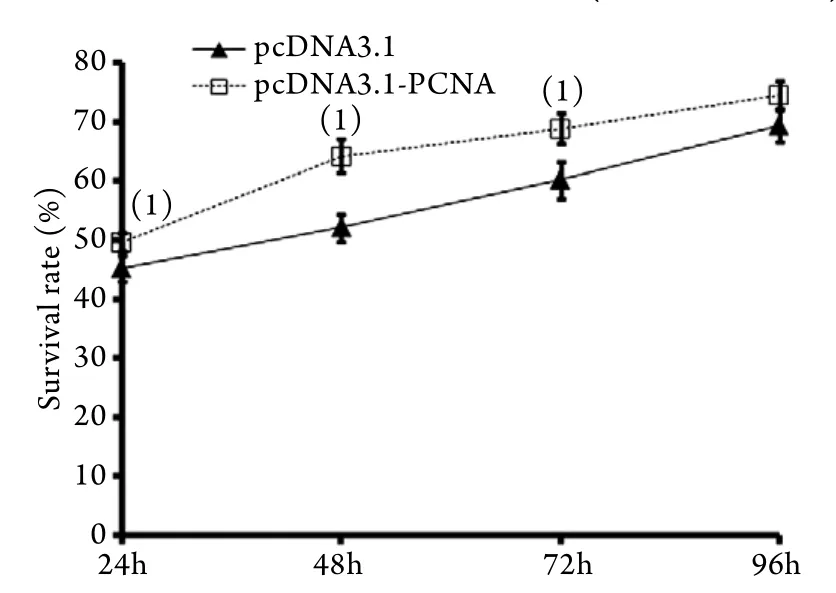
图2 PCNA基因高表达对TCA8113细胞存活率的影响Fig.2 Effect of hyper expression of PCNA on survival of TCA8113 cells
2.4 PCNA基因沉默对TCA8113细胞增殖的影响MTT检测结果显示,随着时间延长,实验组或对照组的细胞存活率逐渐增高,对照组24、48、72、96h细胞存活率分别为48.5%±2.1%、58.2%±2.3%、65.6%±3.5%、70.4%±2.5%,PCNA沉默组24、48、72、96h细胞存活率分别为43.1%±1.4%、50.2±1.5%、55.8±2.1%、63.4±2.4%,两组同一个时间点间比较差异均具有统计学意义(P<0.05,图3)。
2.5 PCNA基因高表达对顺铂诱导TCA8113细胞凋亡的影响 流式细胞仪检测结果显示,未用顺铂处理的情况下,对照组细胞凋亡率为13%,而PCNA高表达后细胞凋亡率明显降低(7%,P=0.030);应用顺铂处理的情况下,PCNA高表达组的TCA8113细胞凋亡率(16%)亦明显低于对照组(41%,P=0.011,图4)。
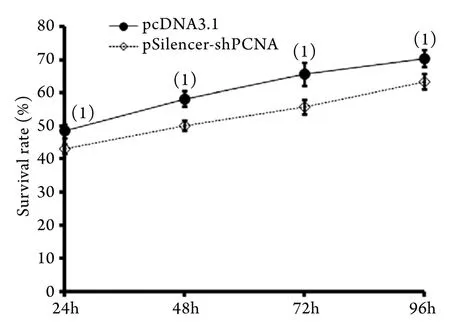
图3 PCNA基因沉默对TCA8113细胞存活率的影响Fig.3 Effect of PCNA silence on survival of TCA8113 cells
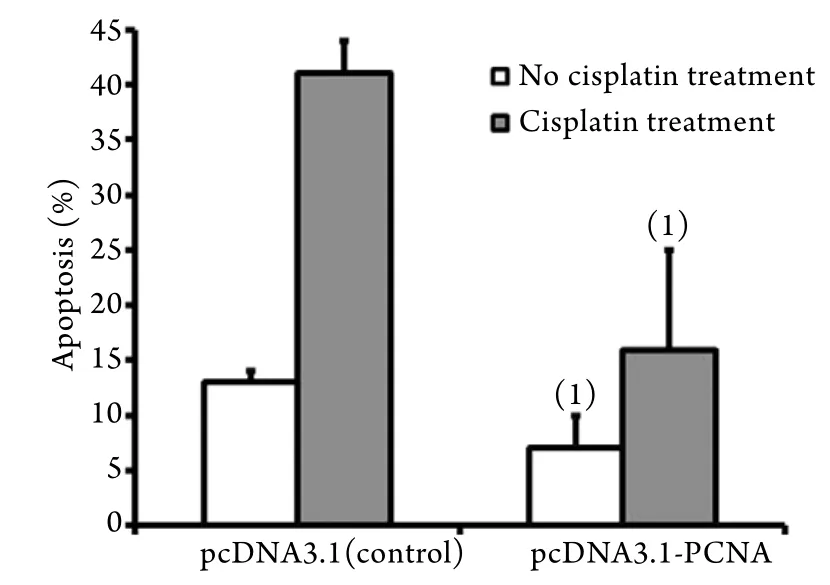
图4 PCNA基因高表达对顺铂诱导的TCA8113细胞凋亡的抑制作用Fig.4 Inhibition effect of PCNA hyper expression on apoptosis of TCA8113 cells induced by cisplatin
2.6 PCNA基因沉默对顺铂诱导TCA8113细胞凋亡的影响 流式细胞仪检测结果显示,无顺铂处理的情况下,PCNA沉默后细胞凋亡率(24%)与对照组(15%)比较差异无统计学意义(P=0.248);采用顺铂处理后,PCNA沉默组TCA8113细胞凋亡率(66%)明显高于对照组(36%,P=0.001,图5)。
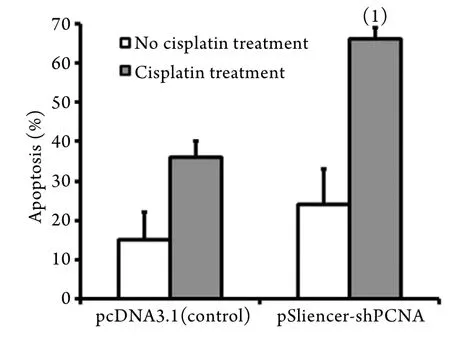
图5 PCNA基因沉默对顺铂诱导的TCA8113细胞凋亡的促进作用Fig.5 Promotion effect of PCNA silence on apoptosis of TCA8113 cells induced by cisplatin
3 讨 论
PCNA基因是人DNA复制复合体的核心组分,具有特殊的环状结构,可推动DNA复制,且PCNA基因能够与多种细胞内分子结合,参与细胞周期调控、DNA损伤修复、DNA甲基化、染色体重塑等多种重要功能[5,15]。此外,PCNA与细胞凋亡及增殖密切相关,已有多项研究报道PCNA在肿瘤如胃癌、肺癌、结直肠癌、胰腺癌以及多种妇科肿瘤中呈高表达[8-9]。PCNA的异常表达与肿瘤的发生发展密切相关,可用于评估肿瘤的恶性程度及增殖潜能,且在不同时期的肿瘤中具有不同的表达水平[8]。最近有多篇文献报道了PCNA在口腔鳞癌中呈异常表达,而在正常口腔黏膜细胞中不表达[11-12],推测PCNA基因可能与口腔鳞癌的发生发展有关,对其进行研究可加深对PCNA基因本身以及口腔鳞癌的理解,并且PCNA可能作为口腔鳞癌治疗的一个潜在靶点[3,16]。
本研究以TCA8113口腔鳞癌细胞作为研究对象,构建pcDNA3.1-PCNA高表达载体和pSilencershPCNA基因沉默载体,通过基因转染高表达PCNA或者沉默PCNA基因,再检测分析PCNA对口腔鳞癌细胞增殖和凋亡的影响。我们采用Western blotting检测验证了高表达的有效性,同时,采用荧光定量PCR结果验证了基因沉默的有效性,转染pSilencer-shPCNA的实验组PCNA mRNA表达水平显著下调。
肿瘤的发生源于细胞的异常增殖,本研究利用PCNA高表达或基因沉默,进一步检测PCNA基因对TCA8113细胞增殖的影响。MTT实验是检测细胞增殖的常用方法,本研究设置了不同的时间点,通过MTT检测发现PCNA基因高表达可促进TCA8113细胞的增殖(P<0.05),而沉默PCNA基因可抑制TCA8113细胞的增殖(P<0.05)。为了进一步验证PCNA基因与口腔鳞癌发生发展的关系,并探讨其初步机制,本研究采用Annexin V/PI染色法检测了PCNA高表达和低表达对细胞凋亡的影响,结果显示在TCA8113细胞凋亡过程中,PCNA高表达抑制了凋亡(对照组细胞凋亡率为13%,PCNA高表达后细胞凋亡率降低到7%),而PCNA沉默则促进了凋亡(PCNA沉默后细胞凋亡率为24%,对照组的细胞凋亡率为15%)。因此,推测PCNA基因的异常表达与口腔鳞癌细胞系的增殖有关。
化疗药物可杀伤肿瘤细胞,是目前治疗肿瘤的主要手段之一。近来的研究表明,化疗药物主要作用于肿瘤细胞生长的不同环节上(抑制增殖或直接诱导肿瘤细胞凋亡)[17-18],但是肿瘤细胞对化疗药物产生耐药性也是目前亟待解决的难题。文献报道PCNA基因在口腔鳞癌中高表达,而在正常的口腔黏膜细胞中不表达[11-12],本研究也证实PCNA基因参与了TCA8113口腔鳞癌细胞的增殖和凋亡通路。因此,我们设想PCNA基因可能作为肿瘤治疗的潜在靶点,可以通过干扰PCNA基因的表达来影响其凋亡或增殖通路,从而增强肿瘤细胞对化疗药物的敏感性,提高治疗效果[3,16]。顺铂是常用的化疗药物,本研究采用顺铂来诱导口腔鳞癌细胞凋亡,结果发现,在顺铂诱导TCA8113细胞凋亡的过程中,PCNA高表达可抑制凋亡(对照组凋亡率为41%,PCNA高表达组为16%),而PCNA沉默可促进凋亡(对照组凋亡率为36%,PCNA沉默组为66%),差异均有统计学意义(P<0.05),该结果证实干扰PCNA基因可增强顺铂对口腔鳞癌细胞的杀伤效果,初步表明PCNA基因作为潜在靶点是可行的,但仍需进一步深入研究。
[1]Bose P, Brockton NT, Dort JC. Head and neck cancer: from anatomy to biology[J]. Int J Cancer, 2013, 133(9): 2013-2023.
[2]da Silva SD, Ferlito A, Takes RP, et al. Advances and applications of oral cancer basic research[J]. Oral Oncol, 2011, 47(9): 783-791.
[3]Le Tourneau C, Siu LL. Molecular-targeted therapies in the treatment of squamous cell carcinomas of the head and neck[J].Curr Opin Oncol, 2008, 20(3): 256-263.
[4]Khan Z, Bisen PS. Oncoapoptotic signaling and deregulated target genes in cancers: special reference to oral cancer[J].Biochim Biophys Acta, 2013, 1836(1): 123-145.
[5]Maga G, Hubscher U. Proliferating cell nuclear antigen (PCNA):a dancer with many partners[J]. J Cell Sci, 2003, 116(Pt 15):3051-3060.
[6]Liu XH, Zhang Y. Expression and significance of C-fos and proliferating cell nuclear antigen in the small intestinal tissue of human fetus[J]. Med J Chin PLA, 2011, 36(2): 145-148. [刘学红, 张泳. C-fos和增殖细胞核抗原在人胎小肠组织中的表达及意义[J]. 解放军医学杂志, 2011, 36(2): 145-148.]
[7]Naryzhny SN. Proliferating cell nuclear antigen: a proteomics view[J]. Cell Mol Life Sci, 2008, 65(23): 3789-3808.
[8]Li B, Chen L. Relationship between gastric cancer and the expressions of IL-6, IL-6 receptor and proliferating cell nuclear antigen[J]. Med J Chin PLA, 2007, 32(7): 710-712. [李冰, 陈凛. IL-6、IL-6R及PCNA的表达与胃癌的临床关系研究[J].解放军医学杂志, 2007, 32(7): 710-712.]
[9]Setia S, Sanyal SN. Downregulation of NF-κB and PCNA in the regulatory pathways of apoptosis by cyclooxygenase-2 inhibitors in experimental lung cancer[J]. Mol Cell Biochem, 2012, 369(1-2): 75-86.
[10]Gao L, Wang GF, Ji XD, et al. Expression of NF-κB p65 and PCNA during oral leukoplakia carcino-genesis[J]. J Zhengzhou Univ (Med Sci), 2009, 44(3): 582-585. [高黎, 王国芳, 季旭东,等. 口腔黏膜白斑及鳞癌组织中核因子-JB p65与PCNA的表达[J]. 郑州大学学报(医学版), 2009, 44(3): 582-585.]
[11]Li XX, Jiang L, Bai L, et al. Expression and clinical significance of Livin and PCNA in oral squamous cell carcinoma[J]. J Pract Stomatol, 2011, 27(4): 562-565. [李向新, 蒋蕾, 白玲, 等. Livin和PCNA在口腔鳞癌中的表达及意义[J]. 实用口腔医学杂志, 2011, 27(04) : 562-565.]
[12]Ada Eli Te, Patimem, Lu XM, et al. The expression of p53 and PCNA in Oral squamous cell carcinoma and immunohistochemical analysis of S-100 positive dendritic cell infiltration[J]. Acta Acad Med Xinjiang, 1996, 19(4): 289-293. [阿达莱提, 帕提曼, 卢晓梅, 等. 口腔鳞状细胞癌p53、PCNA表达及S-100阳性树突状细胞浸润的免疫组化定量分析[J]. 新疆医学院学报, 1996, 19(4): 289-293.]
[13]Gong BF, Yan CY, Experimental study of suppressing effect of siRNA and shRNA targeting PCNA gene on growth of bladder cancer in vitro and in vivo[D]. China Doctoral Dissertations Full-Text Database, 2009. 46-51. [贡冰峰, 严春寅, 靶向PCNA基因的siRNA和shRNA抑制膀胱癌生长的体内外实验研究[D].中国博士学位论文全文数据库, 2009, 46-51.]
[14]Gao HL, Ouyang GL, Huang XX, et al. Effect of Bushen Qianggu decoction on the proliferation of synovial fibroblasts and expression of PCNA and Bcl-2[J]. Chin J Orthop Traumatol,2012, 25(11): 942-945. [高华利, 欧阳桂林, 黄新星, 等. 补肾强骨方含药血清对滑膜成纤维细胞增殖及PCNA和Bcl-2表达的影响[J]. 中国骨伤, 2012, 25(11): 942-945.]
[15]Song LM, San JL, Xu H. The molecular structure and biological functional progress of proliferating cell nuclear antigen(PCNA)[J]. Prog Nat Sci, 2006, 16(10): 1201-1209. [宋楠萌, 桑建利,徐恒. 增殖细胞核抗原(PCNA)的分子结构及其生物学功能研究进展[J]. 自然科学进展, 2006, 16(10): 1201-1209.]
[16]Zhao H, Lo YH, Ma L, et al. Targeting tyrosine phosphorylation of PCNA inhibits prostate cancer growth[J]. Mol Cancer Ther,2011, 10(1): 29-36.
[17]Shortt J, Johnstone RW. Oncogenes in cell survival and cell death[J]. Cold Spring Harb Perspect Biol, 2012, 4(12): a009829.
[18]Liu DQ. Progress in the treatment of tumor[J]. Med J Chin PLA,2007, 32(7): 661-663. [刘端祺. 关注肿瘤治疗的新进展[J].解放军医学杂志, 2007, 32(7): 661-663.]
