深度碳化法处理碳酸盐型锂精矿生产电池级碳酸锂
2014-10-17彭秋华
彭秋华
(白银扎布耶锂业有限公司,甘肃白银 730900)
在西藏,有不少盐湖(主要是扎布耶盐湖)富含锂而且主要是碳酸盐型,经过晒盐后结晶出含碳酸锂质量分数为50%~75%的锂精矿,此锂精矿还含有少量氯化物和硫酸盐。经矿物物相分析,此锂精矿以碳酸锂为主;其次为天然碱、钾芒硝、石盐、粘土矿物;少量泡碱、石英、长石、透闪石等夹杂物。碳酸锂自形—半自形晶体少,多数呈断碎状晶体形态;天然碱多为自形—半自形晶体,晶形小;钾芒硝为半自形板粒状。此矿物的化学分析结果见表1。

表1 锂精矿化学分析结果 %
要将此精矿提纯为纯度为99%以上的碳酸锂产品,以前采用的是石灰苛化法工艺,此工艺流程如下:锂精矿磨细→洗矿→苛化→分离氢氧化锂溶液及锂渣→蒸发浓缩→除杂→二氧化碳碳化→分离洗涤→碳酸锂产品。此工艺需要消耗石灰,产生较多的锂渣(每吨产品产出锂渣约2.8 t),苛化液还必须蒸发浓缩(从Li2O质量浓度约为18 g/L提高到50~60 g/L),需要消耗较多的能源,最关键的是此工艺生产出的碳酸锂只能达到工业级碳酸锂标准,还不能直接用作锂电池正极材料的原料。而要得到可用于电池正极材料的电池级碳酸锂,则必须将工业级碳酸锂再提纯或将工业级氢氧化锂进行碳化转化,这样生产电池级碳酸锂存在工艺流程长、能耗高、渣量大、成本高等问题。为了使碳酸锂型锂精矿的提纯工艺更环保、能耗更低、成本更低、产品质量更高,笔者通过多年的试验研究,终于开发成功了深度碳化法处理碳酸盐型锂精矿生产电池级碳酸锂新工艺。
1 实验部分
1.1 原料准备
本次实验主要用的是品位近70%的好矿,经烘干、磨碎、一次加热搅洗、压滤、烘干、再磨碎,然后用于碳化。后来为了检验差矿能否用于碳化,也用了一点品位约为50%的差矿。经过处理后用于碳化的几批矿的情况如下:
1#洗精矿,品位为 92.82%,w(粒径小于 128 μm粒子)=95%;2#洗精矿,品位为 85.40%,w(粒径小于128 μm 粒子)=94.5%;3#洗精矿,品位为 63.18%,w(粒径小于 128 μm 粒子)=96%;4#洗精矿,品位为87.1%,w(粒径小于 128 μm 粒子)=96%;甘肃白银试验用矿,平均品位为79.71%,w(粒径小于128 μm粒子)=84.25%。
1.2 碳化实验
碳化实验主要分为两部分来做,第一部分是考察碳化终点与碳化液pH的关系,第二部分是考察碳化压力与碳化液浓度的关系及碳化时间与碳化终点的关系。
1.2.1 碳化时间、碳化液pH与碳化液浓度之间的关系
第一部分的实验是在小型有机玻璃碳化塔上进行的,选择小碳化塔的原因是易于操作。表2是碳化时间、碳化液pH与碳化液浓度之间的关系表。从表2可以看出,碳化趋于完成的时候,碳化液的pH也趋于平稳,说明它们之间还是有一定的相关性。碳化2 h反应已基本接近终点(已达最高质量浓度的95%以上),再延长反应时间,质量浓度升幅很小。碳化液的pH随着碳化液质量浓度的升高而降低,当碳化接近终点或到达终点时,碳化液的pH也随之趋于稳定,变化很小。所以,可以根据碳化液的pH来认定反应的终点。

表2 碳化时间、碳化液pH与碳化液浓度之间的关系
1.2.2 碳化液浓度与碳化时二氧化碳压力的关系
第二部分碳化实验是在不锈钢反应锅内进行的,主要是要考察碳化液的浓度随二氧化碳压力变化的情况和碳化终点浓度与碳化温度的关系,同时也进一步考察碳化时间与碳化终点的关系。经过多轮实验,得出在反应时间为2 h、反应温度为25℃左右时,碳化液浓度与二氧化碳压力的关系如表3所示。从表3可以看出,由于碳化压力的升高,碳化液终点浓度也有了明显的升高。比如碳化压力为0.2 MPa时,碳化液中Li2O终点质量浓度约为23 g/L,这个质量浓度比目前苛化液质量浓度(约18 g/L)高出了20%还多;当碳化压力为0.4 MPa时,碳化液中Li2O终点质量浓度约为25.8 g/L,这个质量浓度比目前苛化液质量浓度则高出了40%还多。因此,采用加压碳化时,由于碳化液中Li2O终点浓度比较高,相应减小了过程中的液体物料流通量,因而也就可以减小设备的规模,降低厂房和设备的投资。

表3 碳化液浓度与碳化时二氧化碳压力的关系
1.2.3 碳化液终点浓度与碳化反应温度的关系(第三阶段试验)
根据在甘肃白银的试验情况,笔者发现碳化反应与碳化时控制的料浆温度有很大关系,因此在2007年1月10日—23日期间,在福州又进行了一系列试验考察碳化液终点浓度与碳化反应温度的关系,一共碳化了13次。由于时间的关系,主要考察了0.2 MPa下碳化时碳化液终点浓度与碳化反应温度的变化情况,同时也适当考察了0.3 MPa下碳化时碳化液终点浓度与碳化反应温度的变化情况 (反应时间均为2 h),具体结果见表4和表5。
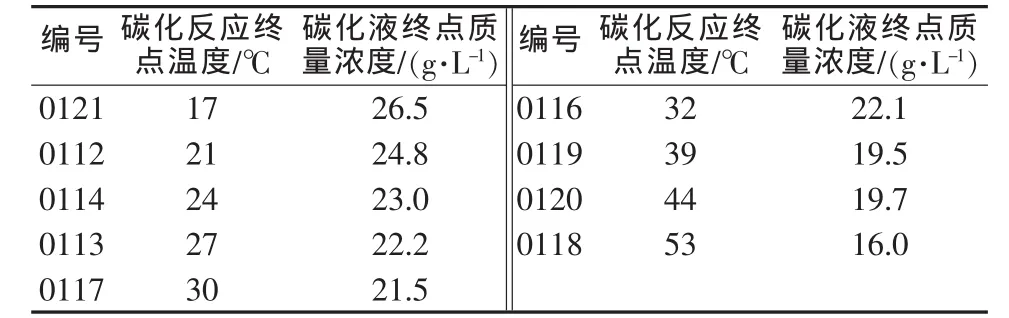
表4 0.2 MPa下碳化液终点浓度与碳化反应温度的关系
从表4和表5可以看出,碳化反应的终点浓度是随着温度升高而下降的。0.2 MPa下,20℃左右时Li2O质量浓度约为25 g/L,30℃左右时Li2O质量浓度约为21.5 g/L,40℃左右时Li2O质量浓度约为19.5 g/L;而在0.3 MPa下,20℃左右时Li2O质量浓度约为26.5 g/L,30℃左右时Li2O质量浓度约为23.5 g/L,40℃左右时Li2O质量浓度约为20.5 g/L。
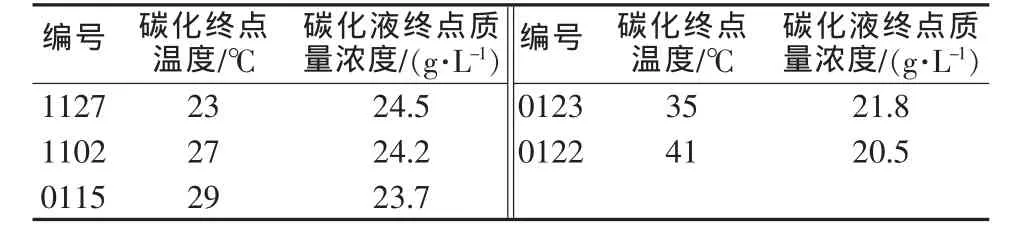
表5 0.3 MPa下碳化液终点浓度与碳化终点温度的关系
从第三阶段试验的结果可以看出,反应温度对碳化液浓度的影响还是比较大的,但只要能够采取措施降低母液的温度并导出反应时产生的热量,碳化反应是能够正常进行的。
1.2.4 二洗矿品位和粒度对碳化反应的影响
经过试验,低品位的矿进反应锅碳化也是可行的。但由于低品位矿中还含有大量的可溶杂质,这些杂质在碳化时大部分进入溶液,一是会影响产品质量,二是造成母液循环次数减少,相应增加锂的损失量。
1.2.5 母液循环使用的影响
以上实验都是在使用母液循环配料的情况下进行的,在循环6次的情况下,对产品质量没有明显影响,再增加循环次数,其对产品质量的影响开始显现。但是能循环6次已经很好了,采用定期外排部分母液的办法可以稳定母液中的杂质含量,从而稳定产品的杂质含量在合格的范围内。
1.2.6 碳化液的稳定性实验
碳化液中碳酸氢锂的稳定性随着温度的升高而降低,并且随着浓度的升高而降低。30℃以下时,稳定性良好;40℃左右则高浓度溶液易分解。两组碳化液稳定性分析结果分别如下:18℃时碳化液Li2O起始质量浓度为20.6 g/L,43℃恒温4 h后的Li2O质量浓度为20.28 g/L,碳酸氢锂分解率为 1.55%;18℃时碳化液Li2O起始质量浓度为27.8 g/L,43℃恒温4 h后的Li2O质量浓度为21.80 g/L,碳酸氢锂分解率为21.58%。
在2007年1月10日—23日期间,补充做了几个碳化液的稳定性实验,实验条件:温度为4个阶梯,分别是 35、40、45、50 ℃,恒温时间都控制在 3 h。实验结果如下:35℃时起始和终点质量浓度都是19.7 g/L,分解率为 0;40℃时起始质量浓度为22.3 g/L,终点质量浓度为 21.8 g/L,分解率为2.24%;45℃时起始质量浓度为22.3 g/L,终点质量浓度为21.4 g/L,分解率为3.14%;50℃时起始质量浓度为21 g/L,终点质量浓度为19.5 g/L,分解率为7.14%。初步实验显示,温度为35℃以下时,Li2O质量浓度约为20 g/L的碳化液是很稳定的;40℃左右时,Li2O质量浓度约为22 g/L的碳化液有少量分解。
1.2.7 碳化反应残渣量和渣含碳酸锂量
在福州的第一阶段试验中,在反应锅中加压碳化时,反应完成后的残渣量和渣含碳酸锂的量见表6。
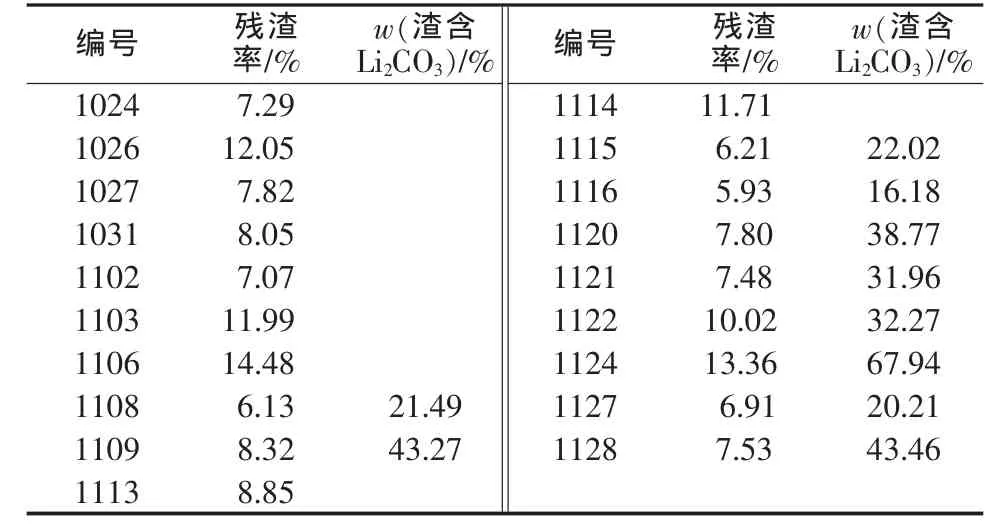
表6 碳化反应残渣量和渣含碳酸锂量
从表6可以看出,残渣率只占投入洗精矿的8.90%,说明碳化完成后要处理的渣量很小。经过一次碳化的渣,虽然量不大,但由于其中碳酸锂含量比较高,所以必须进行进一步的处理,笔者的处理方法是再次碳化或单独苛化均可。
1.3 树脂交换除钙镁和硼
采用特殊的树脂分别交换除去溶液中大部分的钙镁和硼。
经过除钙后的溶液中还含有少量的钙及比较多的镁,钙的质量浓度在0.005 g/L左右,镁的质量浓度在0.2 g/L左右,必须采取措施去除。经过对比实验,最终选择树脂交换的方法除钙镁,所选择的这种树脂是一种带胺基膦酸功能基团的胺基膦酸螯合树脂,这种树脂基本上对所有二价金属离子都有螯合性,尤其对碱土金属有特殊的选择性,能够使钙、镁质量浓度分别降低至0.0005 g/L和0.005 g/L以下。
将经过过滤后的碳化液加入树脂交换柱,让溶液以每小时2倍树脂体积的速度流过树脂交换柱,溶液中的钙镁大部分被树脂交换,从而达到除钙镁的目的。
由于这种碳酸盐型锂精矿含有一定量的硼,并且可以溶于水溶液中,如不除去,可以使产品中的硼质量分数达到0.1%~0.2%,严重影响产品质量。通过对比实验,选择树脂交换的方法除硼,选择的这种树脂是一种由苯乙烯和二乙烯苯交联的大孔结构的螯合树脂,这种树脂中的官能团多价醇基部分与硼之间生成络合阴离子,其胺基部分作为阴离子交换基捕捉生成的络合阴离子,从而选择吸附硼离子。这种树脂不受大量共存盐类的影响;同时反应对pH很敏感,络合离子只有在中性或碱性溶液里才能生成,在酸性溶液里络合离子分解。
在较多其他离子存在的情况下,除硼树脂对硼有较强的选择性交换能力,当溶液中硼的质量浓度为0.025 g/L时,将经过除钙镁后的溶液加入除硼树脂交换柱,让溶液以每小时2倍树脂体积的速度流过树脂交换柱,溶液中的硼大部分被树脂交换。经过交换后能够使溶液中硼的质量浓度降低至0.0025 g/L以下,降幅达到90%。从而使产品中的硼质量分数降到0.02%以下。
1.4 碳化液的热解
碳化液与碳化渣分离后,经过滤进入反应锅进行热解。热解反应在50℃以上开始,60℃以上剧烈反应,达到95℃时反应基本完成,但为了彻底分解完全还要在95℃以上恒温20~30 min。热解进行得很顺利,分解出来的二氧化碳直接排空,没有回收利用。热解出来的产品物理状态很好,始终没有发现结块或结皮,颗粒均匀。
热解时有一部分产品会粘在反应锅的壁上,逐步形成结壁,影响传热速度,使热解所需时间变长。在进行了9次热解后,进行了1次洗结壁。将自来水打入反应锅中(生产中可用母液),水面达到第二层搅拌叶片(目的是充分利用搅拌促进反应进行),充二氧化碳,压力控制在0.1~0.3 MPa(开始时压力比较高,但由于锅盖处有漏气,后来将压力降到0.1 MPa),反应3.5 h后,结壁基本上洗干净了,露出了不锈钢表面,洗结壁的溶液Li2O质量浓度为23 g/L。
在甘肃白银的试验结束后,对热解槽和精制槽进行了检查。热解槽经过11次热解后结壁增厚了3 mm,结壁的碳酸锂为0.066 t,占产出产品质量的1.22%。精制槽经过11次精制后结壁增厚了1 mm,结壁的碳酸锂为0.015 t,占产出产品质量的0.28%。可以看出,结壁情况不是很严重,应该说处于较好状况。
总的来说,碳化液的热解很容易完成,热解时间约为2 h,热解出来的产品颗粒比较均匀,物理外观很好。热解锅内的结壁现象不可避免,但不是特别严重,而且可以通过再次碳化的方法消除结壁。
1.5 产品洗涤和产品质量
热解出来的产品经抽滤去除母液后得到粗品,再经2次搅洗、1次淋洗,烘干后得到最终产品。具体过程是:热解产品先抽滤,按湿产品质量的3倍量取蒸馏水,将水在电炉上烧沸,然后将湿产品加入并搅拌,煮3~5 min,然后抽滤;再按这次湿产品质量的3倍取蒸馏水,将水在电炉上烧沸,然后将洗过一次的湿产品再加进去并搅拌,煮3~5 min,然后抽滤;用与湿产品质量相同的蒸馏水淋洗产品,抽干,然后放入烘箱中在120℃烘干,得到最终产品。
两次搅洗的液固质量比均为3∶1,淋洗的液固质量比为1∶1,洗涤用水均为新水,在生产中可采用逆流洗涤,减少洗涤用水量。
试验得出了7个批次的产品,碳酸锂产品分析结果见表7。

表7 碳酸锂产品分析结果 %
在第二阶段的试验中,产品是经过1次搅洗,然后再经1次淋洗,洗涤液固质量比分别为:搅洗5∶1,淋洗1∶1。共9批产品,9批产品的主成分质量分数和各成分平均质量分数见表8和表9。

表8 甘肃白银碳化试验9批产品的主成分含量 %

表9 甘肃白银碳化试验9批产品各项成分的平均含量 %
从表8看出,产品主成分含量低于电池碳酸锂的国家标准。经过对产品的分析发现,在已经烘干的产品中,还有一定量的碳酸氢锂存在。
用滴定法测定5个样品的碳酸氢锂质量分数,结果分别为:1.699%、1.869%、1.869%、1.811%、1.816%。这与灼烧重量法的结果吻合,验证了碳酸锂产品中有碳酸氢锂残留。
残留的碳酸氢锂在较高温度下可以全部分解,以下是不同温度下恒温2 h后测得的碳酸锂含量:样品 1, 烘 干 温 度 分 别 为 100、 350、400、450、500、550℃时,主成分质量分数分别为98.94%、99.39%、99.53%、99.74%、99.71%、99.70%;样品 2,烘干温度分别为 100、350、400、450、500、550 ℃时, 主成分质量分数分别为 99.01%、99.41%、99.52%、99.70%、99.74%、99.70%。
样品1和样品2在450℃下恒温烘干2 h后的全分析结果见表10。从表10分析结果来看,产品经过450℃烘干后,符合电池级碳酸锂的行业标准YS/T 582—2006《电池级碳酸锂》。

表10 450℃下恒温烘干2 h后的全分析结果 %
1.6 碳化渣的处理
从上面的试验数据可以看出,碳化渣的量虽然不大,但由于还含有较多的碳酸锂,因此必须进行处理。将碳化渣与碳化液分离后再抽干,然后烘干,磨成粉状[w(粒径小于 128 μm 粒子)≈95%],进行了2次二次碳化。
2次二次碳化试验条件相同,具体如下:在碳化塔中加热解母液8 L(Li2O质量浓度为4 g/L),然后加入550 g含碳酸锂质量分数为46.57%的碳化渣,充二氧化碳开始碳化,碳化压力约为0.02 MPa。碳化终点碳化液平均Li2O质量浓度为15.35 g/L,溶出率为81.36%;二次碳化渣平均质量为283 g,二次碳化渣的平均渣率为51.46%,渣含Li2CO3质量分数平均为8.43%。二次碳化后渣含碳酸锂占投入量的9.31%(质量分数)。
按照上面的数据,可以测算出渣量和渣中锂的损失。假设投入1 t碳酸锂品位为90%的洗精矿进行碳化,按照平均残渣率为8.90%、平均渣含Li2CO3质量分数为33.76%计,渣含Li2CO3占投入量的3.33%(质量分数),通过将碳化渣二次碳化后,最终二次碳化渣中的锂损失只占一次碳化时二洗矿锂投入量的0.31%(9.31%×3.33%);最终渣率为二洗矿的 4.58%(8.90%×51.46%)。
2 结论
通过试验发现,采用深度碳化法处理扎布耶锂精矿的工艺可行;碳化时采用加压的方法可以明显将碳化液中氧化锂质量浓度提高至24~26 g/L,有利于减小物料流通量;碳化终点可以用检测碳化液pH的方法确定,也可以用取样分析溶液中氧化锂含量的方法确定;碳化时间为1.5~2.5 h,具体时间要看料浆的细度及二氧化碳与料液混合的好坏而定;碳化压力不宜过高,初步认为是0.2~0.4 MPa为宜,因为碳酸氢锂浓度高则易分解,造成浪费并影响系统的正常运行;碳化液的热解进行得很顺利,热解出来的产品外观很好,没有块状物,不过有一定程度的结壁,但定期用二氧化碳洗结壁则能很好地解决此问题;热解母液可以循环使用约6次(根据原料有所不同),再增加循环次数会因杂质在其中富集而影响产品质量;碳化渣可以用二次碳化的方法处理以回收其中的锂,此方法简单易行,经过二次碳化后的二次渣经沉降、两级逆流洗涤后弃去,渣中锂损失率低于0.5%;最终弃去的渣量很少,渣为弱碱性,基本上没有污染,通过试验数据测算,每吨产品产生的渣不到0.1 t;金属回收率估计可以达到92%左右,其中洗矿母液和热解母液及树脂再生溶液外排损失约5%,机械损失约2.5%,渣中损失约0.5%。
总之,“深度碳化法处理碳酸盐型锂精矿生产电池级碳酸锂”这种工艺方法与现行的苛化法相比有以下几大优点:工艺简单、流程短、物料流通量小、金属回收率高、污染小、成本低等,是目前最有前途的一条工艺路线。此新工艺已经获得国家发明专利(CN, 102502720)。
