丹参总酚酸、山楂总黄酮组分配伍对高脂血症大鼠血脂、超氧化物歧化酶及丙二醛的影响
2014-10-17朱黎霞王利胜张英丰
朱黎霞 王利胜 张英丰
1.南方医科大学珠江医院中医科,广东广州 510282;2.广州中医药大学中药学院,广东广州 510006
随着生活水平的提高和生活方式的转化,高脂血症在临床中呈现多发性、低龄化趋势[1]。丹参和山楂是临床常用的降脂药对[2-4],对高脂血症确有疗效,丹参总酚酸[5-7]、山楂总黄酮[8-9]是降脂的主要物质基础。对中药复方而言,配伍和剂量决定了临床疗效。
中药组分配伍是当前研究的热点。组分配伍从临床出发,遵循传统方剂配伍理论与原则,保持组分配伍的中医特色,针对有限适应证,降低方剂研究的难度[10-11]。本文在丹参、山楂临床用量的基础上,采用基线等比增减设计法重组丹参总酚酸、山楂总黄酮剂量,以高脂血症大鼠为模型动物,探讨不同组分配伍对高脂血症大鼠血脂、超氧化物歧化酶(SOD)及丙二醛(MDA)的影响,为研发出“安全、有效、稳定、可控”的现代中药制剂奠定基础。
1 仪器与试药
1.1 仪器
Anke TDL-40B离心机 (上海安亭科学仪器厂),罗氏P800全自动生化分析仪(瑞士罗氏仪器中心)。
1.2 药物及试剂
丹参总酚酸(自制,采用60%乙醇回流提取法结合大孔树脂精制,经紫外分光光度法测定总酚酸含量61.23%)。山楂总黄酮(自制,采用乙醇回流提取结合大孔树脂纯化,经紫外分光光度法测定总黄酮含量71.25%)。MDA、SOD检测试剂盒(均购自南京建成生物工程研究所)。高脂饲料 (胆固醇4.0%,猪油10.0%,丙基硫氧嘧啶0.2%,胆酸钠0.3%,基础饲料85.5%,委托饲料厂商生产)。阿托伐他汀(商品名立普妥,10 mg/片,美国辉瑞制药公司)。
1.3 实验动物
清洁级 SD 大鼠,雌雄各半,体重(230±10)g,广州中医药大学动物实验中心提供,动物合格证号SCXK2008-0020。
2 方法与结果
2.1 丹参总酚酸和山楂总黄酮组分配伍设计
根据丹参、山楂的临床用量,活性部位转移率结合前期药效初筛,确定丹参-山楂组分总有效剂量为120 mg/kg。在总量恒定的前提下以120 mg/kg为配伍基线,丹参总酚酸以25%递减,山楂总黄酮以25%递增向极点扩展,依次做为组分配伍比例。复制高脂血症大鼠模型,评价不同配伍对高脂血症大鼠血脂的影响。组分配伍见表1。实验前,有效组分均分散于0.5%羧甲基纤维素钠溶液内形成混悬液,灌胃给药。
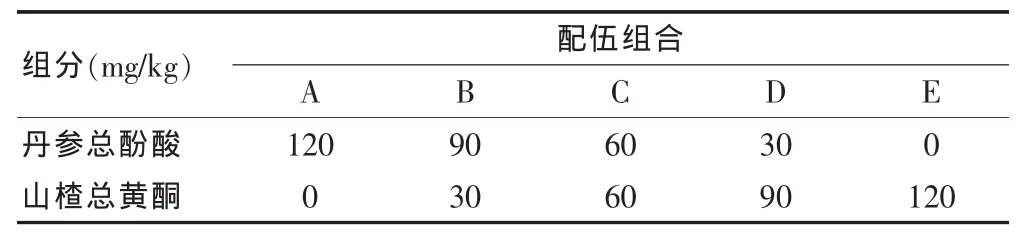
表1 丹参总酚酸、山楂总黄酮组分配伍表
2.2 分组及给药
80只SD大鼠适应性喂养1周后,随机分为8组,每组10只,雌雄各半。整个实验周期内正常组予以普通饲料喂养,丹参、山楂配伍 A、B、C、D、E 组和立普妥(降脂阳性对照组)组均给予高脂饲料(35 g/d)。丹参山楂配伍组分别按表1所设剂量灌胃给药,立普妥组按2.2 mg/kg灌胃给药,正常组和模型组均给予等体积生理盐水。开始给予高脂饲料15 d后各组分别灌胃给药[12-13]。连续给药至第30天,各组大鼠腹主动脉取血,分离血清,检测血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及MDA、SOD活性,并计算动脉粥样硬化指数(TC/HDL-C)。实验过程中,每周称重1次,根据动物体重调整药物剂量。
2.3 统计学方法
采用统计软件SAS 9.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,进行单因素方差分析(ANOVA),组间两两比较采用LSD-t检验;两组间比较采用t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2.4 结果
2.4.1 丹参总酚酸、山楂总黄酮不同配伍比例对高脂血症大鼠血清TC和脂蛋白的影响 采用高脂饲料复制高脂血症大鼠模型,模型组大鼠TC、TG、LDL-C、TC/HDL-C显著升高,具有典型的脂质代谢紊乱状态,和正常组相比,差异有高度统计学意义 (P<0.01)。丹参酚酸和山楂黄酮按不同比例配伍后均可明显降低 TC、TG、LDL-C、TC/HDL-C 水平, 提高HDL-C水平。丹参酚酸、山楂黄酮在配伍比例接近时降脂效果明显优于其他组,说明丹参和山楂具有协同降脂作用。见表2。
表2 丹参总酚酸、山楂总黄酮配伍对高脂血症大鼠血脂的影响(±s,n=10)

表2 丹参总酚酸、山楂总黄酮配伍对高脂血症大鼠血脂的影响(±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;TC/HDL-C:动脉粥样硬化指数
组别 TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L) TC/HDL-C正常组模型组A组B组C组D组E组立普妥组1.45±0.27 5.98±0.53**4.83±0.44#4.46±0.41##3.97±0.23##4.17±0.31##4.96±0.28#2.29±0.46##0.69±0.14 1.27±0.36**0.93±0.12#0.89±0.10##0.75±0.19##0.87±0.27##0.92±0.13#0.74±0.09##0.91±0.11 0.58±0.09**0.64±0.15 0.69±0.19 0.72±0.11#0.83±0.07##0.77±0.09##0.95±0.11##0.91±0.11 0.58±0.09**0.64±0.15 0.69±0.19 0.72±0.11#0.83±0.07##0.77±0.09##0.95±0.11##1.59±0.22 10.31±0.42**7.54±0.59**6.46±0.75**5.51±0.48**5.02±0.27**6.44±0.34**2.41±0.40**
2.4.2 丹参总酚酸、山楂总黄酮不同配伍比例对高脂血症大鼠血清SOD、MDA水平的影响 与正常组相比,高脂模型组SOD活性明显降低(P<0.01),MDA水平显著升高(P<0.01)。丹参、山楂的不同配伍均可升高SOD水平,降低MDA水平,而具有显著的抗氧化活性。在不同配伍组中,山楂黄酮比例越高,抗氧化活性越好。但单用山楂总黄酮或单用丹参总酚酸,效果反而不如配伍组。见表3。
表3 丹参总酚酸、山楂总黄酮配伍对高脂血症大鼠血清SOD、MDA 水平的影响(±s,n=10)
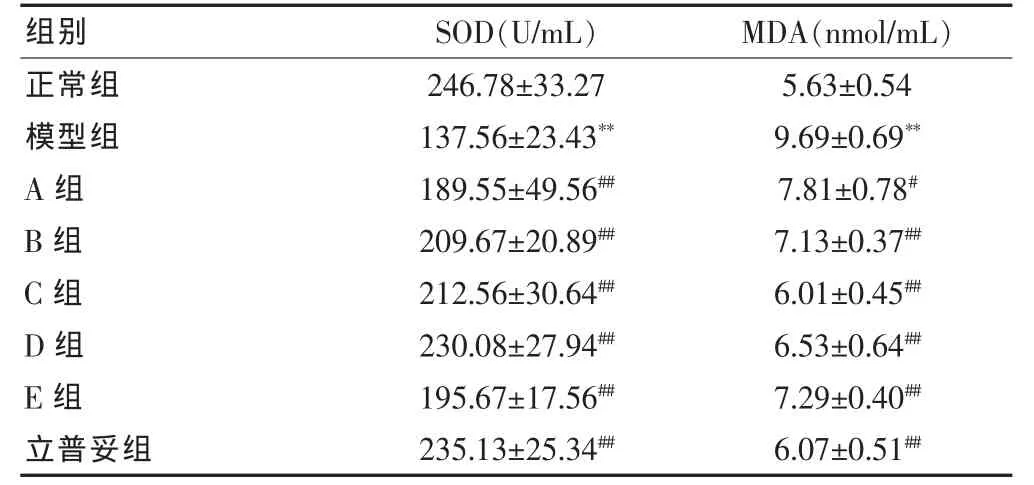
表3 丹参总酚酸、山楂总黄酮配伍对高脂血症大鼠血清SOD、MDA 水平的影响(±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;SOD:超氧化物歧化酶;MDA:丙二醛
组别 SOD(U/mL) MDA(nmol/mL)正常组模型组A组B组C组D组E组立普妥组246.78±33.27 137.56±23.43**189.55±49.56##209.67±20.89##212.56±30.64##230.08±27.94##195.67±17.56##235.13±25.34##5.63±0.54 9.69±0.69**7.81±0.78#7.13±0.37##6.01±0.45##6.53±0.64##7.29±0.40##6.07±0.51##
3 讨论
中药复方既有药味数目的不同,又有剂量的变化,更内含比例的差异,功能主治、作用范围、适应病证、疗效机制等随配伍变化而变化,构成“彼此协同、相互制约”的有机体。在病证结合、理法方药一致的条件下,通过成分群介导的多靶点、多环节、多途径的整合调节作用而发挥整体效应。
中药复方配伍后会产生物理、化学、生物等多方面变化。成分群数、量、比例的相对变化是配伍的物质基础,色泽、气味等物理状态是配伍的外在表现,药理效应、毒副作用、临床适应证、功能主治是配伍的终极目标,成分群体内吸收、分布、代谢、排泄等环节是配伍与药效的必要路径。配伍是“因”,药效是“果”,因果之间的内在联系可借助于配伍产生的物理、化学、生物变量,采用信息学手段予以阐明。
实验设计、数理统计学在配伍机制研究中起重要作用。方剂配伍的实验设计多是从配伍前后的药理效应或化学成分变化作为评价指标,利用数学统计方法探讨方剂配伍模式(如正交设计、均匀设计、聚类分析、主成分分析、多目标优化的ED/NM/MO三联法[14])。如谭晓梅等[15]和贺丰等[16]用正交设计法系统研究了配伍对葛根芩连汤中系列成分含量及人体内过程的影响等。钟志勇等[17]用多指标正交设计合并线性回归法探讨芍药甘草汤的最佳配伍。
本文采用基线等比增减设计法探讨了丹参酚酸和山楂黄酮对高脂血症大鼠模型血脂及SOD、MDA水平的影响。相比正交设计和均匀设计,等比增减设计非常适合药效物质基础相对明确、药味相对较少的小复方(或君药、臣药),根据研究目的以两药主要效应和次要效应为评价指标,通过综合信息分析,进行各配伍的优化筛选[18-19]。
丹参酚酸和山楂黄酮均是已知的较强的中药抗氧化活性部位[20-21]。丹酚酸对超氧阴离子、羟自由基有很强的清除作用和抗脂质过氧化作用。山楂黄酮具有提高抗氧化能力、减轻自由基损伤、促进体内氧化-抗氧化系统平衡恢复等作用[22]。研究发现,单用丹参酚酸和单用山楂黄酮其降脂、抗氧化活性均不如配伍组,且丹参酚酸和山楂黄酮剂量接近时降脂、抗氧化效果最好,具有类似的趋势,协同增效作用明显,C、D组降脂、抗氧化活性明显优于其他组,具体机制尚有待深入研究。
[1]郭姣,朴胜华.从高脂血症发病低龄化趋势探讨其中医发病机制[J].中医药信息,2008,25(6):4-6.
[2]张永丽.丹参山楂降脂丸治疗高脂血症的临床疗效观察[J].中国医药导报,2009,6(19):57-58.
[3]王伟,杨滨,王岚,等.丹参山楂药对对大鼠动脉粥样硬化的影响[J].中国中药杂志,2011,36(6):784-789.
[4]张建永.丹参山楂组分配伍抗动脉粥样硬化及作用机制研究[D].北京:中国中医科学院,2013.
[5]张益嘉,吴铁,崔燎.丹参水溶性有效部位群与丹酚酸B对去卵巢大鼠血脂的调节作用[J].辽宁中医药大学学报,2008,10(7):146-148.
[6]陈昕琳,顾仁樾,章怡祎.丹参多酚酸B对动脉粥样硬化大鼠炎症细胞因子的影响[J].上海中医药大学学报,2011,25(1):63-67.
[7]丹参多酚酸盐对兔动脉粥样硬化斑块稳定作用的研究[D].苏州:苏州大学,2008.
[8]罗先钦,黄崇刚,伍小波.山楂总黄酮对复合因素致大鼠脂肪肝模型脂质代谢与低密度脂蛋白受体表达的影响[J].中草药,2011,42(7):1367-1373.
[9]叶希韵,徐敏华,李晓峰,等.山楂叶总黄酮降血脂防治鹌鹑脂肪肝形成的实验研究[J].复旦学报:医学版,2009,36(2):142-148.
[10]张伯礼,王永炎.方剂关键科学问题的基础研究—以组分配伍研制现代中药[J].中国天然药物,2005,3(5):258-261.
[11]王阶,郭丽丽,王永炎.中药方剂有效成(组)分配伍研究[J].中国中药杂志,2006,31(1):5-9.
[12]徐云凤,赵雨,幺宝金,等.人参蛋白对高脂血症模型大鼠的降血脂作用[J].中药新药与临床药理,2011,22(2):138-141.
[13]刘卫红,张琪,张蕾,等.三仁汤对大鼠高脂血症模型血脂及代谢产物谱的影响[J].中国中西医结合杂志,2011,31(1):52-57.
[14]王睿.实现复方剂量配伍优化的ED-NM-MO三联法[D].北京:北京中医药大学,2004.
[15]谭晓梅,戴开金,罗佳波,等.葛根芩连汤不同配伍对黄芩苷含量的影响[J].中草药,2003,34(7):598-600.
[16]贺丰,罗佳波.麻黄汤中臣佐使药对君药中伪麻黄碱的人体药代学的影响[J].中国中药杂志,2005,30(18):1454-1457.
[17]钟志勇,龚奥娣,韩坚,等.用多指标正交设计合并线性回归法探讨芍药甘草汤的最佳配伍[J].中药药理与临床,2005,21(6):7-10.
[18]唐志书,郭立玮,王斌.基线等比增减设计法优选PNS/TGCO组分对实验性气虚血瘀型冠心病的影响研究[J].中药材,2010,33(9):1439-1442.
[19]商洪才,张伯礼,王永炎,等.一种适用于中药小复方配伍优选设计方法的建立[J].中国实验方剂学杂志,2003,9(3):1-3.
[20]杜冠华.丹酚酸药理作用及作用机制[D].北京:中国协和医科大学,1995.
[21]杨宇杰,陈建双,王春民.山楂叶总黄酮对高脂血症大鼠血清SOD、MDA及PON1的影响[J].中国医院药学杂志,2010,30(3):196-198.
[22]高天曙,王宏贤.山楂叶黄酮类化合物对小鼠血清及肝组织 SOD、MDA 水平的影响[J].中医研究,2012,25(4):67-68.
