hMDHⅡ过表达抑制过氧化氢压力下的CHO细胞凋亡
2014-10-15张存超张学光
靖 钰,张存超,付 托,蒋 成,张学光,寇 庚
(1.苏州大学 医学生物技术研究所,江苏 苏州215007;2.第二军医大学 肿瘤研究所,上海200433)
中国仓鼠卵巢细胞(CHO)是表达单克隆抗体最常用的工程细胞,凋亡是CHO细胞培养过程中细胞死亡的主要方式,限制了细胞密度和蛋白表达量的提高。细胞凋亡又称细胞的程序性死亡,是细胞在多种因素诱导下的自杀行为,其途径分为外在途径、线粒体途径和内质网途径[1]。其中线粒体途径由应激条件、化学治疗试剂和药物所启动。
活性氧(ROS)是一类氧衍生的自由基的总称,通常包括氧离子、过氧化物和自由基等,可通过线粒体途径诱导细胞凋亡[2],是细胞凋亡的重要诱导因素。因此,通过降低活性氧可以减少细胞凋亡,如TIGAR过表达可降低细胞内活性氧水平[3],进而减少凋亡。
人苹果酸脱氢酶Ⅱ(human malate dehydrogenaseⅡ,hMDHⅡ)位于线粒体内,是TCA循环中的一种酶,可以将苹果酸转化为草酰乙酸。研究显示,在CHO细胞中过表达hMDHⅡ能提高细胞内ATP和NADH水平,并增大活细胞密度[4],但缺乏此基因过表达对细胞凋亡影响的研究。
作者以CHO-K1细胞为研究对象,考察hMDHⅡ过表达对活性氧诱导CHO细胞凋亡的影响,拟为理解活性氧诱导的细胞凋亡提供理论支持,为抗凋亡细胞株构建提供新的途径。
1 实验
1.1 材料、试剂与仪器
CHO-K1细胞、E.coli TG1,自行保存。
限制性内切酶(Takara Code:DRR037A),Takara公司;DNA片段小量胶回收试剂盒(W5001)、质粒小量抽提试剂盒(W5211),上海生工生物技术公司;RNA提取试剂(No.740955.50),Macherey-Nagel公司;DNA marker,天根生化科技北京有限公司;淋巴细胞分离液,上海华精生物高科技有限公司;PCR、反转录试剂及DNA连接试剂盒,Promega公司;转染试剂盒lipofectamine 2000,Invitrogen公司;G418试剂,Roche公司;JC-1线粒体膜电位检测试剂盒,碧云天生物技术研究所;DCFH-DA试剂,Sigma公司。
ABI 7500型 Real-time PCR 仪,Applied Biosystems公司;BD FACSCALIBUR型流式细胞仪,BD Bioscience公司。
1.2 方法
1.2.1 hMDHⅡ基因克隆及表达载体构建
hMDHⅡ的编码序列(NM_005918.2)长度为1 017 bp。为此序列设计并合成PCR引物(上海生工生物技术 公 司),F:CCCAAGCTTGCCACCATGCTCTCCGCCCTCGCCCG,R:CGGAATTCTCACTTCAGGGGTCTTCACGAA。分别在此引物对中添加HinDⅢ和EcoRⅠ酶切位点。
从人血液淋巴细胞中提取mRNA并反转录获得cDNA,以此作为PCR模板,进行PCR扩增(退火温度为50℃,30s,35个循环),PCR产物长度为1 045bp。将PCR产物用1.5%琼脂糖凝胶进行分离并鉴定,判定并切割目的条带进行胶回收,用于后续与克隆载体连接。
以pGEM-T作为克隆载体,将胶回收产物与其连接,通过转化、涂布平板、挑取克隆、测序等步骤获得含有正确hMDHⅡ序列(用于后续表达载体构建)的克隆载体。以pcDNA3.0作为表达载体,经HinD Ⅲ和EcoRⅠ酶切后与同样经相同酶酶切后的hMDHⅡ序列连接,经过与上述克隆载体构建相同的步骤获得表达载体,测序确认其序列。
1.2.2 转染与筛选及荧光定量PCR鉴定[5]
用含有hMDHⅡ的pcDNA3.0表达载体转染CHO-K1细胞,转染使用lipofectamine 2000试剂,以800μg·mL-1G418作为筛选压力,获得G418抗性细胞。用有限稀释法筛选这些抗性细胞获得单克隆,并用 Real-time PCR法鉴定所获得的克隆。以β-actin基因作内参,其PCR引物参照文献[6]。hMDHⅡ进行荧光定量PCR的引物为:F:AGAAAGCCAGGCATGACCCG,R:TGTGATGGGGATGGTGGAATTA。PCR采用两步法,退火/延伸温度为60℃,35s,40个循环。
1.2.3 细胞培养
直接更换经鉴定的hMDHⅡ阳性克隆的培养基为CHOM-B01+4mmol·L-1Gln,待细胞悬浮后,转移至100mL摇瓶培养,初始接种密度为5×105个·mL-1,装液量为30mL,细胞每3d传代1次。
补料分批培养时,基础培养基为CHOM-B01+4 mmol·L-1Gln,并添加自主开发的流加培养基。初始接种密度为5×105个·mL-1,装液量为30mL。
1.2.4 细胞凋亡检测
使用JC-1检测线粒体膜电位,线粒体膜电位的缺失可用于指示细胞凋亡:线粒体膜电位较高时,JC-1在线粒体的基质中以聚合物形式存在,此时产生红色荧光;而线粒体膜电位较低时,JC-1因不能在线粒体中聚集而以单体形式存在,此时产生绿色荧光。具体操作如下[7]:取1×105~6×105个细胞,重悬于0.5 mL无血清培养基中,加入 0.5mL JC-1(5mg·mL-1)染色工作液,颠倒数次混匀,在细胞培养箱中37℃孵育20min后,4℃、600g离心3~4min,沉淀细胞。弃上清,细胞用PBS缓冲溶液洗涤2次。用500μL PBS缓冲溶液重悬后,用流式细胞仪检测,用488nm光激发并在530nm和575nm波长处收集信号,以荧光强度比(绿光/红光)表征线粒体膜的去极化情况。
对于大多数细胞,通常10μmol·L-1羰基氰化氯苯 腙 (carbonyl cyanide 3-chlorophenylhydrazone,CCCP)处理20min后线粒体的膜电位会完全丧失,经JC-1染色后观察应呈绿色荧光;而正常的细胞经JC-1染色后应显示红色荧光。因此,两者分别用作阳性对照和阴性对照。
1.2.5 活性氧检测
取1×106个细胞离心后用1mL新鲜无血清培养基重悬,置于24孔板中,加入10μL 10μmol·L-1DCFH-DA试剂。置于培养箱中37℃避光孵育30 min,期间每隔3~5min轻轻摇晃24孔板,使得细胞与DCFH-DA探针充分结合。取上述1mL细胞液以1 000r· min-1离心5min,弃上清并用预冷PBS缓冲溶液洗涤,最终重悬于500μL PBS缓冲溶液中。用流式细胞仪在激发光488nm、发射光525nm处检测。
2 结果与讨论
2.1 hMDHⅡ基因克隆及表达载体的构建
以人淋巴细胞cDNA为模板,使用hMDHⅡ基因克隆引物进行PCR扩增,产物的凝胶电泳鉴定如图1所示。
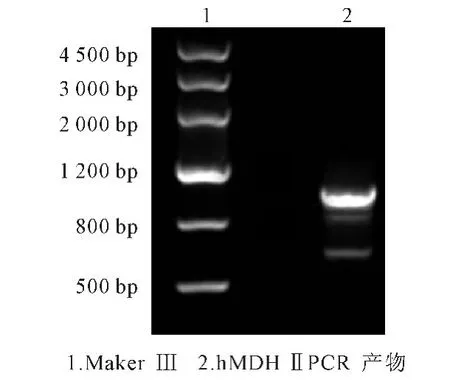
图1 hMDHⅡ基因PCR产物电泳鉴定Fig.1 Electrophoresis identification of hMDHⅡgene PCR product
从图1可见,在约1 000bp位置有一条明亮的条带,将此条带胶回收后与pGEM-T载体连接并转化至E.coli TG1感受态细胞,随后挑选5个克隆用于测序,依次编号为1#~5#。测序结果表明,5#克隆中hMDHⅡ序列与目的序列一致。将hMDHⅡ-pGEMT 5#质粒,按1.2.1方法制备成表达载体,命名为hMDHⅡ-pcDNA3.0,此载体序列经DNA测序确认无误。
2.2 hMDHⅡ的mRNA水平鉴定
将hMDHⅡ-pcDNA3.0和pcDNA3.0载体分别转染CHO-K1细胞,用有限稀释法筛选获得6株具有G418抗性的稳定单克隆,依次编号为1#~6#。分别从这些克隆中提取总RNA并反转录获得cDNA,以此为模板用荧光定量PCR法鉴定hMDHⅡ的表达。结果显示,编号为2#、3#和6#的克隆均表达hMDHⅡ,并且6#克隆hMDHⅡ表达量最高(图2)。取hMDHⅡ表达量最高的6#克隆用于后续实验。
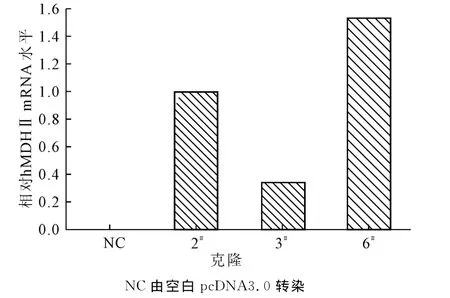
图2 Real-time PCR鉴定hMDHⅡ基因表达Fig.2 Relative hMDHⅡ mRNA quantity determined by Real-time PCR
2.3 hMDHⅡ过表达抑制活性氧压力下的CHO细胞凋亡
以6#克隆为研究对象,考察hMDHⅡ过表达对CHO细胞活率的影响,同时,为考察活性氧对细胞的影响,在补料分批培养第5d向细胞培养物中添加过氧化氢以模拟活性氧条件,结果见图3。
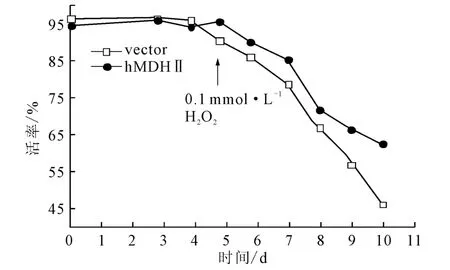
图3 hMDHⅡ过表达对过氧化氢压力下的CHO细胞活率的影响Fig.3 Effect of over-expression of hMDHⅡon survival rate of CHO cell under the condition of hydrogen peroxide treatment
从图3可见,添加0.1mmol·L-1过氧化氢之后,CHO细胞的活率逐渐下降;在补料分批培养第9d、10 d,hMDHⅡ6#细胞的活率显著高于对照组,尤其是第10d时两者差异更为显著。
凋亡是细胞培养后期细胞死亡的主要方式,推测补料分批培养第10d细胞活率的差异可能是凋亡引起的。将补料分批培养第10d的细胞用于线粒体膜电位检测,结果见图4。
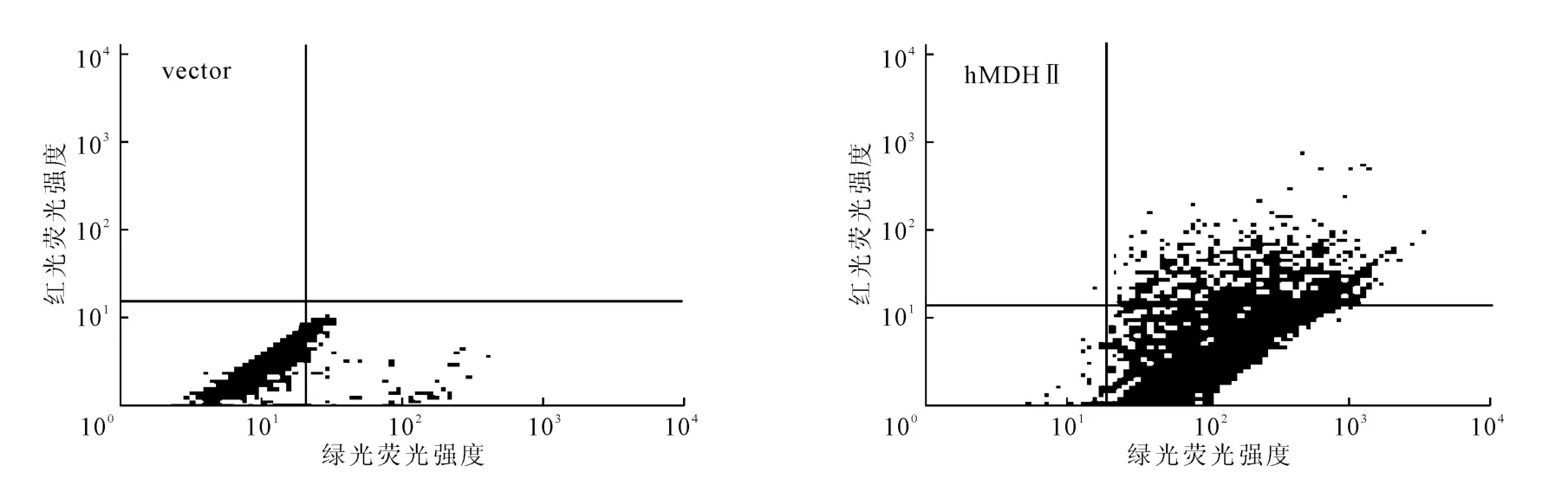
图4 hMDHⅡ过表达提高线粒体膜电位Fig.4 Over-expression of hMDHⅡincreases mitochondrial membrane potential
从图4可见,表达hMDHⅡ的细胞的绿色荧光强度与对照组相比提高了约10倍;对照组无明显红色荧光,而表达hMDHⅡ的细胞可见少量红色荧光。表明大部分细胞线粒体处于低能量状态,而且表达hMDHⅡ细胞的线粒体膜电位高于对照组,证实hMDHⅡ过表达提高了线粒体膜电位,抑制了细胞凋亡。
2.4 hMDHⅡ过表达降低活性氧
测定补料分批培养第10dCHO细胞内的活性氧,如图5所示。图中M1为荧光强度低的细胞,即活性氧水平低的细胞,M2为荧光强度高的细胞,即活性氧水平高的细胞。
从图5可见,hMDHⅡ过表达后,M1数量明显增加、M2数量大幅减少,总体荧光强度显著降低,说明细胞内活性氧减少,其平均活性氧水平是对照组的1/10左右。可见,在CHO细胞内过表达hMDHⅡ能够显著减少细胞内的活性氧。
3 结论
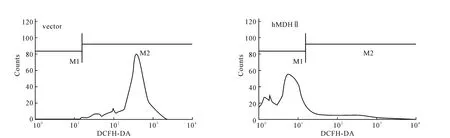
图5 hMDHⅡ过表达降低活性氧Fig.5 Over-expression of hMDHⅡ decreases ROS
成功构建了过表达人苹果酸脱氢酶Ⅱ(hMDHⅡ)的重组CHO细胞,并考察了hMDHⅡ过表达对过氧化氢压力下CHO细胞凋亡的影响。结果表明,hMDHⅡ过表达提高了过氧化氢压力下的CHO细胞活率。进一步的检测发现hMDHⅡ过表达可能通过减少活性氧的产生从而抑制细胞凋亡。
[1]TAYLOR R C,CULLEN S P,MARTIN S J.Apoptosis:Controlled demolition at the cellular level[J].Nat Rev Mol Cell Biol,2008,9(3):231-241.
[2]CIRCU M L,AW T Y.Reactive oxygen species,cellular redox systems,and apoptosis[J].Free Radic Biol Med,2010,48(6):749-762.
[3]BENSAAD K,TSURUTA A,SELAK M A,et al.TIGAR,ap53-inducible regulator of glycolysis and apoptosis[J].Cell,2006,126(1):107-120.
[4]CHONG P K W,REDDYA G S,YUSUFIA N K F,et al.Metabolomics-driven approach for the improvement of Chinese hamster ovary cell growth:Overexpression of malate dehydrogenaseⅡ[J].J Biotechnol,2010,147(2):116-121.
[5]付托,张存超,靖钰,等.人丙酮酸羧化酶异位表达提高中国仓鼠卵巢细胞补料分批培养后期活率[J].化学与生物工程,2013,30(6):39-42.
[6]CHUSAINOW J,YANG Y S,YEO J H,et al.A study of monoclonal antibody-producing CHO cell lines:What makes a stable high producer[J].Biotechnol Bioeng,2009,102(4):1182-1196.
[7]LI Y,LI Q,WANG Z,et al.15-HETE Suppresses K+channel activity and inhibits apoptosis in pulmonary artery smooth muscle cells[J].Apoptosis,2009,14(1):42-51.
