国产可调节输出功率的双极射频消融装置的离体动物实验
2014-09-15汤敏尹航姜兆磊梅举
汤敏 尹航 姜兆磊 梅举
基础研究
国产可调节输出功率的双极射频消融装置的离体动物实验
汤敏 尹航 姜兆磊 梅举
目的 研究不同输出功率下,双极射频消融装置对不同厚度离体心房组织消融至透壁所需的时间及使用阻抗指标评价透壁性时的病理学检验,从而确定国产消融装置的合理输出功率。方法 20头猪屠宰后马上获取猪心,立即浸入4℃的生理盐水溶液中,清洗后制备离体心房组织。使用自行研制的输出功率可调式双极射频消融装置及消融钳,分别使用25 W、30 W及35 W的输出功率对离体心房组织进行消融。消融线间隔约5 mm,彼此间平行。消融透壁的指标是消融时该处同时测定的电阻抗大于100 Ω。依次使用相同的输出功率,记录对不同厚度心房组织完成消融所需时间。消融完成后,沿两条消融线中点依次剪开心房组织,肉眼检查消融效果,测量消融线处组织厚度。按消融组织厚度,将心房组织分成<2 mm、2~4 mm(≥2 mm,<4 mm)、4~6 mm(≥4 mm,<6 mm)及≥6 mm 4组。对应于不同输出功率和厚度,将心房组织分为12个区组。分别随机挑选每个区组的心房组织10块,将心房组织浸入多聚甲醛溶液,固定后心房组织使用石蜡切片,Mason三色法染色,显微镜下检验是否透壁。结果 实验共有350条消融线到达透壁指标。4~6 mm及>6 mm 组的心房组织消融完成时间明显长于<2 mm 组心房组织 [(12.4±0.9)s比 (24.3±0.3)s,P=0.042;(12.4±0.9)s比(35.9±0.3)s,P=0.001]。 消融完成时间在输出功率 25 W 与 35 W 间有显著差异[(28.9±0.5)s比(16.9±0.5)s,P=0.010]。心房组织厚度与消融完成时间呈正相关。单次消融到达消融透壁指标时的病理透壁率为0~60%,随心房厚度增厚而降低,随输出功率增加而升高。结论 心房组织的消融完成时间随射频输出功率增加而缩短,并与心房组织厚度呈正相关。单次射频消融的透壁率较低。综合考虑消融所需时间、透壁率及安全性,输出功率在30~35 W是国产消融仪较为合理的射频输出功率。
双极射频消融;组织厚度;输出功率;消融完成时间;透壁率
心房颤动(atrial fibrillation,AF)是最常见的心律失常,其发病率随年龄的增加而上升,80岁以上人群的患病率超过10%[1,2]。我国流行病学研究显示,房颤的整体人群发病率为0.65%~0.77%[3,4],台湾地区发病率约1.1%[5]。随中国社会老龄化逐步加重,房颤的患病率将有显著上升。房颤导致的脑血管意外、心力衰竭等并发症是房颤致死、致残的主要原因[6,7]。
迷宫手术是迄今最有效治疗房颤的外科手术[8],但手术复杂,术后出血等并发症较多。使用射频等新型能源行微创消融手术以代替迷宫手术中的“切与缝”,能明显缩短手术时间,降低术后并发症发生率[9-11]。近年来,双极射频消融钳由于能监测被消融心房组织的电导参数,消融透壁率高,术后房颤治愈率高于射频消融笔[12,13]。因此,双极射频消融钳是外科治疗房颤的标准方法。
尽管越来越多的患者接受外科手术治疗心房颤动,且随外科医生手术技术的提高,房颤的治愈率也逐步上升。但国内鲜有对射频消融的生物学效应、组织学变化进行研究的报道,几乎所有临床消融的仪器均为进口。开展对射频消融仪器的研究不但对研制国产消融仪意义重大,也对外科医生加深对射频生物学效应的认识有益,以利提高临床房颤治愈率。
本研究拟使用自行研制的输出功率可调的双极射频消融装置,对不同厚度的心房组织进行消融,研究消融完成所需时间。通过对消融后心房组织病理检查,评价电阻抗作为透壁性指标的可靠性,从而确定国产双极射频装置的合理消融输出功率。
1 材料与方法
1.1 离体组织的获取 20头猪屠宰后立即获取猪心,将猪心浸入4℃生理盐水中清洗2次。先将左、右心房组织沿左、右房室瓣瓣环剪下,再沿房间隔的左侧或右侧缘将左、右心房分别取下。修剪去除左心房后壁及右心房腔静脉窦部,将左右心房修剪成由心耳至房室瓣环的类似锥形的组织备用。
1.2 双极射频消融装置及消融方法 双极射频消融控制装置及消融钳均为自行研制。消融仪输出功率为10~60 W,可以在射频消融同时测定组织阻抗。消融前,可设置射频消融时间或到达一定阻抗后自动停止消融。
将双极射频消融钳由心耳开始,沿垂直于心耳至房室瓣环连线的方向,依次做消融线。消融线间隔约5 mm,彼此间平行。同一心房组织使用同一输出功率,消融前设定阻抗到达100 Ω时停止消融,记录到达该阻抗所需的消融时间。输出功率最低采用20 W,依次提高5 W,直至40 W。不同的输出功率依次在不同的心房组织中使用。记录每条消融线的输出功率、消融完成时间及按如下方法测定的消融组织厚度。
1.3 消融效果的评价 沿两条相邻的消融线中点将心房组织剪成以消融线为中心的心房组织条后,做以下评价。
1.3.1 肉眼检查及消融组织厚度测量 检查是否在心内膜及外膜面形成白色的消融线,是否有心房组织破裂。选取消融线中点位置,取长约1 cm的左房组织准备用于病理检查。使用游标卡尺测量该处心房组织两端的组织厚度,取其平均值为消融组织厚度。
1.3.2 随机方法 按消融组织厚度将准备用于病理检查的组织分为<2 mm、2~4 mm(≥2 mm,<4 mm)、4~6 mm(≥4 mm,<6 mm)和≥6 mm 4组。根据消融时使用的输出功率,将各组再细分为3个区组:25 W、30 W和35 W。以此产生12个区组,分别对应不同组织厚度和消融输出功率的组合。
将每区组中的心房组织连续编号,使用excel软件中的RAND函数,随机产生小于最大编号数值的随机整数。该随机数对应编号的心房组织用于病理学检查。该心房组织去除后的其他心房组织重新编号并产生第2块用于病理检查的心房组织。依此类推,直到每区组随机产生10块心房组织被用于病理学检查。如区组中心房组织≤10块,则将所有组织送病理检查。
1.3.3 病理检查 将随机选出用于病理检查的心房组织浸入多聚甲醛溶液中过夜,将组织块使用石蜡包埋,沿垂直于消融线方向行组织切片,每个组织块在消融线不同位置切5张切片,行Mason三色法染色。在显微镜下检查,如消融部位组织显示均一的蓝色,表明组织发生射频消融导致的凝固性坏死,病理检查结果为透壁;如组织切片中有存活的心肌细胞显示红色,则判定为不透壁。
1.4 统计学方法 统计学检验使用软件SPSS 18.0。所有区组消融所需时间表达为±s,不同组织厚度或消融输出功率的主效应表达为总体均数±样本均数标准误,消融透壁率表达为百分数。使用单向方差分析比较各区组间消融完成时间有无显著性差异,使用双向方差分析,检验不同组织厚度或不同射频输出能量时,消融完成时间有无显著性差异,并使用Scheffe检验两组间比较。使用线性回归法检验组织厚度与消融完成时间之间有无相关性。P<0.05为差异有统计学意义。
2 结果
2.1 各区组消融样本数量分布 实验共完成350条消融线,消融线对应于不同组织厚度和射频输出功率区组(表1)。心房组织厚度以2~4 mm最多见,≥6 mm的最少。

表1 不同区组样本量分布(例)
2.2 不同区组消融完成时间 当射频输出功率为20 W时,12条厚度≥6 mm的左心房组织中有10条组织的消融完成时间>60 s。当输出功率为40 W时,18条<2 mm的心房组织中有3条出现消融后心房组织穿孔。其他输出功率时未发生上述情况,因此,排除20 W及40 W作为后续实验射频输出功率。表2列出射频能量为25 W、30 W和35 W时不同厚度心房组织对应的消融完成时间。
表2 不同区组单次射频消融完成时间(±s,s)

表2 不同区组单次射频消融完成时间(±s,s)
射频输出功率(W)心房组织厚度(mm) 总体效应<2 2~4 4~6 ≥6 25 15.6±3.0 20.3±2.6 34.5±2.4 45.3±1.7 28.9±0.5 30 12.5±1.7 18.2±2.5 21.3±1.7 35.0±1.8 21.8±0.4 35 9.0±1.4 13.8±1.2 17.1±2.1 27.5±2.3 16.9±0.5总体效应 12.4±0.9 17.4±0.8 24.3±0.3 35.9±0.3
2.3 心房厚度及射频输出功率对消融完成时间的主效应 不同组织厚度对消融完成时间的主效应如图1所示,消融完成时间随厚度增加而延长。双向方差分析显示组间差异显著(P=0.001)。组间检验显示,心房组织厚度在<2 mm、2~4 mm两组间差异无统计学意义。<2 mm组与4~6 mm组间的消融完成时间差异有统计学意义[(12.4±0.9)s比(24.3±0.3)s,P=0.042]。≥6 mm 组的消融完成时间显著长于上述三组[(12.4±0.9)s比(35.9±0.3)s,P=0.001;(17.4±0.8)s比(35.9±0.3)s,P=0.005;(24.3±0.3)s比(35.9±0.3)s,P=0.042]。
不同射频输出能量对消融完成时间的主效应如图2所示,消融完成时间随射频输出能量增加而缩短。方差分析组间差异明显(P=0.009)。组间检验显示,25 W组与35 W组间消融完成时间比较差异有统计学意义[(28.9±0.5)s比(16.9±0.5)s,P=0.010],25 W与30 W、30 W 与 35 W 间差异无统计学意义。
图3显示心房组织厚度与消融完成时间呈正相关(r2=0.471,P=0.001),且各射频输出功率均有此相关关系(25 W:r2=0.921,P=0.001;30 W:r2=0.879,P=0.008;35 W:r2=0.882,P=0.006)。
2.4 单次心房组织消融透壁率 表3归纳了不同区组的病理检查结果,单次消融的透壁率较低,组织厚度增加时,透壁率下降。射频输出能量提高时,透壁率随之提高。图4a显示经Mason三色染色法染色确认消融透壁图像,经Mason染色后,消融线对应部位的心肌呈蓝色,消融线外心肌存活,仍显示红色(×40倍)。图4b显示为不透壁图像,射频消融后,相当于消融线的一侧心肌为蓝色,中间及另一侧心肌显示红色,证明不透壁(×40倍)。

表3 心房组织单次消融的透壁率(%)
3 讨论
迷宫手术仍是目前治疗心房颤动的金标准。通过外科切与缝产生的组织瘢痕能保证电隔离的效果。同样,使用射频消融方法模仿迷宫手术切口所做的消融线是否透壁是决定房颤治疗效果的关键。射频消融线的完成取决于最基本的三个要素:输出功率、消融时间、组织厚度。输出功率决定消融温度,是使组织发生脱水、凝固性坏死的能量来源。本实验中,20 W输出时,大部分>6 mm的组织消融缓慢,无法完成消融;而40 W输出时,<2 mm的组织出现了组织穿孔。因此,20 W和40 W均不适合作为治疗房颤的消融输出。25~35 W行消融时,随输出功率增大,消融时间缩短,病理透壁率上升。从安全性和病理透壁率综合考虑,30 W和35 W是双极射频消融的合理能量。但这一消融能量不能简单转移至消融笔。使用消融笔时,特别是心外膜消融时,心房内流动的血液可能带走部分射频产生的热量[14,15]。其次,射频消融笔产生的心房组织温度分布不如双极消融钳均匀。过高的温度不但可能造成心房组织破坏,还容易造成临近组织损伤,如食管等[16]。这一能量输出也不能简单移植至其他设备。由于设备设计不同,输出功率的计算方式不相同,因此,对不同设计的射频输出装置,其输出功率无法完全横向比较。设计时,由于最后输出端为消融钳的电极,还需要考虑消融钳电极材料和电阻等因素,才能确定最后产生生物学效应的能量。
实验中,大多数猪心房组织厚度为1.5~4.0 mm,与人类相似。在外科手术中,双极消融钳经常需要钳夹双层心房组织,且在行某些消融线时,如在行下肺静脉间消融线至二尖瓣环连线、房间隔消融线时,钳夹的心房组织厚度可能>4 mm,甚至>6 mm。本实验中,>4 mm的组织消融时间明显长于>2 mm组织,>6 mm组织的消融时间均长于其他组织厚度组,且组织厚度与消融时间呈线性正相关。从透壁率看,>6 mm组单次消融的透壁率非常低。因此,在这些部位行消融时,发生消融不透壁或消融漏点的情况较多,也是术后房颤复发或发生房扑的原因[17,18]。多次消融可能是解决较厚心房组织消融的方法之一。即使是经过多次消融,仍有可能出现消融“漏点”的情况。Pison等[19]进行的杂交治疗,证实经外科微创射频消融后的“漏点”率仍有23%。杂交治疗可能是进一步提高窦性恢复率的新手段之一。
除了射频消融输出能量和组织厚度外,消融时间也是影响透壁率的重要因素之一。与消融笔不同,双极消融钳可以在消融同时测定钳夹组织的阻抗。阻抗升高作为透壁的信号,提示手术医生消融完成。虽然早期研究表明阻抗上升与病理透壁率上升是同步的,但无论是临床报道还是动物实验研究均显示阻抗升高不是完全可靠的透壁提示指标[20,21]。虽然延长消融时间可以提高透壁率,但消融过度导致的组织损坏、出血等并发症有时是致命的。目前,国内外的研究均证实,使用双极射频消融钳的单次病理透壁率仅为30%~50%[22,23]。因此临床上不建议使用阻抗上升作为消融完成的单一指标,应该在同一部位行多次消融以提高病理透壁率。使用我们研制的射频消融仪进行多次消融后的病理透壁率值得进一步研究。
除上述因素外,仍有许多技术细节影响消融组织的病理透壁率。双极射频消融钳的设计除了电极等工程学的考量外,钳夹的力量是设计时的重点之一。后者决定钳子间组织的致密程度,也影响射频消融的透壁率[24]。目前对消融钳有无盐水灌注、是否影响病理透壁率还有争论,支持者认为盐水灌注降低电极与组织接触面的温度,有利于射频能量向心肌深处传播[25,26],因此射频消融的深度更深,透壁率更高。但临床研究尚未发现使用盐水灌注的射频消融装置较无灌注装置有更好的临床效果。
本实验也存在一定局限。首先,由于是离体动物实验,无法观察射频消融后的长期病理透壁率。急性期病理透壁是否能保证长期的病理透壁率尚未知,而后者正是保证房颤不再复发的关键。其次,心房组织多次消融后的病理透壁率及电隔离率等在本次实验中未行研究。上述局限性在后续动物实验研究中可以进一步验证。
使用国产输出功率可调节的双极射频消融装置时,输出功率在25~35 W区间,消融完成时间随输出功率增加而缩短。<4 mm的心房组织消融完成时间在同一功率水平无显著差异,>4 mm心房组织消融完成时间较<4 mm组织明显延长,且病理透壁率随心房厚度增加而降低。综合考虑消融所需时间、透壁率及安全性,输出功率在30~35 W是较为合理的射频输出功率。
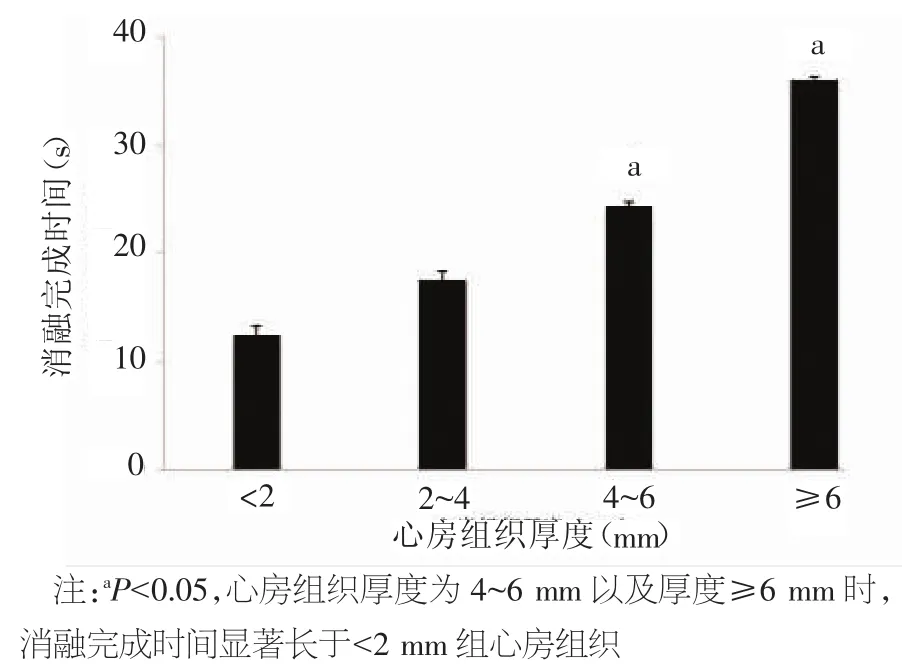
图1 不同心房组织厚度对单次消融完成时间的主效应
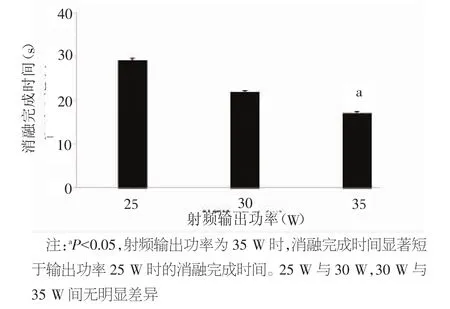
图2 不同射频输出功率对单次消融完成时间的主效应
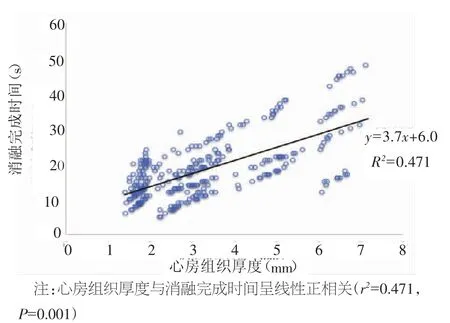
图3 心房组织厚度与消融完成时间的线性回归分析

图4a 射频消融透壁的病理切片图
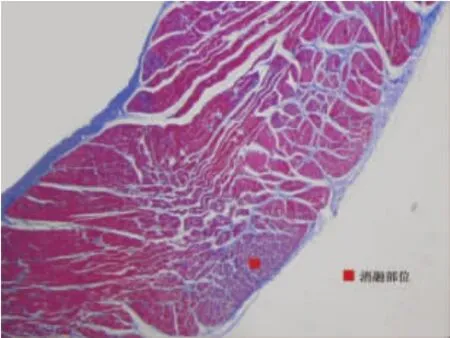
图4b 射频消融不透壁的病理切片图
[1] Benjamin EJ,Levy D,Vaziri SM,et al.Independent risk factors for atrial fibrillation in a population-based cohort.The Framingham Heart Study.JAMA,1994,271:840-844.
[2]Magnani JW,Moser CB,Murabito JM,et al.Association of sex hormones,aging,and atrial fibrillation in men:the Framingham Heart Study.Circ Arrhythm Electrophysiol,2014,7:307-312.
[3] Zhou Z,Hu D.An epidemiological study on the prevalence of atrial fibrillation in the chinese population of mainland China.J Epidemiol,2008,18:209-216.
[4]周自强,胡大一,陈捷.中国心房颤动现状的流行病学研究.中华内科杂志,2004,43:491-493.
[5] Chien KL,Su TC,Hsu HC,et al.Atrial fibrillation prevalence,incidence and risk of stroke and all-cause death among Chinese.Int J Cardiol,2010,139:173-180.
[6] Benjamin EJ, Wolf PA, D’Agostino RB, et al.Impact of atrial fibrillation on the risk of death.Circulation,1998,98:946-952.
[7] Ohsawa MI, Okayama A, Okamura T, et al.Mortality risk attributable to atrial fibrillation in middle-aged and elderly people in the Japanese general population:Nine-teen-year follow-up in NIPPON DATA80.Circ J,2007,71:814-819.
[8] Cox JL.Surgical treatment of atrial fibrillation: a review.Europace,2004,5:S20-29.
[9] Fragakis N,Pantos I,Younis J,et al.Surgical ablation for atrial fibrillation.Europace,2012,14:1545-1552.
[10] Khargi K,Hutten BA,Lemke B,et al.Surgical treatment of atrial fibrillation: a systematic review.Eur J Cardiothorac Surg,2005,27:258-265.
[11] Damiano RJ Jr,Schwartz FH,Bailey MS,et al.The Cox maze IV procedure:predictors of late recurrence.J Thorac Cardiovasc Surg,2011,141:113-121.
[12] Martìn-Suàrez S, Claysset B, Botta L, et al.Surgery for atrial fibrillation with radiofrequency ablation:four years experience.Interact CardioVasc Thorac Surg,2007,6:71-76.
[13] Gillinov AM,McCarthy PM,Blackstone EH,et al.Surgical ablation of atrial fibrillation with bipolar radiofrequency as the primary modality.J Thorac Cardiovasc Surg,2005,129:1322-1329.
[14] Santiago T, Melo J, Gouveia RH, et al.Epicardial radiofrequency applications:in vitro and in vivo studies on human atrial myocardium.Eur J Cardiothorac Surg,2003,24:481-486.
[15] Wood MA, Ellenbogen AL, Pathak VI, et al.Efficacy of a cooled bipolarepicardialradiofrequencyablation probefor creating transmural myocardial lesions.J Thorac Cardiovasc Surg,2010,139:453-458.
[16] Aupperle H, Doll N, Walther T, et al.Ablation of atrial fibrillation and esophageal injury:effects of energy source and ablation technique.J Thorac Cardiovasc Surg,2005,130:1549-1554.
[17] Bugge E,Nicholson IA,Thomas SP.Comparison of bipolar and unipolar radiofrequency ablation in an in vivo experimental model.Eur J Cardiothorac Surg,2005,28:76-82.
[18] Lockwood D,Nakagawa H,Peyton MD,et al.Linear left atrial lesions in minimally invasive surgical ablation of persistent atrial fibrillation:techniques for assessing conduction block across surgical lesions.Heart Rhythm,2009,6:S50-63.
[19] Pison L,La Meir M,van Opstal J,et al.Hybrid thoracoscopic surgical and transvenous catheter ablation of atrial fibrillation.J Am Coll Cardiol,2012,60:54-61.
[20] Bugge E,Nicholson IA,Thomas SP.Comparison of bipolar and unipolar radiofrequency ablation in an in vivo experimental model.Eur J Cardiothorac Surg,2005,28:76-82.
[21] Kato W,Usui A,Oshima H,et al.Incomplete transmural ablation caused by bipolar radiofrequency ablation devices.J Thorac Cardiovasc Surg,2009,137:251-252.
[22] Wakasa S,Kubota S,Shingu Y,et al.Histological assessment of transmurality after repeated radiofrequency ablation of the left atrial wall.Gen Thorac Cardiovasc Surg,2014,62:428-433.
[23]刘培生,陈鑫,刘明.猪心房Atricure双极射频消融系统消融组织透壁性损伤分析.中华外科杂志,2010,48:1881-1884.
[24] Squara F, Latcu DG, Massaad Y, et al.Contact force and force-time integral in atrial radiofrequency ablation predict transmurality of lesions.Europace,2014,16:660-667.
[25] Erdogan A, Grumbrecht S, Neumann T, et al.Microwave,irrigated, pulsed, or conventional radiofrequency energy source:which energy source for which catheter ablation?Pacing Clin Electrophysiol,2003,26:504-506.
[26] Nakagawa H,Yamanashi WS,Pitha JV,et al.Comparison of in vivo tissue temperature profile and lesion geometry for radiofrequency ablation with a saline-irrigated electrode versus temperature controlin a canine thigh muscle preparation.Circulation,1995,91:2264-2273.
In vitro animal test for domestic made bipolar radiofrequency ablation system with changeable radiofrequency output
TANG Min, YIN Hang, JIANG Zhao-lei,et al.Department of Cardiothoracic Surgery, Xinhua Hospital Affiliated to Medical School of Shanghai Jiaotong University,Shanghai 200092, China
MEI Ju, E-mail:Ju_mei63@126.com
Objective To investigate the duration of ablation for atrial tissue with various thickness under different output of radiofrequency(RF) by our domestic made RF ablation machine,and evaluate the accuracy of electrical resistance as the parameter of transmurality.Methods 20 cases of in vitro porcine heart were harvested right after animals were sacrificed.The in vitro hearts were washed in normal saline twice at 4 ℃.Atrial tissue was harvested then.RF was delivered by a domestic made RF ablation system by 25, 30, and 35 watts of output.Ablation lines were made in parallel with the distance of 5 mm in between on atrial tissue.The ablation was terminated after electrical resistance of the ablated tissue reached over 100 Ω.The duration of ablation, the tissue thickness,and the corresponding RF output were recorded.The ablation line was excised for pathological section, transmural-ity was determined by Mason trichrome stain.Results 350 ablation lines were made successfully.Under the same RF output, the ablation duration was longer in the group of atrial tissue with the thickness between 4 and 6 mm,and thicker than 6 mm as compared with the duration of atrial tissue less than 2 mm in thickness[(12.4±0.9)s vs(24.3±0.3)s, P=0.042,(12.4±0.9)s vs (35.9±0.3)s, P=0.001].With the same tissue thickness, the duration of ablation was significantly different between groups of 25 W and 35 W output[(28.9±0.5)s vs (16.9±0.5)s, P=0.010].The duration of ablation was positively correlated to the thickness of atrial tissue.The pathological transmurality varied from 0 to 60%.It increased with the higher output,and decreased with the thicker atrial tissue.Conclusion The duration of ablation is determined by the thickness of atrial tissue and the RF output.The pathological transmurality is relatively low with single ablation.30 and 35 W are optional RF output,considering the safety of ablation,reasonable ablation duration and pathological transmurality.
Bipolar radiofrequency ablation; Thickness of tissue;Radiofrequency output;Duration of ablation;Transmurality
上海市科学技术委员会重点科技攻关项目(项目编号:11441900200)
200092 上海市,上海交通大学医学院附属新华医院心胸外科
梅举,E-mail:ju_mei63@126.com
10.3969/j.issn.1672-5301.2014.09.023
Q95-33;R654.2
A
1672-5301(2014)09-0851-05
2014-07-14)
