爱玉ISSR反应体系的建立与优化*
2014-09-05黄其梅叶美娜阮少江
史 辉,黄其梅,叶美娜,阮少江,陈 勇
(1.宁德师范学院生物系,福建 宁德 352100;2.闽东特色生物资源福建省高校工程研究中心,福建 宁德 352100)
爱玉ISSR反应体系的建立与优化*
史 辉1,2,黄其梅1,叶美娜1,阮少江1,2,陈 勇1,2
(1.宁德师范学院生物系,福建 宁德 352100;2.闽东特色生物资源福建省高校工程研究中心,福建 宁德 352100)
通过单因子试验和正交设计,对影响爱玉ISSR-PCR扩增效果的因素,如模板DNA用量、Taq酶用量、dNTPs浓度、引物浓度、延伸时间和循环次数等指标进行优化.实验确立了可用于爱玉ISSR-PCR分析最适宜的反应体系:20 μL反应体积中含1 ng模板DNA、1.0 U Taq酶、0.4 μmol/L引物和0.18 mmol/L dNTPs;PCR扩增程序为94 ℃预变性4 min;94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸2.5 min,共35个循环;72 ℃延伸7min,4 ℃保存.应用该体系对14份爱玉种质进行扩增,证实了该体系的适用性和稳定性.
爱玉;ISSR;反应体系;正交设计
爱玉(FicuspumilaL. var.awkeotsang)是桑科榕属(Moraceae,Ficus)植物,分布于中国的福建省东北部、浙江南部和台湾.爱玉瘦果制成的爱玉冻是一种高贵的天然食品,富含果胶、维生素和矿质元素,且糖分与脂肪含量较低,可作为低脂低热食品研发的重要资源,具有良好的应用前景.近年来爱玉栽培面积不断扩大,对优良品系的需求越来越多.目前,人们对爱玉遗传背景不是很了解,为防止因伪劣品系或品系混乱造成生产损失,对爱玉优良品系进行准确鉴别尤为重要.
简单序列重复区间扩增(Inter-simple sequence repeats,ISSR)是在微卫星标记技术上发展起来的标记技术,具有多态性高和产物特异性强等特点[1],广泛应用于植物品种鉴定、基因定位、遗传作图、遗传多样性、进化及分子生态学研究.目前,ISSR技术已在香蕉、芒果、柑橘等多种果树上得到广泛应用,但在关于爱玉的研究还未见报道.不同植物的ISSR反应体系中各成分用量、扩增程序和适宜引物均不同[2],因此进行体系优化是研究的前提.笔者采用单因素试验和正交试验相结合的实验方法,建立爱玉ISSR-PCR最适反应体系,以期为爱玉种质资源鉴定与引种等奠定研究基础.
1 材料和方法
1.1材料
1.1.1 试材 供试材料为爱玉太6品系基因组DNA,采自福州闽侯南屿镇爱玉生态研究园.
1.1.2 试剂 Taq DNA聚合酶与DL2000 Marker均购自Takala公司,引物由上海捷瑞生物工程有限公司合成,琼脂糖为西班牙Biowest进口分装,其他试剂均为国药分析纯.
1.1.3 仪器 梯度PCR扩增仪(美国Biometra C-412),移液枪(法国吉尔森 Ppetman系列),制冰机(Scotsman AF100-AS),超纯水系统(美国MILLI-Q),涡旋振荡器(德国IKAMS3digital),电泳仪(北京六一DYY-10C型),紫外透射仪(上海嘉鹏科技有限公司ZF),凝胶成像系统(Bio-rad GelDoc EZ).
1.2方法
1.2.1 ISSR-PCR反应体系单因子优化 选用UBC808引物(序列为(AG)8C),模板为爱玉太6品系DNA,分别对影响ISSR-PCR扩增的DNA模板用量、Taq酶用量、引物浓度、dNTPs浓度、循环次数和延伸时间等6个因素进行优化.分别设置11个模板用量为0.05,0.1,0.2,0.3,0.4,0.5,1,2,3,4,5 ng;10个Taq酶用量为0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.1,1.2 U;10个引物用量为0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 μmol/L;10个dNTPs浓度为0.10,0.12,0.14,0.16,0.18,0.20,0.22,0.24,0.26,0.28 mmol/L;5个循环数为25,30,35,40,45个;5个延伸时间为1.0,1.5,2.0,2.5,3 min.初始反应体系为:模板DNA 1 ng;808引物0.5 μmol/L;10*buffer 2 μL;dNTPs 0.20 mmol/L;Taq酶 0.5 U;补ddH2O至20 μL.初始PCR扩增程序为:94 ℃预变性4 min,94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸90 s,共35个循环;72 ℃最后延伸7 min,4 ℃保存[3].扩增结束后,产物经1.5%琼脂糖电泳检测,凝胶成像系统并拍照记录数据.比较各因素在不同梯度时的扩增效果,每个因素的优化条件作为后续的扩增条件.
1.2.2 ISSR-PCR反应体系正交优化 根据单因子试验初步确定Taq酶用量、引物浓度、dNTPs浓度、循环数和延伸时间后,采用L18(35)正交设计[4]对各个因素进行优化组合(见表1).参照文献[4],以谱带多态性高、主带清晰、副带明显、背景低为原则,对正交实验各处理综合评分,最高为10分,最低为1分.根据打分求出每个因素同一水平下的平均值ki,并求出极差R,得到爱玉ISSR-PCR反应各因素的最佳组合.正交优化试验因子和水平数见表1.
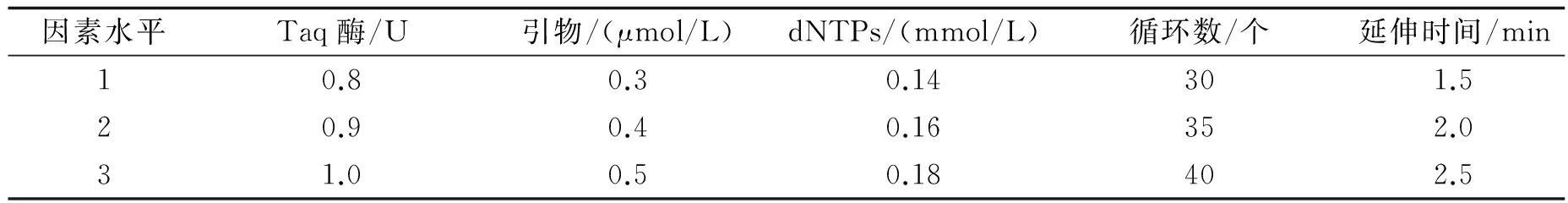
表1 ISSR-PCR反应体系正交试验设计表L18(35)
1.2.3 优化体系适用性检测 为了验证优化后体系的适用性和稳定性,随机选择2个适宜引物,用此优化的反应体系对14份爱玉种质进行扩增,验证其优化效果.
2 结果与讨论
2.1单因素试验结果
2.1.1模板用量对PCR的影响 模板用量对扩增谱带数量的影响不大(见图1),主要影响谱带的亮度,随着用量的增加,条带亮度略有增加,当模板用量超过1 ng时,条带亮度不再增加.因此,模板量选用1 ng.
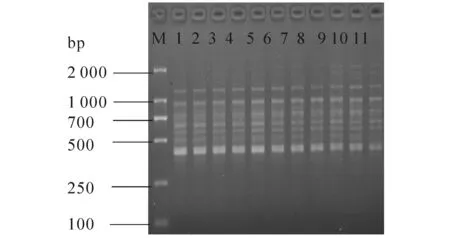
2.1.2 Taq酶用量对PCR的影响 Taq酶用量对结果影响明显(见图2),当Taq酶用量小于0.9 U时,随着酶用量的增加,扩增条带亮度明显增加.达到0.9 U时,条带亮度最高,再增加酶的用量,条带亮度降低,扩增效果变差.当达到1.2 U时,几乎无扩增,因此0.9 U为Taq酶最适的用量.
M—DL 2000;1—11分别表示5,4,3,2,1,0.5,0.4,0.3,0.2,0.1,0.05 ng模板DNA.
M—DL 2000;1—10分别表示0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.1,1.2 U Taq酶.
2.1.3 dNTPs浓度对PCR的影响 在图3中显示,浓度在0.10~0.18 mmol/L范围内,随浓度的增加,条带数量不变,清晰度略有增加,当浓度超过0.18 mmol/L时,条带的数量和清晰度随之下降,在大约250 bp处出现模糊分散的扩增条带,这是非特异性扩增所致.为后续正交试验考虑,选中间的一个条带较为清晰的浓度0.16 mmol/L作为适宜的dNTPs浓度.
2.1.4 引物浓度对PCR的影响 如图4,在一定范围内,随着引物浓度的增加,条带的数量和清晰度随之增加.当引物浓度超过0.4 μmol/L时,条带的清晰度随之下降,在250 bp处出现模糊的非特异性条带.所以,引物浓度选择0.4 μmol/L.
M—DL 2000;1—10分别表示0.10,0.12,0.14,0.16,0.18,0.20,0.22,0.24,0.26,0.28 mmol/L dNTPs.
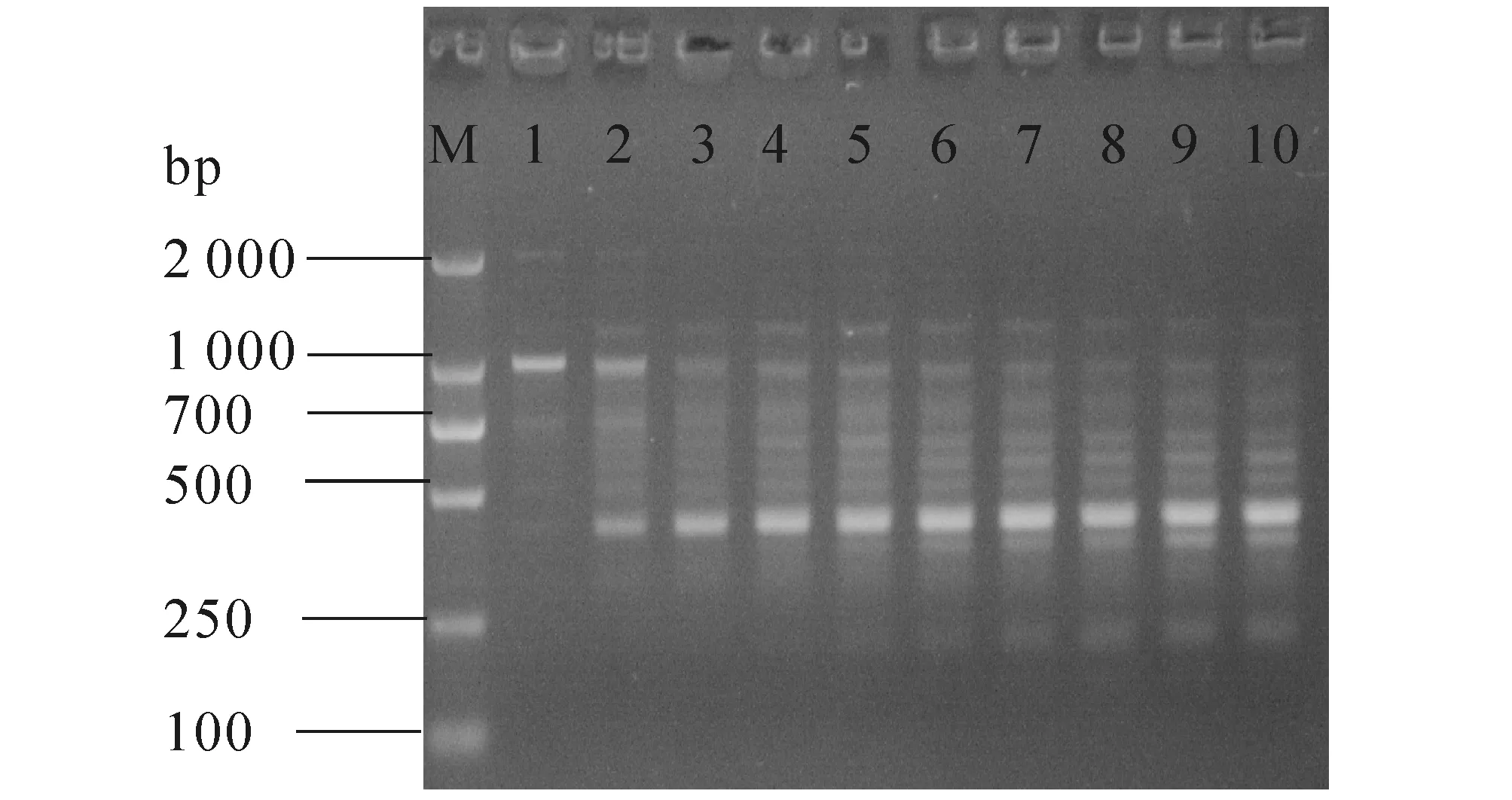
M—DL 2000;1—10分别表示0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 μmol/L 引物.
2.1.5 延伸时间对PCR的影响 如图5,随着延伸时间的增加,条带的数量、亮度和清晰度变化不大,有些大于2 000 bp的大片段虽有扩增,但很模糊,后续条带计数困难.为节约时间,延伸时间选2 min.
2.1.6 循环数对PCR的影响 循环数决定PCR产物量.循环数少,产量少,条带弱;循环数过多会引入非特异性扩增.如图6,25个循环几乎无扩增,随着循环数的增加,条带的亮度有增加趋势,但条带数量明显减少,有些大于750 bp的片段几乎无扩增.因此,30个循环是最适宜的延伸时间.
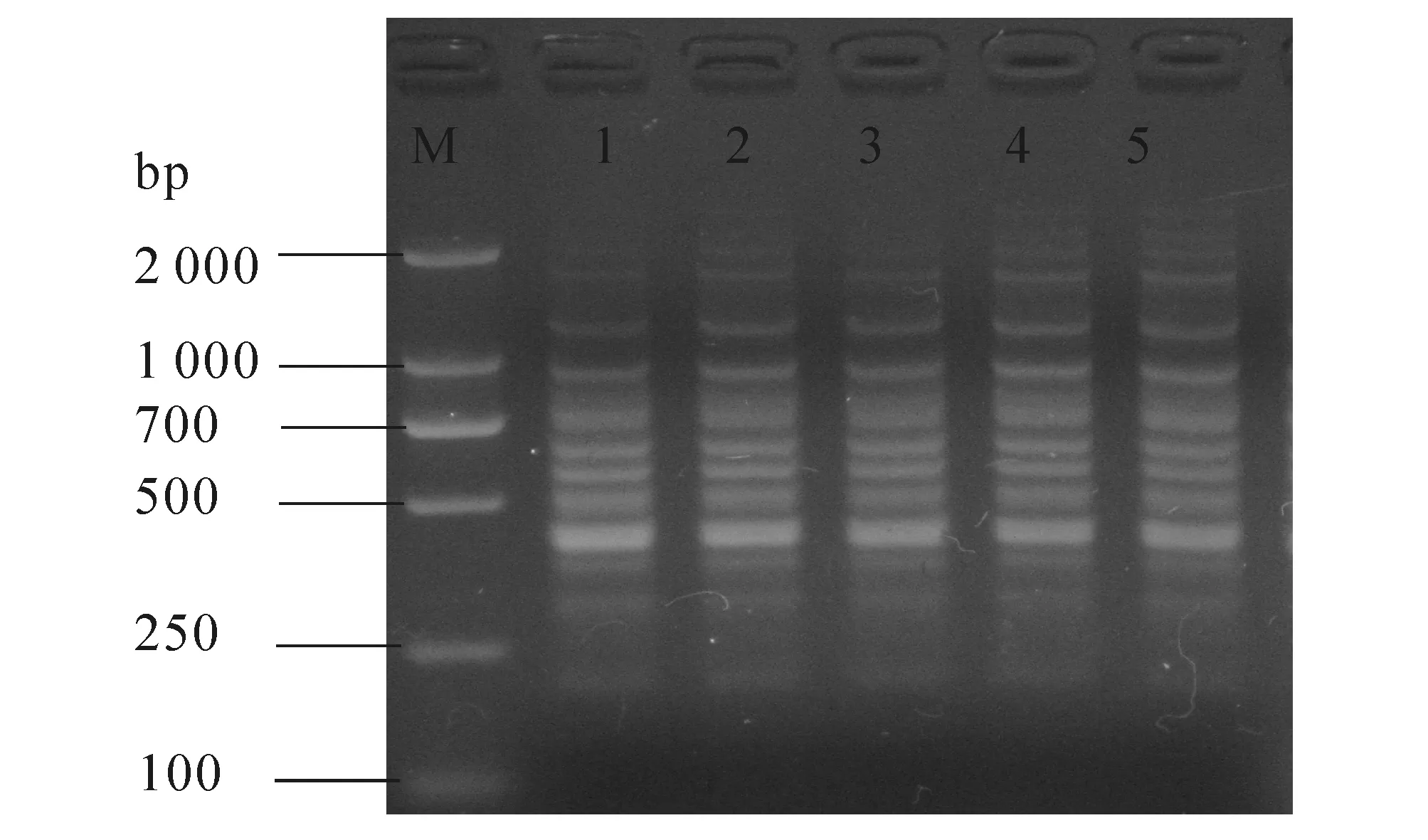
M—DL 2000;1—5分别表示1,1.5,2,2.5,3 min延伸时间.
M—DL 2000;1—5分别表示25,30,35,40,45循环.
2.2正交实验结果
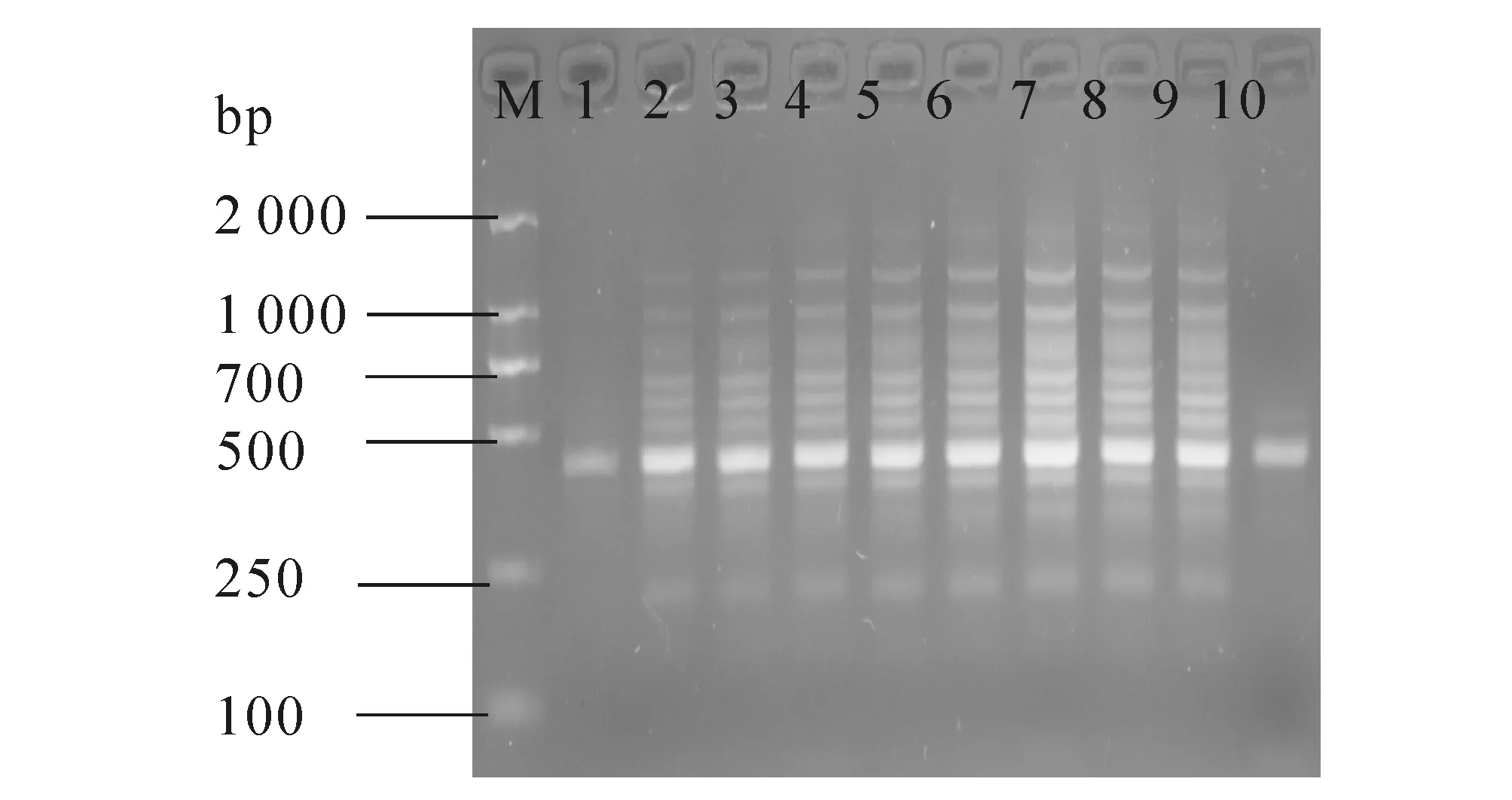
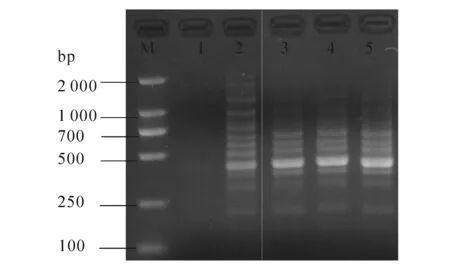
图7中,正交试验的所有处理均有扩增条带,但不同处理其扩增条带的数量、明亮度和清晰度不同.以谱带多态性高、主带清晰、副带明显、背景低为原则,对正交实验各处理综合评分见表2.从各因素的K值可以看出,Taq酶为3水平(1.0 U)、引物为2水平(0.4 μmol/L)、dNTPs为3水平(0.18 mmol/L)、循环次数为1水平(30次)、延伸时间为3水平(2.5 min)时扩增效果最好;从极差可以看出,循环次数对扩增效果影响最大,30个循环明显优于其他循环;延伸时间对扩增效果有一定影响;Taq酶用量对扩增效果影响最小.
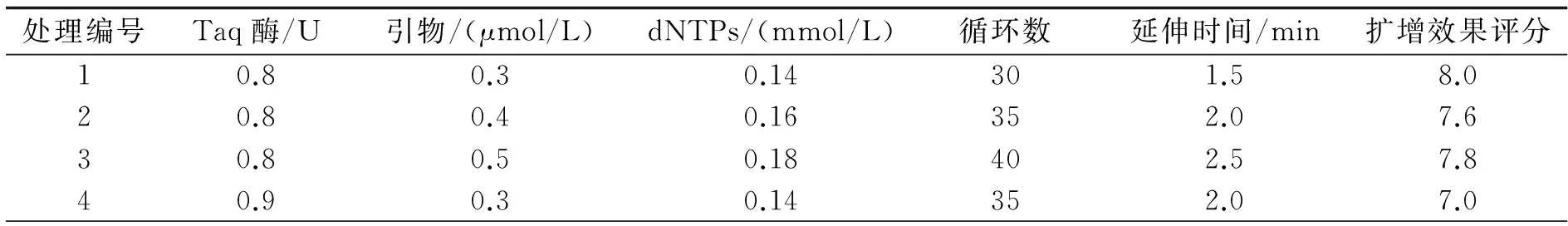
表2 ISSR反应体系的正交试验结果L18(35)
续表
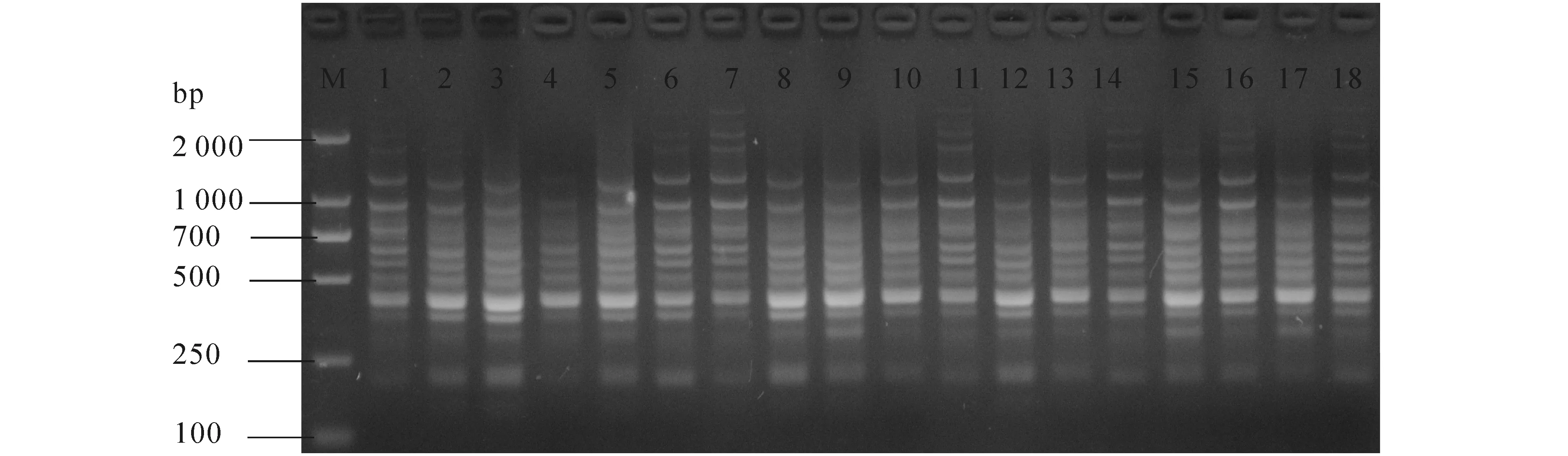
M—DL 2000;1—18为处理编号.
2.3优化体系适用性检测结果
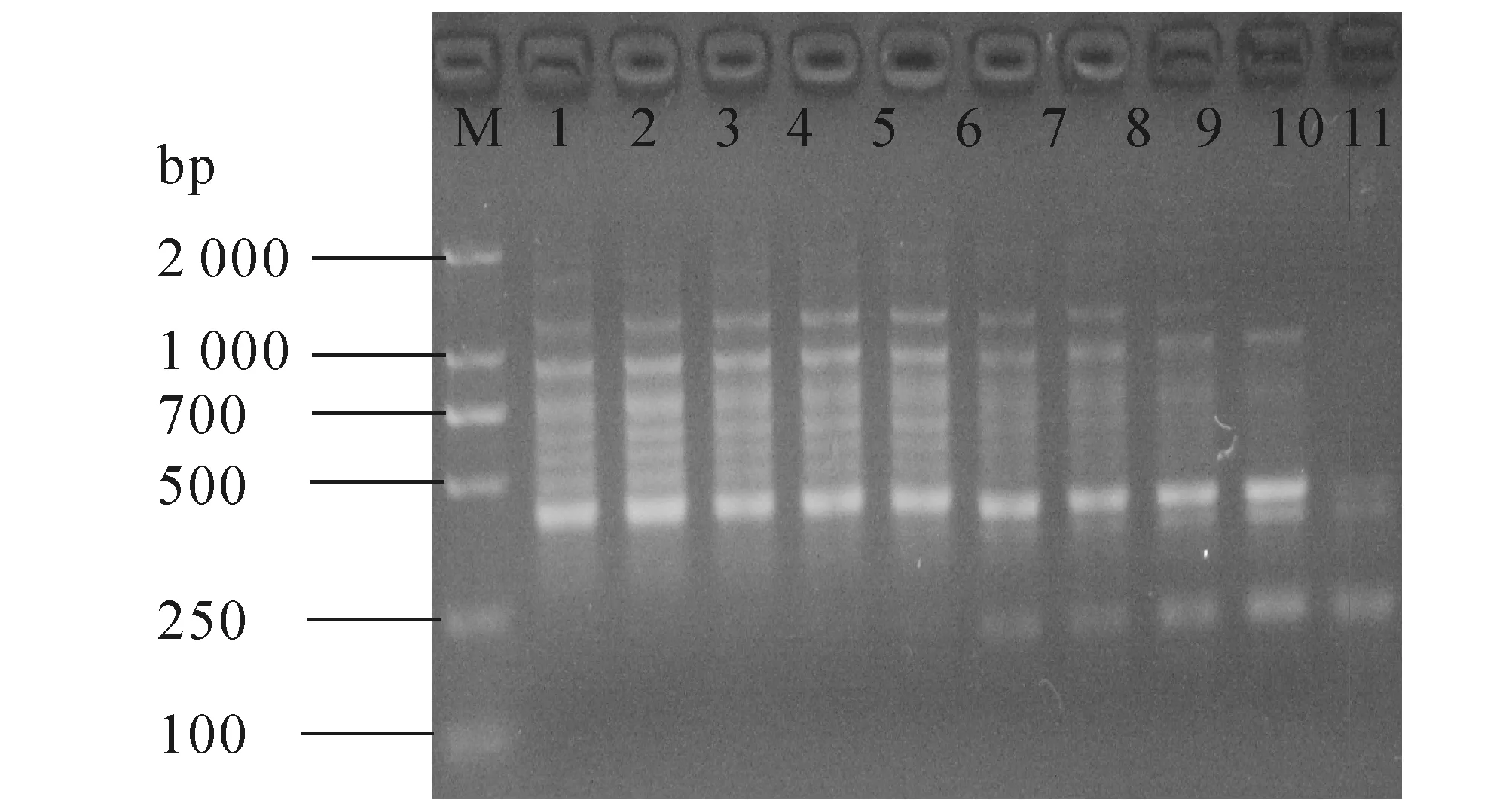
随机选取UBC809和UBC864这2个引物,确定最佳退火温度Tm后,采用该优化体系对14份爱玉种质进行PCR扩增,都能扩增出比较清晰的条带,且多态性较高(见图8),说明该优化后的反应体系适于爱玉的ISSR-PCR扩增.
3 结论与分析
研究表明,ISSR标记是随机标记,影响ISSR-PCR的因素很多,反应体系和反应程序中的每个因子都对最终的扩增效果有影响[5].但在各种扩增参数固定的条件下,会表现出较高的稳定性[6].因此,对ISSR-PCR反应体系的各种影响因子如模板用量、Taq酶用量、dNTPs、引物浓度、Mg2+离子等因素进行优化和筛选是必要的,也是应用该技术的前提[7].
(1) 模板用量关系到PCR产物的产量和特异性.当模板用量过低时,引物与模板结合的几率小,扩增效率低,条带浅或无条带;当模板用量过高时,非特异性条带增加,同时也会增加模板之间配对的机会,减少引物与模板的配对,也可能将杂质过多地带入反应体系[8-9].其他植物的研究发现,ISSR-PCR反应对模板DNA用量范围要求较宽,20 μL反应体系中一般为5~50 ng[10-11].但笔者在前期的研究中,模板量超过20 ng就几乎没有扩增.可能是因为爱玉基因组较小,少量的基因组DNA含有与其他植物等量的模板;也可能是因为爱玉叶片多酚、多糖类次生物质含量极高[12],模板DNA纯度较低.因为模板DNA中的杂质会抑制Taq酶活性,适当稀释会减少杂质对Taq酶活性的抑制[13].研究中适宜的模板DNA用量为1 ng.
(2) 实验中发现,Taq酶用量对扩增效果影响很大.当Taq酶用量过低时,催化能力弱,产物的合成量低,条带浅;当Taq酶用量过高时,不仅增加试验成本,而且产生非特异性扩增,背景增强,条带模糊,甚至无扩增.
(3) dNTPs浓度太高容易产生错配,增加非特异性扩增;浓度太低扩增效率低,甚至会因为dNTPs的过早消耗完毕,而使扩增产物单链化,影响扩增效果[14].文中dNTPs的浓度小于0.10 mmol/L 时扩增条带较弱,当浓度大于0.20 mmol/L时又出现非特异扩增,且部分特异性扩增条带丢失.
(4) 当引物浓度过高时,易引入碱基错配和非特异性扩增,还会形成引物二聚体;当引物浓度过低时,与模板结合效率低,产量下降,并有可能出现涂抹现象[15].文中引物浓度对结果影响较为明显,浓度太低不能进行有效的扩增,浓度太高会条带不稳定及清晰度下降.这与其他植物研究结果较为一致.
(5) 延伸时间过短,产物得不到有效扩增;延伸时间过长,易产生非特异性扩增.研究中选用的几个延伸时间梯度都比较长,基本都能满足扩增的需要,延长延伸时间对长片段的扩增有利,但是在该研究中几个长片段的扩增效果不明显,对结果几乎无影响.
(6) 循环数对结果影响较显著,循环数不足,几乎没有扩增;循环数过多,又会丢失大部分特异性扩增的大片段.可能是过多的循环数使Taq酶活性减弱,扩增速度减慢,在一定的延伸时间内,只能完成中小片的扩增,不能完成较大片段的扩增.
考虑ISSR-PCR主要反应参数间的交互作用[16],在单因素的试验基础上,进一步作正交试验.考虑到爱玉模板浓度对结果影响最小,模板浓度范围较宽,为减少工作量,正交试验中就不再对模板浓度进行优化.正交试验设计是从多个因子中挑选出有代表性的水平组合进行实验,相对于多因子的完全组合设计大大减少了工作量,以最少的处理组合,获得最优体系[17].由于文中对正交试验结果的评分主要依靠主观判断,存在一定的主观性,因此需要检测优化体系的适用性和稳定性.
该实验优化后的ISSR反应体系在14份爱玉材料中都能扩增出稳定清晰,多态性高的条带.因此,建立的爱玉ISSR-PCR 反应体系稳定可靠,适用于其他ISSR引物和所有爱玉种质,可以为后续应用ISSR标记技术进行爱玉种质遗传多样性分析、品种鉴定和引种等工作奠定研究基础.
[1] ZIET K E,RAFAL S A,LABUDA D.Genome Fingerprinting by Simple Sequence Repeat (SSR) Anchored Polymerase Chain Reaction Amplification[J].Genomes,1994,20(2):176-183.
[2] 张春平,何 平,王瑞波,等.三角叶黄连ISSR反应体系的建立与优化[J].中草药,2009,40(2):282-284.
[3] 王心宇,陈佩度,亓增军,等.ISSR标记在小麦指纹图谱分析中的应用研究初探[J].农业生物技术学报,2001,9(3):261-263.
[4] 何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[5] LIU Guifeng,DONG Jingxiang,JIANG Ying,et al.Analysis of Genetic Relationship in 12 Species of Section Strobus with ISSR Markers[J].Journal of Forestry Research,2005,16(3):213-215.
[6] 房志超,黄建峰,高爱平.芒果ISSR反应体系的建立与优化[J].热带作物学报,2001,32(2):203-207.
[7] 欧立军,颜 旺,廖亚西,等.天门冬ISSR分子标记技术的建立与体系优化[J].中草药,2001,24(2):353-357.
[8] 欧文军,李开绵,王文泉.小桐子基因组DNA的提取及ISSR-PCR反应体系的优化[J].中国农学通报,2008,24(5):409-413.
[9] 卢圣栋.现代分子生物学实验技术[M].第2版.北京:中国协和医科大学出版社,1999:458-463.
[10] 周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005:143-146.
[11] 赵依杰,王江波,张小红,等.枇杷ISSR扩增反应体系的优化[J].中国农学通报,2010,26(7):26-30.
[12] 吴文珊,朱晓东,郑翠芳,等.爱玉子基因组DNA的提取和质量分析[J].福建林业科技,2008,35(3):48-50.
[13] 赵 谦,杜 虹,庄东红.ISSR分子标记及其在植物研究中的应用[J].分子植物育种,2007,6(5):123-129.
[14] 余 艳,陈海山,葛学军.简单重复序列区间(ISSR)引物反应条件优化与筛选[J].热带亚热带植物学报,2003,11(1):15-19.
[15] BRUNO W S.High Output Genetic Mapping of Polyploids Using Pcr-Generated Markers[J].Theoretical and Applied Genetics,1993,86:105-112.
[16] 潘 坤,王文泉,吴 翼,等.椰子ISSR体系优化[J].中国农学通报,2009,25(4):24-29.
[17] 张永春,汤庚国,褚云霞,等.彩色马蹄莲ISSR体系的建立及初步分析[J].分子植物育种,2009,7(4):827-832.
(责任编辑 易必武)
EstablishmentandOptimizationofISSRReactionSystemforFicusPumilaL.var.Awkeotsang
SHI Hui1,2,HUANG Qimei1,YE Meina1,RUAN Shaojiang1,2,CHEN Yong1,2
(1.Department of Biology,Ningde Normal University,Ningde Fujian 352100,China;2.Fujian Provinces University Project Research Center of Biological Resources with Mingdong’s Unique Feature,Ningde 352100,Fujiang China)
The factors affecting the ISSR-PCR amplification onFicuspumilaL. var.awkeotsangsuch as dosage of template DNA,Taq DNA polymerase,dNTPs,primers and extension time and cycle times were optimized through the combination of single factor and orthogonal design experiment.The results showed that the optimal reaction system for ISSR-PCR of Ficus pumila were as follows:In the 20 μL reaction volume,1ng template DNA,1.0U Taq DNA polymerase,0.4 μmol/L primers,0.18 mmol/L dNTPs.The optimal PCR amplification process was:4 minutes at 94 ℃ for predenaturation,then followed by 35 cycles,each with 45 seconds at 94 ℃ for denaturation,45 seconds at 53 ℃ for annealing,2 at 72 ℃ for extension,finally extension at 72 ℃ for 7 minutes and holding the samples at 4 ℃.The system was applied in the amplification of 14 varieties of indicated the suitability and stability of the system.
FicuspumilaL. var.awkeotsang;inter-simple sequence repeat(ISSR);reaction system;orthogonal design
1007-2985(2014)02-0073-06
2013-12-26
宁德师范学院“服务海西建设”资助项目(2010H309);福建省自然科学基金资助项目(2006JA0399);福建省大学生创新创业训练计划资助项目(201310398019)
史 辉(1979-),男,安徽淮北人,宁德师范学院生物系副教授,硕士,主要从事作物遗传育种教学研究
陈 勇(1954-),男,江苏南京人,宁德师范学院生物系教授,主要从事植物分类教学研究
S667
A
10.3969/j.issn.1007-2985.2014.02.017
