COX-2在沙漠干热环境创伤失血性休克大鼠肺组织中的表达及其与肺损伤的相关性研究
2014-08-30刘江伟钱建辉钱若筠杨向新
李 瑞,谢 志,刘江伟,钱建辉,钱若筠,张 琼,杨向新,杨 帆
创伤失血性休克容易诱发急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)等,均是危及生命的综合征,导致高发病率和死亡率[1]。我国西北地区分布着大面积的戈壁沙漠,在夏季存在着气温高、昼夜温差大、干燥等特点。因为戈壁沙漠环境恶劣,在此环境下更易造成机体损伤的加重,我们推测此环境下的创伤失血性休克更容易造成肺部损伤,但目前在国内外尚未见沙漠干热环境创伤失血性休克后继发性肺部损伤的文献报道,本实验主要是在西北特殊环境人工实验舱中(40°C,湿度10%)建立创伤失血性休克模型,研究COX-2在创伤失血性休克继发肺损伤的变化规律及其与肺损伤机制的相关性,为沙漠干热环境创伤失血性休克有效救治提供理论依据。
材料与方法
1 实验材料和仪器
140只SPF级,雄性SD大鼠,重约280~320g(新疆医科大学实验动物中心); 丙二醛(MDA)、总超氧化物歧化酶(T-SOD)测定试剂盒(南京建成生物工程研究所); COX-2引物: 上游: 5′-TGGTGCCGGGTCTGATGATG-3′,下游: 5′-GCAATGCGGTTCTGATACTG-3′; β-actin引物: 上游: 5′-AACCGTGAAAAGATGACCCAGAT-3′,下游5′-GTGGACAGTGAGGCCAGGAT-3′,(上海生物工程有限公司); TRIzon总RNA提取试剂(北京康为世纪生物科技有限公司); 反转录试剂盒和荧光定量Mix(美国Invitrogen公司)。泰盟BL-420F机能系统; 电子显微镜; 酶标仪、荧光定量PCR仪(美国Bio-Rad公司); 模拟环境在兰州军区乌鲁木齐总医院研制的“西北特殊环境人工实验舱”中进行。
2 实验分组、模型建立及取材
实验前大鼠常规自由进食、饮水,沙漠干热环境创伤失血性休克组将各组实验大鼠放置在西北特殊环境人工实验舱内,并使用沙漠干热环境气候模式(40°C,湿度10%),让大鼠自由活动预热60min后,在人工实验舱内制造创伤失血性休克模型,模型参照孙英刚等[2]建立的创伤失血性休克模型并加以改进,采用3%戊巴比妥腹腔麻醉,使用静脉留置针行右颈动、静脉和右股动脉插管,右颈动脉插管接BL-420F生物机能监测系统,用于测量血压等血流动力学指标; 颈静脉插管建立简易补液通道; 右股动脉插管以备放血。留置针插管前均经肝素钠生理盐水(500U/kg)抗凝,并连接三通管以方便监测血压及采血。大鼠稳定10min后,利用250g铁轮于30cm高度击中SD大鼠左下肢股骨中上段造成粉碎性骨折,致伤后简易包扎伤口,经右股动脉放血使MAP维持在(35±5)mmHg[3],若经打击后血压不能维持则通过右颈静脉补液通道输注生理盐水以维持平均动脉压(MAP)。大鼠行动静脉插管及创伤打击模型完成时间控制在25~30min,并以大鼠MAP达到(35±5)mmHg为休克0h时间点。模型成功后转移至常温环境中(25°C,湿度35%),常温环境创伤失血性休克在常温常湿环境中进行,其方法同干热环境组,沙漠干热环境对照组和常温环境对照组除不致伤外其余步骤同实验组,插管完成后即进行采血及组织取样。分别按照设定的时间点处死大鼠,打开胸腔,游离、结扎右侧肺叶,首先分离、剪开气管首先进行气管插管、固定,用5ml注射器,每次4ml 4℃生理盐水缓慢推注、回抽,共灌洗肺5次,记录回抽液体量,计算回收百分率(回收率需>80%,否则弃用),-80℃冻存备用,然后留取右侧肺,右肺上叶甲醛4%固定,然后脱水、包埋,其余-80℃冻存。
3 观测指标及方法
3.1病理学变化及肺损伤病理学评分 由包埋好的肺组织,行常规切片、HE染色,观察病理变化,同时由专业技术人员根据Mikawa、张素品等[4-5]标准做肺损伤评分,各按程度分为5个等级 : 0分为无该项病理改变或极轻; 1分为病理变化轻且很局限; 2分为病理变化中等; 3分为病理变化中等但广泛或局部显著; 4分为非常显著的广泛性病理改变。每张切片随机取10个高倍视野,每个视野病理评分为每项评分之和,10个视野的平均值为病理评分。
3.2肺灌洗液总蛋白量的测定 肺灌洗液由-80℃取出,4℃12 000转离心10min,按照总蛋白定量测定试盒说明书步骤操作,于562nm处测定各管光密度(OD)值,根据公式计算最终浓度,统计处理数据。
3.3肺组织MDA浓度、T-SOD活力测定 把肺组织由-80℃取出,称取0.1g肺组织,在4℃生理盐水中漂洗、拭干,于玻璃匀浆管中手工匀浆,用1ml生理盐水冲洗转移至1.5ml EP管内制备成10%的组织匀浆,3 000转/min,离心10min,留取上清,MDA按照试剂说明书步骤操作,于460nm处,测定光密度(OD)值,而T-SOD活力测定首先根据预实验确定最佳取样浓度和最佳取样量(2%组织匀浆,取样量50μl),按照试剂说明书步骤操作于550nm处,测定OD值,最后根据公式计算各样本活性或浓度。
3.4肺组织COX-2 mRNA 表达量 肺组织按照北京康为世纪生物科技有限公司提供的TRIzon总RNA提取试剂说明书,提取总RNA并测量浓度,计算20μl反转录体系所需体积; 然后依据美国Invitrogen公司提供说明书以提取的总RNA作为模板配成20μl的体系,进行反转录得到cDNA,最后以反转录出来的cDNA为模板配成20μl体系,在Bio-Rad实时荧光定量仪器上设定扩增参数: 95℃预变性3min; 95℃预变性10s,60℃复性30s,75℃延伸10s,共41个循环; 最后于75℃延伸10min,进行测定得出COX-2和内参β-actin的ct值。
4 统计学分析
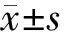
结 果
1 肺损伤病理学评分
常温组与干热组肺损伤评分在休克后各时间点均高于对照组(P<0.05); 干热组休克后各时间点均高于常温组,最大值(6.63±0.14)出现在1.5h时,常温组最大值(5.50±0.20)在2.0h时出现,各时间点比较差异(P<0.05)(图1)。
2 肺灌洗液总蛋白量
常温组与干热组肺灌洗液总蛋白量在休克后各时间点均高于对照组(P<0.05); 干热组休克后各时间点均高于常温组,最大值(157.31±3.63)μg/ml出现在1.5h,常温组最大值(117.29±5.97)μg/ml出现于2h,组内休克后各时间点比较存在明显差异(P<0.05); 相关性分析发现其与肺损伤评分结果呈正相关,相关系数为R常温=0.674、R干热=0.795(P<0.05)(图2)。

▲常温组与干热组各时间点与对照组比较均存在显著性差异,△各时间点常温组与干热组比较,*常温组各时间点比较,#干热组各时间点比较,P<0.05
图1 各组大鼠肺损伤病理评分

▲常温组与干热组各时间点与对照组比较均存在显著性差异,△各时间点常温组与干热组比较,*常温组各时间点比较,#干热组各时间点比较,P<0.05
图2 各组大鼠肺灌洗液总蛋白量
3 肺组织MDA浓度与T-SOD活力
干热组MDA浓度休克后各时间点均高于常温组,干热组在1.5h时出现峰值,而常温组峰值出现在2.0h时,组内各时间点之间也存在差异(P<0.05); 干热组与常温组MDA浓度均与肺损伤评分呈正相关,相关系数分别为R干热=0.885、R常温=0.757。而干热组T-SOD活力休克后各时间点间均小于常温组,在休克后0.5h处出现峰值,组内各时间点间也存在差异(P<0.05),与肺损伤评分呈负相关,相关系数分别为R干热=-0.573,R常温=-0.826(P<0.05)(表1)。
4 肺组织COX-2 mRNA表达量
常温组与干热组COX-2 mRNA表达量休克后各时间点均高于对照组(P<0.05),干热组休克后各时间点均高于常温组,干热组最大值(3.46±0.19)出现在1.5h早于常温组最大值(2.13±0.13)(常温组最大值出现在2h)出现,组内休克后各时间点比较存在明显差异(P<0.05),相关性分析发现COX-2 mRNA表达量与肺损伤评分呈正相关,相关系数分别为R干热=0.706、R常温=0.761(P<0.05)(表1)。

表1 肺组织匀浆MDA浓度、T-SOD活力、COX-2 mRNA表达量
休克后各时间点与对照组比较:*P<0.05; 常温组休克后各时间两两比较存在显著差异:#P<0.05; 干热组休克后各时间点间两两比较存在显著差异:ΔP<0.05; 各时间点常温组与干热组比较:▲P<0.05
讨 论
创伤失血性休克容易造成全身性缺血再灌注、多器官功能衰竭,其中急性肺损伤(ALI)作为全身炎症反应综合征(SIRS)一个重要组成部分经常发生在创伤患者,在过去的10年中,尽管支持治疗改善,ALI仍然具有很高的死亡率(26%~35%)[6-7]。沙漠戈壁在夏季存在着气温高、昼夜温差大、干燥等特点,目前对于沙漠干热环境中的创伤失血性休克的研究国内外未见文献报道,本实验通过在西北特殊环境人工实验舱中建立沙漠干热环境创伤失血性休克模型,探讨COX-2等在创伤失血性休克继发肺损伤时的变化规律及其与肺损伤机制的相关性,为进一步研究提供理论依据。
本实验研究发现常温组与干热组肺损伤评分在休克后各时间点均高于对照组,且干热组休克后各时间点均高于常温组,干热组峰值出现在1.5h早于常温组峰值(2.0h)出现(P<0.05); 常温组与干热组肺灌洗液总蛋白量在休克后各时间点均高于对照组,干热组休克后各时间点均高于常温组,峰值出现比常温组峰值早,组内休克后各时间点比较存在明显差异(P<0.05); 相关性分析发现其与肺损伤评分结果呈正相关,R常温=0.674、R干热=0.795(P<0.05)。可见创伤失血性休克大鼠继发急性肺损伤时,沙漠干热环境中高温、干燥等特点一方面可能是通过使TAX2/PGI2动态平衡失衡,微血管强烈收缩、微血管内血栓形成与堵塞等引发肺水肿、较严重组织细胞损伤,另一方面通过呼吸道直接对肺泡壁、血管上皮细胞产生损伤,导致细胞膜、血管基底膜完整性破坏、渗出增加,进一步加重肺损伤。
当氧自由基(ROS)生产超过其抗氧化能力,导致脂质过氧化和随之而来的组织损伤和细胞死亡[8],MDA浓度高低间接反映机体细胞受自由基破坏的严重程度,而T-SOD活力可反映机体清除氧自由基的能力。该实验结果显示干热组和常温组肺组织匀浆MDA浓度在休克后各时间点均高于对照组(P<0.05); 干热组各时间点均明显高于常温组,干热组在1.5h时出现峰值,而常温组峰值出现在2.0h时,组内各时间点之间也存在差异(P<0.05); 但是干热组和常温组T-SOD活力在休克后各时间点均低于对照组,干热组T-SOD活力休克后各时间点间均小于常温组,在休克后0.5h处出现峰值,组内各时间点间也存在差异(P<0.05); 干热组MDA浓度与肺损伤评分呈正相关,而T-SOD活力与肺损伤病理学评分呈负相关。两者结合表明干热环境中创伤失血性休克大鼠继发性肺损伤可能是由于氧自由基大量产生,同时组织抗氧化能力减弱,导致脂质过氧化损伤所引起。另外,沙漠高气温、干燥等因素可导致创伤失血性休克大鼠肠道细菌发生转移,炎症因子大量释放,引起“呼吸爆发”、“二次打击”等也可能是其较常温组损伤严重且出现较早的原因之一。
众所周知的环氧化酶(COX)是前列腺素(PGs)合成的限速酶,参与炎症反应且在许多肿瘤组织细胞中COX-2的表达升高[9]。其中COX-2是诱导型,正常组织只有少量表达,但在多种细胞因子及促炎性物质等能快速诱导其基因大量表达,生成COX-2催化产生大量PGs同时释放ROS,PGs在ALI的发病过程中发挥重要作用,亦可加重炎症反应,引起收缩、组织水肿、渗出等[10]。该研究结果显示常温组与干热组COX-2 mRNA表达量休克后各时间点均高于对照组(P<0.05),干热组休克后各时间点均高于常温组,干热组最大值(3.46±0.19)出现在1.5h早于常温组最大值(2.13±0.13) 出现(常温组最大值出现在2h),组内休克后各时间点比较存在明显差异(P<0.05),相关性分析发现COX-2 mRNA表达量与肺损伤评分呈正相关,相关系数分别为R干热=0.706、R常温=0.761(P<0.05)。可见沙漠干热环境中创伤失血性休克大鼠发生继发性肺损伤较严重,损伤出现较早,可能是机体缺血、缺氧等因素使COX-2 mRNA的表达升高,肺组织TAX2/PGI2平衡失调,导致肺组织血管收缩,微血管通透性增加、微循环障碍等导致肺水肿,同时肺组织中性粒细胞扣押、聚集亦可诱导COX-2 mRNA高表达。另外最重要的可能是沙漠干热环境中高气温、干燥等因素促使肠道细菌转移、内毒素休克提前出现时,可刺激COX-2 mRNA表达量增加,产生大量PGs和ROS等进而形成恶性循环,进一步加重对肺脏损伤。
同时最新研究发现LPS直接刺激成纤维细胞表达COX-2和PGE2,而Resolvin D1可通过减少COX-2的表达,对脂多糖(LPS)诱导的急性肺损伤起保护作用[11-12]。机械通气所致肺损伤时,可通过抑制COX-2使炎症介质产生减少和水通道蛋白(AQP1)下调保护肺脏[13]。沙漠干热环境创伤失血性休克大鼠继发性肺损伤时,其主要特点是损伤较严重,损伤出现较早,因而COX-2可能成为沙漠干热环境创伤失血性休克药物干预治疗的有效靶点,如何及时有效地通过阻断COX-2途径,防止肺损伤的进一步加重,有待进一步研究。
参考文献:
[1] Briel M,Meade M,Mercat A,et al.Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and meta-analysis[J].JAMA,2010,303(9):865-873.
[2] 孙英刚,黄宗海,冯浩淼,等.创伤性休克大鼠模型的建立[J].解放军医学杂志,2002,27(12):1086-1087.
[3] Jellestad L,Fink T,Pradarutti S,et al.Inhibition of glycogen synthase kinase (GSK)-3-beta improves liver microcirculation and hepatocellular function after hemorrhagic shock[J].Eur J Pharmacol,2014,742:175-184.
[4] Mikawa K,Nishina K,Takao Y,et al.ONO-1714,a nitric oxide synthase inhibitor, attenuates endotoxin-induced acute lung injury in rabbits[J].Anesth Analg,2003,97(6):1751-1755.
[5] 张素品,张加艳,于泳浩,等.七氟烷后处理对大鼠肺缺血再灌注损伤的影响[J].中华麻醉学杂志,2009,29(8):753-756.
[6] Fan J.TLR Cross-talk mechanism of hemorrhagic shock-primed poulmonary neutrophil infiltration[J].Open Crit Care Med J,2010,(2):1-8.
[7] Erickson SE,Martin GS,Davis JL,et al.Recent trends in acute lung injury mortality: 1996-2005[J].Crit Care Med,2009,37(5):1574-1579.
[8] Lange M,Szabo C,Traber DL,et al.Time profile of oxidative stress and neutrophil activation in ovine acute lung injury and sepsis[J].Shock,2012,37(5):468-472.
[9] Li F,Liu Y,Chen H,et al.EGFR and COX-2 protein expression in non-small cell lung cancer and the correlation with clinical features[J].J Exp Clin Cancer Res,2011,(30):27.
[10] Wu CY,Chi PL,Hsieh HL,et al.TLR4-dependent induction of vascular adhesion molecule-1 in rheumatoid arthritis synovial fibroblasts: roles of cytosolic phospholipase A(2)alpha/cyclooxygenase-2[J].J Cell Physiol,2010,223(2):480-491.
[11] Wang B,Gong X,Wan JY,et al.Resolvin D1 protects mice from LPS-induced acute lung injury[J].Pulm Pharmacol Ther,2011,24(4):434-441.
[12] Selige J,Tenor H,Hatzelmann A,et al.Cytokine-dependent balance of mitogenic effects in primary human lung fibroblasts related to cyclic AMP signaling and phosphodiesterase 4 inhibition[J].J Cell Physiol,2010,223(2):317-326.
[13] Jin LD,Wang LR,Wu LQ,et al.Effects of COX-2 inhibitor on ventilator-induced lung injury in rats[J].Int Immunopharmacol,2013,16(2):288-295.
