含氟吡咯、吡咯烷液晶分子的合成与性能研究
2014-08-16李惠娟刘培炼陈虹任
李惠娟,刘培炼,陈虹任,张 弘,曾 卓
(华南师范大学化学与环境学院,广州510006)
液晶材料具有广泛的应用,现已成为备受关注的新型材料[1-4].建立液晶理论模型并采用可行的合成方法去寻找低熔点、高清亮点的液晶单体化合物、尽可能降低液晶材料的粘度和增大液晶材料的介电各向异性(Δε)成为液晶材料研究的目标[5-9].在液晶分子中引入氟原子会使液晶材料具有黏度低、电阻率高、响应速度快、脂溶性好、优良的化学稳定性等优点,使得含氟液晶广泛应用于薄膜晶体管液晶显示器(TFT-LCD)[10].但含氟液晶目前仍然存在相变区间窄,清亮点较低等问题[11].为了拓宽液晶分子的介晶相范围和提高清亮点,人们常在其结构中引入多环作为刚性结构[12-14],多数液晶分子含有苯环结构,在分子末端苯环的3,4位或者3,4,5位引入氟原子可以提高液晶材料的介电各向异性[15-17],然而此类化合物的介电各向异性(Δε)仍然相对较小,器件仍需较大的阈值电压,降低了液晶材料的性能.
为了解决上述问题,本课题组选择含氟氮杂五元环(吡咯,吡咯烷)作为液晶结构刚性基元,吡咯、吡咯烷是富电子的五元杂环,其电子流动性大,具有独特的光学性质和电子传输能力,且其衍生物的熔点较低,同时这些含氟吡咯和吡咯烷分子中含有供电子的氮原子和多个强极化的C—F键,这些特性能提高液晶单体材料的清亮点和介电常数,本文设计并合成了吡咯烷、3,3,4,4-四氟吡咯烷、3,4-二氟吡咯3个系列五元氮杂环含氟液晶,期待这些杂环制成的含氟液晶材料拥有宽介晶相范围、高清亮点、较大的介电常数等良好的液晶性能.
1 实验方法
1.1 目标化合物的合成路线
目标化合物吡咯烷、3,3,4,4-四氟吡咯烷、3,4-二氟吡咯含氟液晶化合物的合成路线如图1所示.
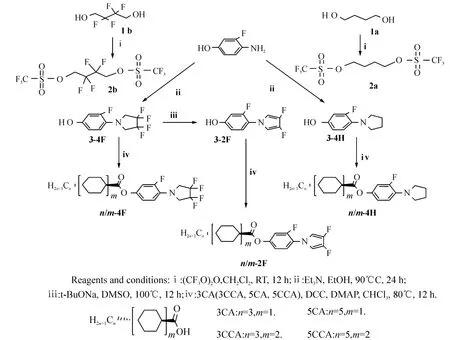
图1 化合物n/m-4F、n/m-2F、n/m-4H的合成路线Figure 1 Synthesis of fluorinated compounds n/m-4F,n/m-2F,n/m-4H
1.2 中间体化合物(2a,2b,3-4H,3-4F,3-2F)的合成
1.2.1 三氟甲磺酸 2,2,3,3-四氟-1,4-丁二酯(2b)的合成 将 2,2,3,3-四氟-1,4-丁二醇(1 mmol)、吡啶(3 mmol)加入装有20 mL CH2Cl2的圆底烧瓶中,在0℃下,缓慢滴入三氟甲磺酸(2.5 mmol)直至滴加完毕.反应12 h后加入20 mL CH2Cl2,用20 mL水洗涤3次,无水 Na2SO4干燥.减压蒸发除去CH2Cl2,得到白色固体.
目标化合物2a的合成步骤同化合物2b.
1.2.2 3-氟-4-吡咯烷苯酚(C10H12FNO)(3-4H)的合成 将4-氨基-3-氟苯酚(1 mmol)、三氟甲磺酸1,4-丁二酯(1 mmol)、三乙胺(3 mmol)加入装有3 mL乙醇的圆底烧瓶中,装上冷凝管并加热回流24 h,薄层层析(TLC)跟踪,反应完全.减压蒸发除去有机溶剂,加入20 mL CH2Cl2后用20 ml水洗涤3次,无水Na2SO4干燥.减压蒸发除去CH2Cl2,通过柱层析方法分离提纯物质[48~75μm硅胶,洗脱剂:V(乙酸乙酯)∶V(石油醚)=1∶5].真空干燥后得红色固体 135.9 mg(0.75 mmol),产率 75%.
1.2.3 3-氟-4-(3,3,4,4-四氟吡咯烷)苯酚(3-4F)的合成 目标化合物3-4F的合成步骤同化合物3-4H,通过柱层析方法分离提纯物质[48~75μm硅胶,洗脱剂:CH2Cl2].真空干燥后得红褐色固体177.5 mg(0.70 mmol),产率 70%.
1.2.4 3-氟-4-(3,4-二氟吡咯)苯酚(3-2F)的合成
将 3-氟-4-(3,3,4,4-四氟吡咯烷)苯酚(1 mmol)、叔丁醇纳(4 mmol)加入装有3 mL DMSO的圆底烧瓶中,100℃搅拌24 h,薄层层析(TLC)跟踪,反应完全.加入20 mL CH2Cl2后用水洗涤(20 mL×3),无水Na2SO4干燥.减压蒸发除去CH2Cl2,通过柱层析方法分离提纯物质[48~75μm硅胶,洗脱剂:CH2Cl2].真空干燥后得米黄色固体 174.7 mg(0.82 mmol),产率 82%.
1.3 目标化合物n/m-4H、n/m-4F及 n/m-2F的合成
以化合物3/1-4H为例:将3-氟-4-吡咯烷苯酚(1 mmol)、反式-4-正丙基环己烷羧酸(1.2 mmol)、N,N'-二环己基碳二亚胺(1.2 mmol)、4-二甲氨基吡啶(0.2 mmol)加入装有3 mL三氯甲烷的圆底烧瓶中,回流24 h,薄层层析(TLC)跟踪,反应完全.减压蒸发除去有机溶剂,通过柱层析方法分离提纯粗产物[48~75μm硅胶,洗脱剂:V(二氯甲烷)∶V(石油醚)=1∶3].真空干燥后得白色固体,产率85%.
其它目标化合物n/m-4H、n/m-4F及n/m-2F的合成步骤同化合物3/1-4H,产率为83% ~88%.化合物n/m-4H的洗脱剂与3/1-4H相同;n/m-4F和n/m-2F的洗脱剂为:V(二氯甲烷)∶V(石油醚)=1∶5.
1.4 化合物的介晶性、热稳定性检测
采用差示扫描量热分析仪(DSC)、偏光显微镜(POM)及X射线粉末衍射仪(XRD)分析检测了这些化合物的介晶性能,并利用热重分析(TGA)检测它们的热稳定性,热重分析仪(TGA)的型号为德国的Netzsch STA409PC,升温速率为10℃/min.差示扫描量热仪(DSC)的型号为Netzsch DSC200PC,扫描速率为10℃/min.带热台(HCS601)的偏光显微镜(POM)的型号为Nikon LINKAM-THMSE600.采用粉末X光衍射仪(XRD)对部分典型目标化合物的介晶相态进行了确认,X射线粉末衍射仪(XRD)的型号为 Bruker D8 Advance,使用 Cu靶,波长为0.154 nm的α1射线,升温速率为10℃/min.
2 结果与讨论
2.1 合成的目标化合物结构分析
所有化合物在国内外均未见报道,其结构由核磁共振氢谱、核磁共振氟谱、质谱、元素分析得到确认,数据如下:
3-氟-4-吡咯烷苯酚 (C10H12FNO)(3-4H):1H NMR(CDCl3,400 MHz)δ:6.61(s,3H),4.90(s,1H),3.25(s,4H),1.94(s,4H).19F NMR(376 MHz,CDCl3)δ-122.45(s,1F).MS(ESI)m/z:180.61(M+).Anal.calcd for C10H12FNO.0.8H2O:C 61.40,H 7.01,N 7.16;found C 61.41,H 6.99,N 7.11.
3-氟-4-(3,3,4,4-四氟吡咯烷)苯酚(3-4F):1H NMR(CDCl3,400 MHz)δ:6.79 ~ 6.47(m,3H),4.87(d,J=11.3 Hz,1H),3.76(s,4H).19F NMR(376 MHz,CDCl3)δ-121.02 ~ -121.22(m,4F), -122.50(s,1F).MS(ESI)m/z:252.61(M+). Anal. calcd for C10H8F5NO:C 47.44,H 3.11,N 5.53;found C 47.54,H 3.30,N 5.42.
3-氟-4-(3,4-二氟吡咯)苯酚(3-2F):1H NMR(CDCl3,400 MHz)δ:7.14(s,1H),6.68(d,J=22.1 Hz,2H),6.56(s,2H),5.18(s,1H).19FNMR(376 MHz,CDCl3)δ-123.28(t,J=10.3 Hz,1F), -178.76(s,2F).MS(ESI)m/z:212.79(M+).Anal.calcd for C10H6F3NO:C 56.35,H 2.84,N 6.57;found C 56.27,H 2.99,N 6.48.
反式-4-正丙基环己烷羧酸3'-氟-4'-(吡咯烷)苯基酯(3/1-4H):1H NMR(CDCl3,400 MHz)δ:6.81 ~ 6.56(m,3H),3.35(s,4H),2.43(s,1H),2.10(d,J=12.9 Hz,2H),2.00 ~1.81(m,6H),1.54(d,J=25.0 Hz,3H),1.26(d,J=50.2 Hz,5H),0.93(d,J=35.3 Hz,4H).19F NMR(376 MHz,CDCl3)δ-124.52(s,1F).MS(ESI)m/z:334.42(M+).Anal.calcd for C20H28FNO2:C 72.04,H 8.46,N 4.20;found C 72.06,H 8.52,N 4.08.
反式-4-正戊基环己烷羧酸3'-氟-4'-(吡咯烷)苯基酯(5/1-4H):1H NMR(CDCl3,400 MHz)δ:6.69(t,J=23.9 Hz,3H),3.34(s,4H),2.42(s,1H),2.08(s,2H),1.89(d,J=40.1 Hz,6H),1.52(d,J=12.9 Hz,3H),1.26(s,9H),0.93(d,J=34.8 Hz,4H).19F NMR(376 MHz,CDCl3) δ -124.54(s,1F).MS(ESI)m/z:362.47(M+).Anal.calcd for C22H32FNO2:C 73.10,H 8.92,N 3.87;Found C 73.16,H 9.00,N 3.78.
反式-4-(反式-4-正丙基环己基)环己烷羧酸3'-氟-4'-(吡咯烷)苯基酯(3/2-4H):1H NMR(CDCl3,400 MHz)δ:6.72(d,J=22.4 Hz,2H),6.63(d,J=9.4 Hz,1H),3.34(d,J=2.3 Hz,4H),2.40(d,J=12.2 Hz,1H),2.12(d,J=12.4 Hz,2H),1.93(t,J=6.6 Hz,4H),1.87 ~1.67(m,6H),1.51(d,J=26.6 Hz,2H),1.35~1.24(m,2H),1.18 ~0.92(m,10H),0.90 ~0.78(m,4H).19F NMR(376 MHz,CDCl3)δ-124.53(s,1F).MS(ESI)m/z:416.62(M+).Anal.calcd for C26H38FNO2:C 75.14,H 9.22,N 3.37;found C 75.12,H 9.22,N 3.25.
反式-4-(反式-4-正戊基环己基)环己烷羧酸3'-氟-4'-(吡咯烷)苯基酯(5/2-4H):1H NMR(CDCl3,400 MHz)δ:6.81 ~6.56(m,3H),3.35(s,4H),2.41(t,J=12.2 Hz,1H),2.13(d,J=13.2 Hz,2H),1.94(s,4H),1.80(d,J=32.4Hz,7H),1.53(d,J=27.7 Hz,3H),1.34 ~0.78(m,18H).19F NMR(376 MHz,CDCl3)δ-124.54(s,1F).MS(ESI)m/z:444.63(M+).Anal.calcd for C28H42FNO2:C 75.81,H 9.54,N 3.16;found C 75.77,H 9.54,N 3.02.
反式-4-正丙基环己烷羧酸 3'-氟-4'-(3,3,4,4-四氟吡咯烷)苯基酯(3/1-4F):1H NMR(CDCl3,400 MHz)δ:6.82(d,J=20.7 Hz,2H),6.60(t,J=9.0 Hz,1H),3.85(t,J=11.9 Hz,4H),2.43(t,J=12.2 Hz,1H),2.09(d,J=12.6 Hz,2H),1.86(d,J=13.0 Hz,2H),1.52(d,J=24.2 Hz,3H),1.38 ~1.14(m,5H),0.93(d,J=14.4 Hz,4H).19F NMR(376 MHz,CDCl3)δ-122.26 ~-122.40(m,4F), -123.94(t,J=11.5 Hz,1F).MS(ESI)m/z:406.62(M+).Anal.calcd for C20H24F5NO2:C 59.25,H 5.97,N 3.46;found C 59.38,H 5.90,N 3.36.
反式-4-正戊基环己烷羧酸 3'-氟-4'-(3,3,4,4-四氟吡咯烷)苯基酯(5/1-4F):1H NMR(CDCl3,400 MHz)δ:6.83(d,J=20.5Hz,2H),6.60(t,J=8.5 Hz,1H),3.86(t,J=11.3 Hz,4H),2.45(d,J=11.7 Hz,1H),2.10(d,J=12.4 Hz,2H),1.87(d,J=12.6 Hz,2H),1.52(d,J=24.9 Hz,2H),1.24(d,J=21.4 Hz,9H),1.03 ~0.81(m,5H).19F NMR(376 MHz,CDCl3)δ-122.34(t,J=11.9 Hz,4F),-123.95(t,J=11.1 Hz,1F).MS(ESI)m/z:457.04(M++Na+).Anal.calcd for C22H28F5NO2:C 60.96,H 6.51,N 3.23;found C 60.61,H 6.55,N 3.12.
反式-4-(反式-4-正丙基环己基)环己烷羧酸3'-氟-4'-(3,3,4,4-四氟吡咯烷)苯基酯(3/2-4F):1H NMR(CDCl3,400 MHz)δ:6.89 ~ 6.75(m,2H),6.60(s,1H),3.86(s,4H),2.42(s,1H),2.12(d,J=11.7 Hz,2H),1.76(d,J=37.8 Hz,8H),1.59 ~1.44(m,3H),1.34 ~0.76(m,13H).19F NMR(376 MHz, CDCl3) δ-122.33(d,J=13.9Hz,4F),-123.94(t,J=10.8 Hz,1F).MS(ESI)m/z:486.32(M+).Anal.calcd for C26H34F5NO2:C 64.05,H 7.03,N 2.87;found C 64.17,H 7.09,N 2.74.
反式-4-(反式-4-正戊基环己基)环己烷羧酸3'-氟-4'-(3,3,4,4-四氟吡咯烷)苯基酯(5/2-4F):1H NMR(CDCl3,400 MHz)δ:6.90 ~ 6.74(m,2H),6.60(t,J=7.2 Hz,1H),3.86(s,4H),2.42(s,1H),2.12(d,J=12.2 Hz,2H),1.90 ~1.63(m,6H),1.60 ~1.42(m,2H),1.35 ~0.75(m,20H).19FNMR(376 MHz,CDCl3)δ-122.33(d,J=13.9 Hz,4F),-123.94(t,J=10.7 Hz,1F).MS(ESI)m/z:539.47(M++Na+).Anal.calcd for C28H38F5NO2:C 65.23,H 7.43,N 2.72;found C 65.36,H 7.45,N 2.59.
反式-4-正丙基环己烷羧酸3'-氟-4'-(3,4-二氟吡咯)苯基酯(3/1-2F):1H NMR(CDCl3,400 MHz)δ:7.25(s,1H),6.98(d,J=26.5 Hz,2H),6.64(s,2H),2.48(s,1H),2.11(s,2H),1.87(s,2H),1.56(s,4H),1.27(d,J=48.3 Hz,4H),0.95(d,J=41.0 Hz,4H).19F NMR(376 MHz,CDCl3)δ -122.94(t,J=10.1 Hz,1F),-177.88(s,2F).MS(ESI)m/z:388.16(M++ Na+). Anal. calcd for C20H22F3NO2.0.1H2O:C 65.42,H 6.09,N 3.81;found C 65.17,H 6.05,N 3.69.
反式-4-正戊基环己烷羧酸3'-氟-4'-(3,4-二氟吡咯)苯基酯(5/1-2F):1H NMR(CDCl3,400 MHz)δ:7.24(s,1H),6.97(d,J=26.4 Hz,2H),6.64(s,2H),2.48(s,1H),2.12(d,J=12.2 Hz,2H),1.89(d,J=12.6 Hz,2H),1.58(s,4H),1.26(d,J=21.5 Hz,8H),0.95(d,J=42.3 Hz,4H).19F NMR(376 MHz,CDCl3)δ-122.94(t,J=10.0 Hz,1F), -177.88(s,2F).MS(ESI)m/z:433.97(M++K+).Anal.calcd for C22H26F3NO2:C 67.16,H 6.66,N 3.56;found C 67.29,H 6.73,N 3.47.
反式-4-(反式-4-正丙基环己基)环己烷羧酸3'-氟-4'-(3,4-二氟吡咯)苯基酯(3/2-2F):1H NMR(CDCl3,400 MHz)δ:7.22(s,1H),6.97(d,J=26.4 Hz,2H),6.64(s,2H),2.46(s,1H),2.15(d,J=12.1 Hz,2H),1.91 ~1.65(m,6H),1.53(d,J=16.8 Hz,4H),1.31(s,2H),1.20 ~0.78(m,12H).19F NMR(376 MHz, CDCl3) δ-122.95(t,J=9.9 Hz,1F),-177.89(s,2F).MS(ESI)m/z:486.67(M++K+).Anal.calcd for C26H32F3NO2:C 69.78,H 7.21,N 3.13;found:C 69.85,H 7.30,N 3.30.
反式-4-(反式-4-正戊基环己基)环己烷羧酸3'-氟-4'-(3,4-二氟吡咯)苯基酯(5/2-2F):1H NMR(CDCl3,400 MHz)δ:7.22(s,1H),6.97(d,J=26.7 Hz,2H),6.64(s,2H),2.47(s,1H),2.15(d,J=12.3 Hz,2H),1.92 ~1.65(m,6H),1.56(s,4H),1.35 ~ 0.78(m,18H).19F NMR(376 MHz,CDCl3)δ-122.95(t,J=10.4 Hz,1F),-177.88(d,J=3.8 Hz,2F).MS(ESI)m/z:475.13(M+).Anal.calcd for C28H36F3NO2:C 70.71,H 7.63,N 2.95;found C 70.90,H 7.78,N 2.80.
2.2 目标新分子的介晶性
由表1可知,合成的目标化合物的液晶性能主要受3方面影响:(1)氮杂环结构;(2)末端烷基链长短;(3)环己基液晶砌块类型.
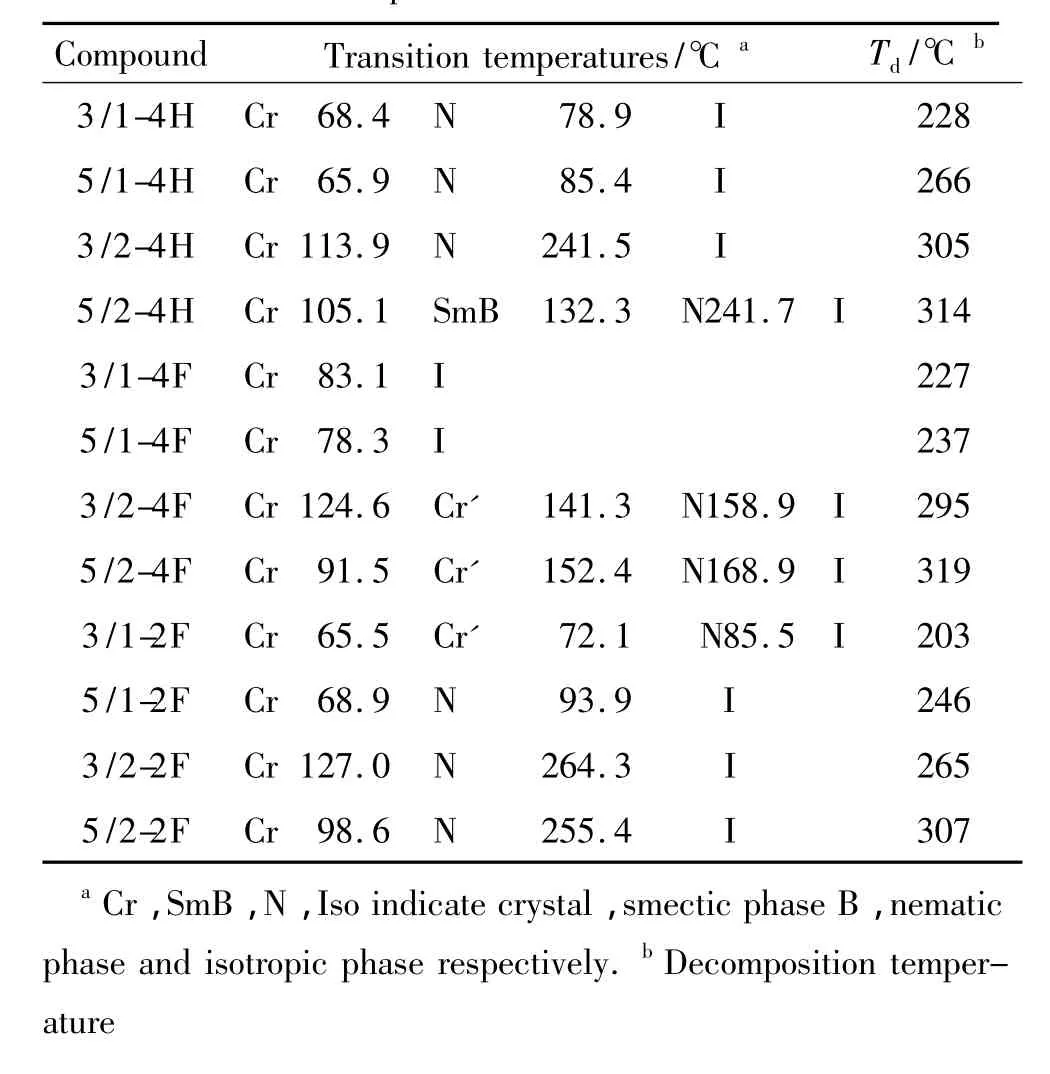
表1 新分子的介晶性与热稳定性Table 1 Liquid crystalline properties and thermal stability of the new compounds
通过在液晶分子的末端引入不同的氮杂环,发现不同类型的氮杂环对液晶相的形成有着重要的影响.当分子末端取代基为3,4-二氟吡咯时(n/m-2F),更有利于液晶相的形成和稳定,同时这些液晶新分子呈现出向列相并且具有最宽的液晶相范围.其中5/2-2F的向列相温度范围宽达156.8℃,3/2-2F的向列相温度范围达到137.3℃.在n/m-2F系列化合物中,化合物3/1-2F在65.5~72.1℃存在着晶相之间的转变,同时在这个温度范围内POM未观察到液晶相的形成.研究结果表明吡咯烷端基对液晶相的形成和稳定也有较大的贡献,其作用仅次于3,4-二氟吡咯端基,除化合物5/2-4H在105.1℃至132.3℃呈SmB相外,其它化合物(n/m-4H)都呈现为向列相.这一系列化合物也有相对较宽的液晶相范围,3/2-4H的向列相温度范围宽达127.6℃,5/2-4H的向列相温度范围宽达109.4℃.在3个系列化合物中,以3,3,4,4-四氟吡咯烷基作为末端取代基的化合物(n/m-4F),其液晶相温度范围是最窄.这是由于3,3,4,4-四氟吡咯烷基为扭曲折叠的信封构型以及存在相对较多的高极性C—F键,不利于分子的定向排列,抑制了液晶相的形成,所以在化合物3/1-4F和5/1-4F中没有观察到任何液晶相行为.化合物3/2-4F和5/2-4F都存在着晶相之间的转变,而且它们的向列相温度范围较窄,约18℃.
为了进一步确认这3个系列化合物的液晶相类型,利用变温粉末X光衍射技术对部分典型化合物5/2-4H、5/2-4F和5/2-2F的液晶相结构进行了研究(图2).在小角区2θ=3.3°,呈现出一个尖锐的小衍射峰,所对应分子内层与层的间距 d值为2.674 nm.其广角区2θ=17.94°,出现一个尖锐的衍射峰,对应的间距d值为0.494 nm,说明在此温度下,5/2-4H分子中存在层状结构.结合此温度下呈现出的板块液晶织构(图3),说明5/2-4H在115.0℃形成的液晶相为近晶B相.继续加热至145.0℃,其XRD衍射图(图4)仅在广角区观察到一个宽的弥散衍射峰,说明在该温度并没有形成层状的近晶相结构.结合此温度下的纹影液晶织构(图5),可以确定5/2-4H在145.0℃的液晶相为向列相.综合分析化合物5/2-4H的 DSC、POM及XRD数据,该化合物在105.1~132.3℃呈SmB相,在132.3~241.7℃呈向列相.对于化合物5/2-4F和5/2-2F,它们的XRD衍射图都仅在广角区出现宽的弥散衍射峰,而在小角范围内没有观察到衍射峰,结合偏光显微镜的丝状纹影织构,可判断出它们分别在152.4~168.9 ℃和98.6 ~255.4 ℃呈现向列相.
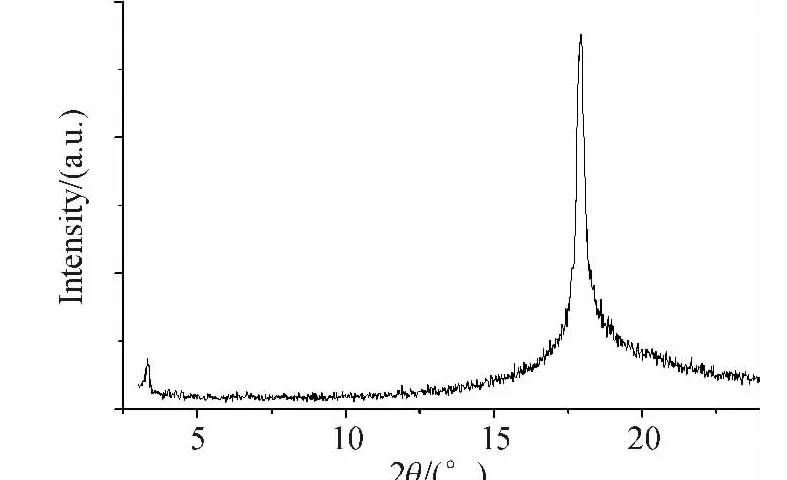
图2 化合物5/2-4H在115℃的XRD衍射图Figure 2 XRD diffraction pattern for 5/2-4H recorded at115℃

图3 化合物5/2-4H在115℃的POM图Figure 3 POM texture for 5/2-4H at115℃
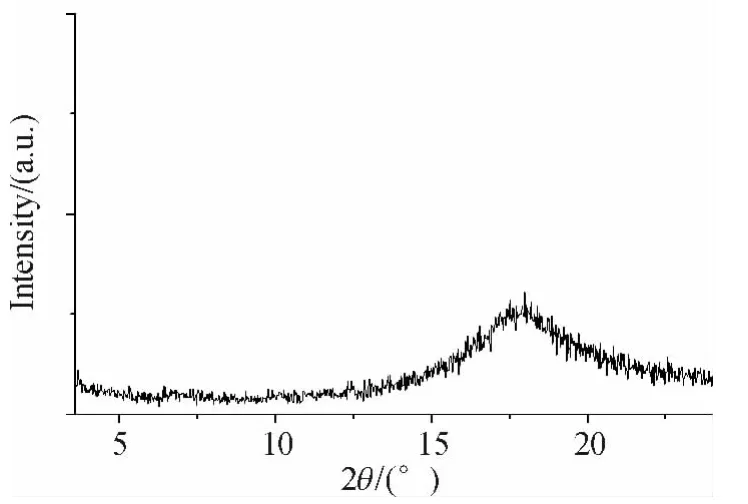
图4 化合物5/2-4H在145℃的XRD衍射图Figure 4 XRD diffraction pattern for 5/2-4H recorded at145℃

图5 化合物5/2-4H在145℃的POM图Figure 5 POM texture for 5/2-4H at145℃
末端烷基链的长短对化合物的液晶相行为也有重要的影响.刚性基元完全相同的液晶分子,其熔点随着末端烷基链的增长而降低,因为随着末端烷基链的增长,分子的极性有所下降,导致紧密堆积程度下降,使得熔点降低.在这3个系列化合物中,对于大部分化合物当分子末端的正丙基换成正戊基时,熔点都有一定程度的下降,但是对于化合物3/2-4F和5/2-4F则呈现相反的变化,它们的熔点分别为141.3℃和152.4℃,这主要是由于分子中同时存在较大立体位阻的3,3,4,4-四氟吡咯烷以及双环己烷,从而使得分子间距加大,具有末端正戊基取代的分子反而排列更紧密.
环己基液晶砌块的类型对液晶相也有重要的影响.含双环己基的液晶分子比含单环己基的液晶分子具有更宽的液晶相范围和更高的清亮点.这是因为双环己基的液晶分子具有更大的长宽比,能够有效地增加分子的轴向长度,从而更有利于液晶相的形成和稳定.在3个系列的液晶化合物中,含单环己基的液晶分子,其液晶相范围都没有超过25℃,而含双环己基的液晶分子都具有相对较宽的液晶相温度范围,其中化合物 5/2-2F、3/2-2F、3/2-4H、5/2-4H 的向列相温度范围分别为 156.8、137.3、127.6、109.4℃.此外,环己基的反式结构几何排列协调,相互交错重叠,形成紧密堆积,分子极性增大,表现出较高的清亮点,双环己基液晶砌块存在2个反式几何构型,具有更紧密的堆积,故呈现更高的清亮点.在本文中,含单环己基的液晶分子的清亮点都没有超过95℃,而含双环己基的液晶分子的清亮点最高可达到264.3℃.
总体而言,氮杂环结构,末端烷基链长短,环己基液晶砌块的类型共同作用影响了液晶相的形成和稳定,结果表明:当分子同时含双环己基液晶砌块和3,4-二氟吡咯端基时,能获得最宽的介晶相范围和高清亮点的向列相含氟酯类液晶新分子.
2.3 目标新分子的热稳定性
通常作为显示用的液晶材料要求具有良好的热稳定性.本文对所有液晶化合物进行热重量分析,结果见表1,12种合成的目标化合物的分解温度全都大于其清亮点,表明这些新分子在介晶相范围内是热稳定的.
3 结论
为了发展新型的、具有吡咯骨架的含氟液晶,扩大吡咯及其衍生物作为功能性有机材料的应用,设计并合成了以吡咯烷、3,3,4,4-四氟吡咯烷、3,4-二氟吡咯作为液晶分子末端基团的吡咯衍生物.研究的结果发现:相对末端为 3,3,4,4-四氟吡咯烷(n/m-4F)的分子,末端为吡咯烷(n/m-4H)或3,4-二氟吡咯的分子(n/m-2F)更有利于液晶相的形成和稳定,它们都具有较宽的液晶相范围.末端为3,4-二氟吡咯基的分子(n/m-2F)相对末端为吡咯烷的分子(n/m-4H)具有更高的清亮点和更宽的介晶相范围.当分子同时含双环己基液晶砌块和3,4-二氟吡咯端基时,就能获得宽的介晶相范围和高清亮点的向列相液晶分子.其中化合物5/2-2F的向列相温度范围宽达156.8℃,清亮点高达255.4℃.由于3,3,4,4-四氟吡咯烷为扭曲折叠的信封构型,从而不利于分子的定向排列,进而不利于液晶相的形成,故设计液晶分子时,不考虑以3,3,4,4-四氟吡咯烷作为分子的末端刚性环.研究还发现,选择不同的液晶结构单元可以显著改变液晶分子的熔点、清亮点及介晶相范围,同时增加含氟取代基团和调节分子末端烷基链的长短,有效地改善了这些液晶分子的物理性质和化学性质,部分液晶分子具有高清亮点及宽的向列相范围,它们可作为混合液晶中的高清亮点组分及提高工作温度范围的组分,这些结果为进一步开发及应用高性能液晶材料打下基础.
[1]Yamane S,Sagara Y,Mutai T,et al.Mechanochromic luminescent liquid crystals based on a bianthryl moiety[J].Journal of Materials Chemistry,2013,1(15):2648-2656.
[2]Bubnov A,Kaspar M,Hamplova V,et al.The rmotropic and lyotropic behaviour of new liquid-crystalline materials with differenthydrophilic groups:Synthesis andmesomorphic properties[J].Journal of Organic Chemistry,2013,9:425-436.
[3]Uklein A V,Vasko A A,Ouskova A A,etal.Nonlinear optical properties of new photosensitive smart materials based on nematic liquid crystal with H-bonded dye-polymer complex[J].Optics Communication,2013,296:79-83.
[4]Manickam M,Iqbal P,Belloni M,et al.A brief review of carbazole-based photorefractive liquid crystalline materials[J].Israel Journal of Chemistry,2012,52(10):917-934.
[5]Xu M,Yang D K.Dual frequency cholesteric light shutters[J].Applied Physics Letters,1997,70(6):720-722.
[6]Takahashi T,Saito S,Akahane T.Electrooptical properties of vertically aligned twisted nematic cells with negative dielectric anisotropy[J].Japanese Journal of Applied Physics,1997,36:3531-3536.
[7]Lee SH,Kim H Y,Park IC.Rubbing-free,vertically aligned nematic liquid crystal display controlled by inplane field[J].Applied Physics Letters,1997,71(19):2851-2853.
[8]Lee SH,Kim H Y,Park IC,et al.Dual domainlike,vertically aligned nematic liquid crystal display driven by in-plane field[J].IEICE Transactions on Electronics,1998,81(11):1681-1684.
[9]丁时进.液晶模型的分析理论[J].华南师范大学学报:自然科学版,2013,45(3):1-7.Ding SJ.The analytical theory of the liquid crystalmodel[J].Journal of South China Normal University:Natural Science Edition,2013,45(3):1-7.
[10]Takatsu H.Development and industrialization of liquid crystal materials[J].Molecular Crystal Liquid Crystals,2006,458(1):17-26.
[11]才勇,黄锡珉.显示用液晶材料[J].液晶与显示,1997,12(1):49-57.Cai Y,Huang X M.Liquid crystal used for display[J].Chinese Journal of Liquid Crystals and Displays,1997,12(1):49-57.
[12]李娟利,安忠维.侧向氟取代双烷基环己基联苯类液晶化合物的介晶性研究[J].液晶与显示,2006,21(3):214-217.Li JL,An ZW.The mesomorphism research of lateral fluorinated di-alkyl cyclohexyl biphenyl liquid crystal compounds[J].Chinese Journal of Liquid Crystals and Displays,2006,21(3):214-217.
[13]王浩,张蕾,梁晓.侧向二氟代酯类液晶的合成[J].精细化工,2006,23(6):524-526.Wang H,Zhang L,Liang X.The synthesis of the lateral di-fluorinated ester liquid crystal[J].Fine Chemicals,2006,23(6):524-526.
[14]Wu LH,Chu CS,Janarthanan N.Synthesis and characterization of ferroelectric side chain liquid crystal polymers bearing banana-shaped chiral mesogens[J].Journal of Polymer Research,2000,7(2):125-134.
[15]Goto Y,Ogawa T,Sawada S,et al.Fluorinated liquid crystals for activematrix displays[J].Molecular Crystals Liquid Crystals,1991,209(1):1-7.
[16]Demus D,Goto Y,Sawada S,etal.Trifluorinated liquid crystals for TFT displays[J].Molecular Crystal Liquid Crystals,1995,260(1):1-21.
[17]Greenfield S,Coates D,Gouldin G,et al.Nematogenic laterally fluorinated biphenyls with polar terminal groups[J].Liquid Crystals,1995,18(4):665-672.
