缺氧对星形胶质细胞DNA甲基化及组蛋白乙酰化相关酶的表达影响
2014-08-14杨清麟
杨清麟,李 良
(首都医科大学基础医学院病理学系,北京 100069)
星形胶质细胞是中枢神经系统(central nervous system,CNS)的主要支持成分,也是脑组织中最丰富的胶质细胞类型,具有调节脑内微环境和神经传递等重要功能,并为神经元提供营养物质和神经营养因子[1]。缺血低氧是机体常见的一种损伤因素,能量代谢的下降可引发一系列线粒体呼吸功能障碍,活性氧自由基产生过多,从而引起细胞的变性坏死。在缺氧等损伤因素刺激下,星形胶质细胞可发生活化反应,称为反应性星形胶质细胞(reactive astrocyte),主要表现为细胞增生、形态学改变以及相关蛋白的异常表达[2,3]。近些年来表观遗传学的研究成为热点,所谓表观遗传学是指在DNA序列未改变的基础上,基因功能发生可遗传的表型改变, DNA甲基化和组蛋白修饰是表观遗传学研究的主要内容之一。DNA甲基化是在DNA甲基转移酶(DNA methyltransferase,DNMT)的催化下,以S-腺苷甲硫氨酸为甲基供体,将甲基转移到胞嘧啶C第5位碳原子上的过程。目前认为,DNMTs家族成员至少包括DNMT1、DNMT2、DNMT3A和DNMT3B四个亚型[4]。甲基结合结构域蛋白2(methyl-binding domain 2, MBD2)则能发挥DNA去甲基转移酶的作用。组蛋白的乙酰化水平由组蛋白乙酰化转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)共同调节。多种具有HAT和HDAC活性的调节因子,通过对组蛋白乙酰化过程的调节,在基因表达调控中发挥着重要作用。其中CREB绑定蛋白(CREB-binding protein,CBP)就是一个常见的具有HAT活性的调节因子。缺血低氧损伤是否可以通过表观遗传学调控机制影响反应性星型胶质细胞蛋白的表达,关于这方面的研究少有报道。本研究采用原代培养的星形胶质细胞,观察缺氧处理对DNA甲基化和组蛋白乙酰化相关酶表达水平的影响。
1 材料和方法
1.1 材料
新生24 h内SPF级Sprague-Dawley(SD)雄性大鼠(来源于北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】),胎牛血清(杭州四季青),DMEM/F12培养基、DMEM培养基(Gibco公司),多聚赖氨酸(poly-L-Lysine,PLL)、核酸染料Hoechst 33258、碘化丙啶(propidium iodide, PI)(美国Sigma公司),兔抗DNMT1单克隆抗体、兔抗DNMT3A多克隆抗体、兔抗CBP单克隆抗体、兔抗HDAC3单克隆抗体(Cell Signaling公司),兔抗MBD2多克隆抗体(Santa Cruz公司),鼠抗β-actin单克隆抗体、HRP标记羊抗兔IgG抗体、HRP标记羊抗小鼠IgG抗体(北京中杉金桥生物技术有限公司),BCA蛋白定量试剂盒和ECL发光试剂盒(Pierce公司),GFAP、DAPI(碧云天生物技术研究所)。
1.2 方法
1.2.1 原代星形胶质细胞的培养:新生24 h内的SPF级SD大鼠,冷冻麻醉, 75%乙醇消毒,断头,取出两侧大脑半球置于冰的PBS中,在体视显微镜下剥离脑膜并分离出大脑皮质,剪碎后加入适量胰酶37℃消化5 min,终止消化后小心吹打,经200目筛网滤过, 将滤液离心5 min(1000 r/ min),弃上清,将用含10%胎牛血清DMEM/ F12培养基重悬后的悬液接种至培养瓶中,差速贴壁1 h后将上清离心5 min(1000 r/ min), 重悬后接种于用多聚赖氨酸预处理的培养瓶中。每2~3 d换液1次, 待第9~14天左右细胞长满后,固定于恒温摇床(37℃, 250 r /min)震荡18 h,舍弃含脱落细胞的细胞悬液,以去除少突胶质细胞和小胶质细胞,PBS清洗后消化传代,第三代细胞用细胞免疫荧光法标记神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)检测星形胶质细胞纯度在95%以上,可以使用。
1.2.2 缺氧处理:培养细胞分为对照组和缺氧模型组。缺氧模型组的细胞进行氧糖剥夺(oxygen-glucose deprivation,OGD)处理,将正常培养的星形胶质细胞弃掉原培养液,PBS冲洗两遍,加入5%胎牛血清,2.78 mmol/L葡萄糖的DMEM培养基后,放入37℃,2% O2,5% CO2,85%湿度条件下分别培养24 h,48 h和72 h。
1.2.3 Western blot检测:收集细胞后加入全细胞裂解液提取蛋白,13000 r/min, 离心10 min后取上清液,BCA法测定蛋白浓度并制备电泳蛋白样品,分别用8%或10% SDS-PAGE凝胶电泳分离蛋白质,电泳后将PAGE凝胶中的蛋白质电转移至硝酸纤维素膜上,用脱脂牛奶室温封闭1 h后分别加入一抗DNMT3A(1∶1000 ), DNMT1(1∶1000 ), MBD2(1∶200 ), CBP(1∶1000),HDAC3 (1∶1000 ),4℃过夜。TTBS冲洗后,加入辣根过氧化物酶标记的相应二抗,室温孵育1 h加入ECL发光试剂后在暗室曝光。所得X-线胶片用Gel-Doc凝胶成像系统扫描,应用ImageJ分析软件对各组条带进行半定量分析,计算各蛋白条带总吸光度A值与相应内参总吸光度A值的比值。
1.2.4 细胞活性测试:原代培养第三代的星形胶质细胞分别缺氧处理24 h,48 h,72 h后,吸去原培养基,PBS浸洗3次,加培养液和Hoechst染液(Hoechst 染液终浓度为5 μg/mL), 37℃, 5%CO2孵箱中孵育15 min后取出, PBS液洗涤3次, 加PBS液和PI染液((PI染液终浓度为10 μg/mL), 室温静置10 min, PBS洗涤,荧光显微镜下观察,照像,每个小皿在40倍视野下随机计数10个视野,每组计数4个小皿,计算死亡细胞百分比(细胞死亡率=死亡细胞数/所有细胞数*100%)。
1.3 统计学分析
2 结果
2.1 原代培养星形胶质细胞鉴定
培养星形胶质细胞经两次传代后,用小鼠抗GFAP(glial fibrillary acidic protein,胶质纤维酸性蛋白,被普遍认为是星形胶质细胞的标志物)的单克隆抗体进行细胞免疫荧光染色,经过鉴定证实为星形胶质细胞,阳性率达95%以上(彩插8图1)。
2.2 细胞活性检测
采用Hoechst33258/PI双染检测细胞活性,PI标记坏死的细胞(图2中红色荧光所示),Hoechst33258标记所有的细胞核(图2中蓝色荧光所示)。星形胶质细胞缺氧24 h后,对细胞活性没有明显影响,细胞死亡率仅从对照组的1.5%(彩插8图2A)增加到2.3%(彩插8图2B);细胞缺氧48 h后,细胞死亡率为4.7%(彩插8图2C),与对照组相比有统计学意义,证明这时缺氧对细胞造成了一定的损伤;细胞缺氧72 h后,细胞死亡率与对照组相比差异性显著,达到8.6%(彩插8图2D)。
2.3 DNA甲基化相关酶的表达
星形胶质细胞经缺氧处理48 h后,DNA甲基转移酶DNMT3A、DNMT1的表达分别比对照组增加了49%和83%,而去甲基转移酶MBD2的表达比对照组减少了36% (图3)。
2.4 组蛋白乙酰化相关酶的表达
星形胶质细胞经缺氧处理48 h后,组蛋白去乙酰化酶HDAC3的表达增高,为对照组的2.1倍,而组蛋白乙酰化酶的表达显著上升,增高至对照组的20倍(图4)。
3 讨论
越来越多的研究显示,缺血低氧性脑损伤可诱导星形胶质细胞异常蛋白的表达,在疾病发生发展过程中发挥重要的作用[5-8],那么表观遗传学机制是否参与蛋白表达的调控?本实验结果显示,原代培养的星形胶质细胞经缺氧处理48 h后,DNA甲基转移酶DNMT1和DNMT3A表达水平增高。 DNMT1是1955年Bestor等[9]从真核生物中克隆出来的第一个DNA甲基转移酶,它的主要作用是维持原有DNA 甲基化,这种维持作用可以将DNA甲基化信息传递给子代细胞, 并且在细胞分裂过程中起最主要的稳定维持甲基化状态的作用[10-11]。DNMT3又称从头甲基化酶,在未甲基化的基因组序列中催化CpG二核苷酸甲基化[12]。本实验中发现两种DNMT水平均有升高,提示缺氧不仅可以维持原有DNA甲基化水平,同时还可以诱导新位点发生甲基化。DNA甲基化的发生和甲基化程度的高低取决于DNMTs及去甲基转移酶的表达,本实验中星形胶质细胞缺氧后DNMT表达增高的同时DNA去甲基转移酶表达水平下降,提示缺氧可诱导星形胶质细胞DNA甲基化水平的增高。目前关于缺氧诱导星形胶质细胞DNA甲基化水平改变尚无报道,而关于其它细胞缺氧及脑组织缺氧后的DNA甲基化水平及相关酶的改变,研究结果报道也并不一致。Jae-Chul L等[13]对沙鼠进行脑缺血处理,发现DNMT1在海马CA1区的表达下降;Yoka A等[14]使用Hela细胞进行缺氧实验,显示DNA甲基转移酶和去甲基转移酶活性均没有改变,缺氧也未影响其全基因组甲基化水平;Ying W等[15]使用大鼠脑组织发现缺氧后DNA甲基化水平明显升高。此外,本课题组之前采用双侧颈总动脉结扎法(two-vessel occlusion, 2-VO)制备脑血流低灌注模型,发现缺血/低氧的大鼠脑组织早期(术后10 d,30 d)全基因组甲基化水平明显下降,而后期(术后90 d,180 d)又明显升高。
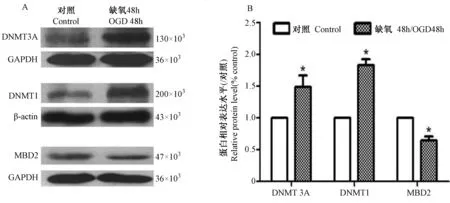
注:A为蛋白印迹图;B为蛋白表达量统计图;*示差异有统计学意义:P < 0.05。

注:A为蛋白印迹图;B为蛋白表达量统计图;*示差异有统计学意义P<0.05;**示统计学差异有显著性P<0.01。
缺氧对组蛋白乙酰化水平的影响也有一些相关报道,Annamaria L等[16]采用原代培养的小鼠大脑皮层神经元进行氧糖剥夺处理,发现组蛋白H3的乙酰化水平降低;Huaping S等[17]用原代培养的大鼠心肌细胞进行急性缺氧处理,发现HAT活性升高,而HDAC在急性缺氧1 h时明显活性升高,缺氧4 h后又比急性缺氧1 h时有所下降,组蛋白H3的乙酰化水平升高;Qin L等[18]使用细胞系进行缺氧处理后发现组蛋白H4的乙酰化水平也有所降低。本实验结果显示缺氧后HDAC表达虽有增高,但HAT的增高却更加明显。HAT通过在组蛋白N端赖氨酸残基引入乙酰基,使其乙酰化,激活转录基因从而促使基因表达,而HDAC则通过使组蛋白去乙酰化来抑制基因转录。组蛋白乙酰化和去乙酰化与基因的表达调控密切相关,HAT和HDAC之间的动态平衡控制着染色质的结构和基因的表达。本实验中HAT表达的增高是HDAC增高水平的将近10倍,可能促进某些基因的表达,在缺氧性脑损伤中发挥相应的作用。
本实验结果发现缺氧后星形胶质细胞DNA甲基化水平升高,组蛋白乙酰化水平也同时升高。DNA甲基化会抑制基因的表达,而组蛋白乙酰化可促进基因的表达,这两组结果看似矛盾。事实上基因组甲基化水平并不能够代表某个特殊基因甲基化水平,如老年人常表现有基因组的低甲基化,然而肿瘤病患者却有某些抑癌基因的高甲基化;同样组蛋白的修饰除乙酰化外,还有甲基化、泛素化、磷酸化等修饰方式综合调控基因的表达。因此,针对某一特定基因的表达,还应综合各方面因素全面考虑。
以上结果表明,缺氧可以影响星形胶质细胞DNA甲基化和组蛋白乙酰化相关酶的水平,并可能引起表观遗传学的改变,影响相关基因的表达,从而在缺血性脑损伤中发挥作用。
参考文献:
[1] Mehta SL, Manhas N, Raqhubir R. Molecular targets in cerebral ischemia for developing novel therapeutics [J]. Brain Res Rev, 2007, 54(1):34-66.
[2] Idaira O, Miriam F, Eduardo D,etal. Dopamine release regulation by astrocytes during cerebral ischemia [J]. Neurobiol Dis, 2013, 58: 231-241.
[3] Pekny M, Nilsson M. Astrocyte activation and reactive gliosis [J]. Glia, 2005, 50(4): 427-434.
[4] Cheng X, Blumenthal RM. Mammalian DNA methyltransferases: a structural perspective [J]. Structure, 2008, 16(3): 341-350.
[5] Nedergaard M, Dirnagl U. Role of glial cells in cerebral ischemia [J]. Glia, 2005, 50(4): 281-286.
[6] Xu M, Zhang H L. Death and survival of neuronal and astrocytic cells in ischemic brain injury: a role of autophagy [J]. Acta Pharmacol Sin, 2011, 32(9):1089-1099.
[7] Wang W, Redecker C,Yu ZY,etal. Rat focal cerebral ischemia induced astrocyte proliferation and delayed neuronal death are attenuated by cyclin-dependentkinase inhibition [J]. J Clin Neurosci, 2008, 15(3): 278-285.
[8] Huang Z, Liu J, Cheung PY,etal. Long-term cognitive impairment and myelination deficiency in a rat model of perinatal hypoxic-ischemic brain injury [J]. Brain Res, 2009, 1301: 100-109.
[9] Hermann A, Gowher H, Jeltsch A. Biochemistry and biology of mammalian DNA methyltransferases [J]. Cell Mol Life Sci, 2004, 61 (19-20):2571-2587.
[10] GoyaI R, Rathert P, Laser H,etal. PhosphoryIation of serine-515 activates the Mammalian maintenance methyltransferase Dnmt1 [J]. Epigenetics, 2007, 2 (3): 155-160.
[11] Valinluck V, Sowers LC. Endogenous cytosine damage products alter the site selectivity of human DNA maintenance methyltransferase DNMT1 [J]. Cancer Res, 2007, 67 (3):946-950.
[12] Ting AH, Jair KW , Suzuki H,etal. Mammalian DNA methyltransferasel: inspiration for new directions [J]. Cell Cycle, 2004 , 3 (8):1024-1026.
[13] Jae-Chul L, Joon HP, Bing CY,etal. Effects of Transient Cerebral Ischemia on the Expression of DNA Methyltransferase 1 in the Gerbil Hippocampal CA1 Region [J]. Neurochem Res, 2013, 38(1): 74-81.
[14] Yoko A, Kenichi N, Ikuo M,etal. The involvement of DNA and histone methylation in the repression of IL-1β-induced MCP-1 production by hypoxia [J]. Biochem Bioph Res Co, 2011, 414(1): 252-258.
[15] Ying W, Chang L, Qu LG,etal. Intrathecal 5-azacytidine inhibits global DNA methylation and methyl- CpG-binding protein 2 expression and alleviates neuropathic pain in rats following chronic constriction injury [J]. Brain Res, 2011, 1418: 64-69.
[16] Annamaria L, Giuseppe P, Caterina B,etal. Targeted acetylation of NF-kappaB/RelA and histones by epigenetic drugs reduces post-ischemic brain injury in mice with an extended therapeutic window [J]. Neurobiol Dis, 2013, 49: 177-189.
[17] Huaping S, Lei C, Huilan W,etal. Synergistic induction of miR-126 by hypoxia and HDAC inhibitors in cardiac myocytes [J]. Biochem Bioph Res Co, 2013, 430(2): 827-832.
[18] Qin L, Max C. c-Myc mediates a hypoxia-induced decrease in acetylated histone H4 [J]. Biochimie, 2009, 91(10): 1307-1310.
