吡咯类离子液体电解质性质对锂空气电池放电性能的影响
2014-08-10孙彦波黄彦芳段东红郝晓刚刘世斌
孙彦波,李 瑜,黄彦芳,段东红,郝晓刚,刘世斌
(太原理工大学 洁净化工研究所,太原 030024)
吡咯类离子液体电解质性质对锂空气电池放电性能的影响
孙彦波,李 瑜,黄彦芳,段东红,郝晓刚,刘世斌
(太原理工大学 洁净化工研究所,太原 030024)
利用循环伏安法、电池充放电装置等电化学手段,测试了所选离子液体N-甲基-N-丙基吡咯双三氟甲基磺酸基酰亚胺(PYR13TFSI)、N-甲基-N-丁基吡咯双三氟甲基磺酸基酰亚胺(PYR14TFSI)和N-甲基-N-甲氧乙基吡咯双三氟甲基磺酸基酰亚胺(PYR1(201)TFSI)的饱和氧溶解度、溶液电导率及氧电化学行为随锂盐浓度的变化。结果显示:室温离子液体的溶液电导率和氧扩散系数与锂盐质量摩尔浓度呈负相关,氧气溶解度随着锂盐质量摩尔浓度的增加呈现先降后升的“火山形”趋势;在0.6 mol/kg LiTFSI条件下,PYR1(201)TFSI离子液体的氧电还原反应活性较高,而PYR14TFSI离子液体的相对较低;PYR14TFSI, PYR1(201)TFSI和PYR13TFSI离子液体组成的锂空气电池的放电电容分别是1 068,1 084,1 249 mAh/g, PYR13TFSI离子液体的放电电压最高,明显高于有机电解液(EC、DMC、EMC体积比为1∶1∶1)锂空气电池的放电电容及电压。
离子液体;电导率;氧气溶解度;氧扩散系数;锂空气电池
金属锂是最轻和最电正性的金属,有着3 860 mAh/g的理论比容量[1]。锂空气电池在不携带氧气的情况下,其理论能量密度接近汽油11 140 W·h/kg的能量密度[2]。K. M. Abraham[3]在1996年首次报道了关于非质子化电解质的锂空气电池,由此引起全世界范围的科学工作者对锂空气电池的研究兴趣。
一般来说,锂空气电池由4部分构成:锂金属阳极,电解液,只允许Li+通过的隔膜,以及由催化剂、碳粉和粘结剂构成的空气阴极。目前,锂空气电池能量密度、功率密度、循环稳定性以及充放电效率与商业化的要求还存在着较大的差距。其中,空气电极的结构、电荷传递材料、催化剂材料的性能对电池性能具有重要影响。由于Li+和氧气主要通过催化剂层微孔内的电解质传递至催化活性物表面,经电化学反应形成放电产物,因此,电解液被认为是提高电池性能的关键影响因素之一。传统的有机电解液易挥发、氧电还原反应生成不易氧化分解的碳酸锂或烷基碳酸锂[4];与之相比,室温离子液体具有较小的挥发性、较高的离子电导率、较宽的电化学窗口和较高的溶解能力等特点,作为锂空气电池的电解质有利于提高电池性能。Takashi Kuboki[5]使用扣式电池,用疏水离子液体1-甲基-3-乙基咪唑双三氟甲基磺酸基酰亚胺在20℃下以0.01 mA/cm2的电流密度放电,放电容量达到5 360 mAh/g;Kedi Cai等[6]以0.8 mol/L的LiTFSI和0.05 mol/L的四丁基胺/1-甲基-3-丁基咪唑双三氟甲基磺酸基酰亚胺为电解液,在0.02 mA/cm2放电电流下,首次放电比容量达到1 300 mAh/g,放电电压达到2.5 V。Hun-Gi Jung[7]等以双三氟甲基磺酸基酰亚胺锂的二甲醚-四甘醇为电解液,在500 mA/g电流密度下放电,2.4 V以上能量密度达到5 000 mAh/g。尽管有关研究者取得了一些进展,但尚未能获得放电性能与三维多孔空气电极中电解质主要性能间的联系,影响了电池性能的提高。
本文选择了三种电化学窗口(>5 V)、电导率和疏水性较高、黏度较低的吡咯类室温离子液体PYR13TFSI、PYR14TFSI和PYR1(201)TFSI作为锂空气电池的电解液,拟通过实验测定其氧气溶解度、锂离子电导率随锂盐摩尔浓度的变化关系、氧还原反应动力学数据以及电池放电性能,探讨电池放电性能与电解质性质间的联系,为进一步提高锂空气电池的能量密度、功率密度奠定基础。
1 实验部分
1.1 化学试剂
除非另有说明,实验中所用化学试剂均为分析纯,不需要进一步的化学处理。PYR14TFSI (质量分数99.5%, Solvionic公司),PYR1(201)TFSI (质量分数99.4%, Merck公司), PYR13TFSI (质量分数99%, Solvionic公司)和LiTFSI (质量分数≥99%, Aldrich公司)在使用之前都先在70 ℃烘箱中真空条件下烘24 h,其分子结构示意图如图1所示。有机电解液为1mol/L的LiPF6-EC+DMC+EMC(VEC∶VDMC∶ VEMC=1∶1∶1)和N-甲基吡咯 (C5H9NO),分别购于诺莱特苏州科技有限公司和天津光复精细化学研究所。

图1 室温离子液体的分子结构式
1.2 测试方法及仪器
循环伏安曲线在标准三电极电化学系统中由VMP2多通道电化学工作站 (Princeton Αpplied Research,USA)测得。在该电化学系统中,以玻碳电极为工作电极,铂丝作为对电极,Ag/Ag+为参比电极。该参比电极参照文献[4]制备,即银线浸没在乙腈、0.01 mol/L硝酸银和0.1 mol/L四丁基高氯酸铵组成的参比溶液中。在实验中使用的3 mm直径的玻碳电极在每次实验之前均用0.05 mm 氧化铝粉抛光,所有的循环伏安实验均在水质量分数低于5×10-6、温度为25℃、充满氩气的手套箱里面进行。氧电还原实验前,电解液在25 ℃条件下用纯度为99.99%的氧气鼓泡至少30 min。扫描电压范围是-1.6~+0.8 V (vs Ag/Ag+),扫描速率范围是9~100 mV/s。不同锂盐质量摩尔浓度的离子液体溶液均在手套箱中配制完成。室温离子液体的电导率由DDS-11A型电导率仪(上海雷磁仪器厂)在25 ℃下测得;氧气溶解度由Unisense氧气测定仪(Unisense Inc., Denmark)测得。锂空气电池的放电曲线由图2所示的电池系统测得。空气阴极的电催化剂层由导电活性炭、α-MnO2催化剂[8]以及PVDF粉末混合物(三者质量比为63∶27∶10)挤压而成,120℃下烘干,泡沫镍作为电极电流集流体。金属锂阳极与空气阴极间的空间由有机电解液填充,三维空气阴极的微孔中浸满LiTFSI-RTILs室温离子液体。所有测试用的锂空气电池均在充满氩气的手套箱里组装,在充满氧气的密封塑料袋里面进行电池放电测试。放电曲线测试条件:在密封塑料袋里搁置3 h,让氧气在空气电极中充分扩散,放电电流流密度为0.05 mA·cm-2,截止电压控制为2.0 V.

1—不锈钢顶盖;2—空气阴极极片+离子液体;3—隔膜;4—金属锂片;5—聚四氟乙烯底座;6—不锈钢螺帽;7—不锈钢螺杆;8—电解液室;9—固定金属锂片不锈钢螺帽 10—不锈钢螺杆
2 结果与讨论
2.1PYR13TFSI,PYR14TFSI和PYR1(201)TFSI锂盐溶液的电导率和氧气溶解度
图3是在不同锂盐质量摩尔浓度下3种离子液体的电导率。由图可见,离子液体溶液的电导率随着锂盐质量摩尔浓度的增加而降低。这可能是离子的移动性受到黏度[9]和阴阳离子间相互作用[10]共同影响的结果。一般而言,随着锂盐含量的增加,较多的Li+被吸引到TFSI-附近,增大了溶液的黏度和离子强度,降低了离子迁移速率。在研究的锂盐质量摩尔浓度范围内,PYR13TFSI和PYR1(201)TFSI的电导率比较接近,明显高于PYR14TFSI的电导率,这可能与离子液体阳离子链的长度有关[11-12],因为PYR14+链的长度大于PYR13+。依据范德华体积原理,大π键的存在使得甲氧乙基具有较高的电子流[13], PYR1(201)+甲氧乙基基团因较强的共轭效应影响而比PYR14+链显得更加紧凑。

图3 不同锂盐质量摩尔浓度下PYR13TFSI,PYR14TFSI和PYR1(201)TFSI溶液的电导率
图4是在不同锂盐质量摩尔浓度下离子液体中氧气的饱和溶解度。从图中可以看出,纯的PYR14TFSI的氧气溶解度明显大于纯PYR13TFSI和PYR1(201)TFSI中的溶解度。Yuta Tani等[14]和Aki等[15]认为这一现象是熵而非焓的原因,离子液体阳离子链长度的增加,会降低离子液体的密度,增加离子液体的自由体积,从而更利于氧气的溶解。三种离子液体的氧气溶解度随着锂盐质量摩尔浓度的增加呈现先降低后升高的变化趋势,在锂盐质量摩尔浓度低于0.6 mol/kg的范围内,随着锂盐浓度的增大溶液黏度增大,氧气溶解度降低;原因可能是增加锂盐质量摩尔浓度会降低离子液体的自由体积,氧气的溶解度随之降低。而之后出现的上升的趋势可能是由于随着锂盐的增加,离子液体中溶解的分子氧和TFSI-之间的范德华力增强,从而使氧气的溶解明显增加。

图4 不同锂盐质量摩尔浓度下PYR13TFSI,PYR14TFSI和PYR1(201)TFSI溶液的氧饱和溶解度
2.2氧在PYR13TFSI, PYR14TFSI和PYR1(201)TFSI中的电还原特性
图5-a是在氧气饱和的3种纯离子液体玻碳工作电极上的循环伏安图。从图中可以看出,在-1.5~1.0 V之间出现了一对氧化还原峰,其中还原峰为溶解氧的电还原,氧化峰为氧还原产物的还原所致。在还原峰的位置-1.3~-1.2 V范围,PYR13TFSI、PYR14TFSI和PYR1(201)TFSI的起始还原电位分别为-1.05,-1.03,-1.09 V,还原峰电位分别是-1.26,-1.24,-1.25 V,还原峰电流分别是-30.0,-28.8,-26.2 μA。而氧化峰的位置在-1.2~-1.0 V之间,氧化峰电位分别为-1.13,-1.11,-1.06 V,氧化峰电流分别为14.4,18.6,10.0 μA。从还原峰的数据不难看出,PYR13TFSI和PYR14TFSI两种纯净的离子液体更有益于氧的电还原反应,而氧化峰峰电位和峰电流的相对大小关系与Cormac O. Laoire等[16]关于离子协调特性越高则溶解氧气的反应活性越低的研究结果相符。PYR13TFSI和PYR1(201)TFSI在-1.0 V左右出现了一个小的还原峰,而PYR14TFSI却不明显,我们认为可能是首次放电过程中在电极表面形成的SEI膜所致。
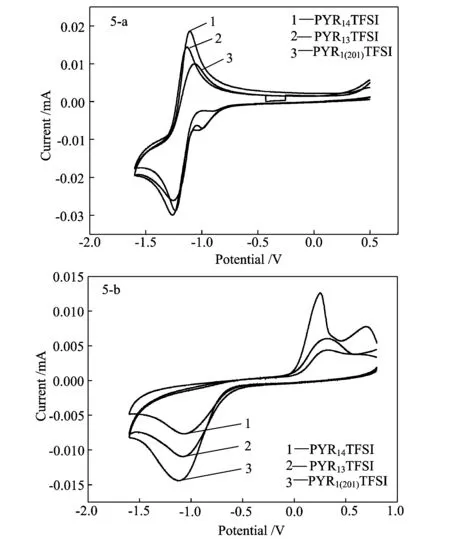
图5 氧饱和的纯净离子液体(5-a)和氧饱和的0.6 mol/kg LiTFSI离子液体溶液(5-b)在玻碳工作电极上的循环伏安曲线
图5-b是0.6 mol/kg锂盐质量摩尔浓度的3种离子液体在氧饱和状态下玻碳工作电极上的循环伏安曲线。在循环伏安曲线中有着一对不可逆的氧化还原峰,在-1.2~-1.0 V范围, PYR13TFSI,PYR14TFSI和PYR1(201)TFSI是氧还原的,起始还原电位分别为-0.37,-0.49,-0.55 V,峰电位分别为-1.08,-1.07,-1.11 V,峰电流分别为-11.0,-7.7,14.4 μA。在-1.2~-0.7 V之间的氧化峰,为放电产物氧化分解所致。和不添加锂盐的图5-a相比,锂盐的存在使得起始还原电位有较大的提高,但还原峰电流明显降低。总体而言,在加入锂盐后,这3种离子液体限制了氧还原反应。这可能是由于锂盐的加入降低了氧气在离子液体中的溶解度,或者氧还原产物吸附在电极表面造成了电极钝化[17]、溶液黏度增加引起氧扩散系数减小[18]的结果。而从图5-b看出,PYR1(201)TFSI在有锂盐存在的条件下,有着最大的还原峰电流,用该种离子液体作为电解液相对有利于电池放电功率的增加。
2.3PYR13TFSI,PYR14TFSI和PYR1(201)TFSI的溶解氧扩散系数
图6-a是不同扫描速度下氧饱和的PYR1(201)TFSI在玻碳电极上的循环伏安曲线。在-1.65~-0.55 V范围内,还原峰电流正比于扫速的平方根,这符合Randles-Sevick方程[19]:

(1)

图6 玻碳工作电极在不加锂盐(6-a)、添加0.6 mol/kg LiTFSI(6-b)条件下氧饱和的PYR1(201)TFSI溶液中的循环伏安曲线
式中:A是电极面积;c是氧气的浓度(mol/L);v是电位扫描速度;n是氧化还原过程中电子转移数;F是法拉第常数;D是氧气扩散系数。根据Md. Mominul Islam[20]和Chris J.Allen等[21]的研究结果,氧化还原过程中的电子转移数等于1。图6-b是0.6mol/kg锂盐质量摩尔浓度、不同扫描速度下氧饱和的PYR1(201)TFSI在玻碳电极的循环伏安曲线。
由图可知,还原峰电流与电位扫描速度的平方根成线性关系,满足Nicholson提出的方程[22-23]:
(2)
式中:Ip是还原峰电流;n是反应中总的电子转移数;A是玻碳电极面积;c是氧气的浓度;v是扫描速率;D是氧扩散系数;α是电子转移系数。
根据A.J.Bard等[19]和J.A.Harrison等[24]的理论,不可逆条件下峰电位和扫描速度的对数成线性关系(见图7)。

图7 0.6 mol/kg LiTFSI 的PYR1(201)TFSI溶液中还原峰电位(Epc)和电压扫速v关系(扫速为9~100 mV/s)
通过峰电位和扫描速度的对数的线性拟合,可得到电子转移系数α,进而求得氧扩散系数D(见图8)。

图8 离子液体溶液的氧扩散系数与锂盐质量摩尔浓度的关系
图8是不同锂盐浓度下三种离子液体锂盐溶液溶解氧的扩散系数曲线。由图可知,氧扩散系数和锂盐质量摩尔浓度呈负相关关系,盐质量摩尔浓度越高溶解度越低,在所测试的浓度范围,PYR1(201)TFSI和PYR13TFSI的氧扩散系数相近,且明显大于PYR14TFSI的氧扩散系数。据Marupatch Jamnongwong等人[25]的研究报道,氧扩散系数与溶剂中添加的溶质有关,满足D∝(1-kbn);其中k和n是经验系数,b是锂盐的质量摩尔浓度。本实验结果与该关系相一致。从离子液体溶液的电导率随锂盐变化的关系曲线(图3)可知,PYR1(201)TFSI和PYR13TFSI溶液有着相近的溶液电导率且大于PYR14TFSI溶液的电导率,而电导率受溶液黏度影响,电导率越高则黏度越小。由此我们可以推知,PYR1(201)TFSI和PYR13TFSI有着相近的溶液黏度且小于PYR14TFSI的。根据Stokes-Einstein方程[18],氧扩散系数满足D∝η-1这一关系,其中η是溶液黏度,因此就不难理解PYR1(201)TFSI和PYR13TFSI有着相近的氧扩散系数且大于PYR14TFSI这一实验现象。PYR1(201)TFSI和PYR13TFSI具有较大的氧扩散系数,说明这两种离子液体更利于电池的大倍率放电。
2.4空气电极中电解质对锂空气电池放电性能的影响

a—0.6 mol/kg LiTFSI-PYR13TFSI, b—0.6 mol/kg LiTFSI-PYR14TFSI, c—0.6 mol/kg LiTFSI-PYR1(201)TFSI,d—1 mol/L LiPF6-EC+DMC+EMC(VEC∶VDMC∶VEMC=1∶1∶1)
图9是空气电极中分别填充锂盐质量摩尔浓度为0.6 mol/kg的3种吡咯类离子液体和锂盐浓度为1 mol/L的有机电解液的锂空气电池在0.05 mA/cm2放电电流密度下首次放电电压与放电容量的关系。由图可知,3种离子液体中PYR13TFSI有着最高的放电电压和最宽的放电平台,2.0 V电压以上的电容量为1 279 mAh/g,在有效工作时间内平均放电电压最高,达到2.76 V;PYR14TFSI和PYR1(201)TFSI的放电曲线较为接近(约为2.65 V,2.63 V),其放电电压略低于PYR13TFSI,放电容量分别为1 074和1 083 mAh/g。由图5-b中3种离子液体的氧还原起始电位可知,它们的起始电位很接近,但PYR1(201)TFSI的峰电流最大,PYR13TFSI略低,而PYR14TFSI最低。由此推测,以这3种离子液体作为空气电极填充的电解质,在相同的电流密度下,填充PYR1(201)TFSI的空气电极将具有相对最小的反应过电位,填充PYR14TFSI的空气电极具有最大的反应过电位,不过,峰电流的差距并不是很明显,反应过电位的差距应该不显著。由欧姆定律可知,在放电电流恒定的条件下,欧姆过电位与离子液体溶液的电导率成反比。而由图3可知,填充PYR1(201)TFSI的空气电极有着最小的欧姆过电位,而填充PYR14TFSI的欧姆过电位最大。从图8的氧扩散系数可知,在相同的氧扩散浓度梯度下,三种离子液体中浓差过电位遵从这样的规律:EPYR1(201)TFSI≈EPYR13TFSI 本实验使用相同的方法制备空气阴极,可以忽略空气阴极结构对放电容量的影响,说明电解液的性质是影响锂空气电池放电容量的一个主要因素。由图3和图8可知,PYR13TFSI不仅有着最大的电导率而且还有着较高的氧扩散系数,而PYR14TFSI的电导率和氧扩散系数最小。由放电容量可知,电导率和氧扩散系数越大,单位时间内电化学反应就越快,放电电容就越高,反之,则相反。填充有机电解液的电池放电电压和放电容量相比较,其放电容量(737 mAh/g)分别是添加PYR13TFSI、PYR14TFSI和PYR1(201)TFSI的锂空气电池放电容量的0.59,0.69,0.68倍,由此我们认为这可能是有机电解中氧扩散系数或者锂离子电导率较低的缘故。 离子液体的物理和电化学表征显示,离子液体溶液中锂离子电导率和氧扩散系数随着锂盐LiTFSI浓度的增大而变小,氧气溶解度随着锂盐质量摩尔浓度的增加先降低后升高。氧气在PYR13TFSI、PYR14TFSI、PYR1(201)TFSI三种室温离子液体中的溶解度约在40~65 μmol/L范围,其中,氧在PYR14TFSI中的溶解度显著高于其它两者,并随LiTFSI质量摩尔浓度增加显著降低,而在PYR13TFSI、PYR1(201)TFSI中则略有降低;氧的扩散系数随LiTFSI质量摩尔浓度增加均明显降低,其中在PYR13TFSI、PYR1(201)TFSI中的扩散系数相对较高;类似地,电导率也随LiTFSI质量摩尔浓度增加有所降低,PYR13TFSI和PYR1(201)TFSI锂盐溶液的电导率较为接近,明显高于PYR14TFSI锂盐溶液。以玻碳电极为工作电极,在三种离子液体中加入LiTFSI后氧还原反应活性有所降低。添加PYR14TFSI、PYR1(201)TFSI和有机电解液锂空气电池的放电电压平台相近,均小于PYR13TFSI锂空气电池;而添加有机电解液锂空气电池的放电容量分别是添加PYR13TFSI、PYR14TFSI和PYR1(201)TFSI锂空气电池放电容量的0.59,0.69,0.68倍。以这3种离子液体锂盐溶液为空气电极的电解质,锂空气电池的放电性能高于传统有机电解质电池的性能。这与离子液体锂盐溶液中氧的溶解度和电导率较高直接相关,提高电解质中氧的溶解度和电导率是提高锂空气电池放电性能的有效途径。 [1] Tarascon J M, Armand M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414: 359-367. [2] Bruce P G, Freunberger S A, Hardwick L J, et al. Li-O2and Li-S batteries with high energy storage[J]. Nature Materials, 2011, 11(1): 19-29. [3] Abraham K M, Jiang Z, Carroll B. Highly conductive PEO-like polymer electrolytes[J]. Chemistry of Materials, 1997, 9(9): 1978-1988. [4] Mizuno F, Nakanishi S, Shirasawa A, et al. Design of non-aqueous liquid electrolytes for rechargeable Li-O2batteries[J]. Electrochemistry, 2011, 79(11): 876-881. [5] Kuboki T, Okuyama T, Ohsaki T, et al. Lithium-air batteries using hydrophobic room temperature ionic liquid electrolyte[J]. Journal of Power Sources, 2005, 146(1): 766-769. [6] Cai K, Pu W, Gao Y, et al. Investigation of ionic liquid composite electrolyte for lithium-oxygen battery[J]. International Journal of Hydrogen Energy, 2013, 38(25): 11023-11027. [7] Jung H G, Hassoun J, Park J B, et al. An improved high-performance lithium-air battery[J]. Nature Chemistry, 2012, 4(7): 579-585. [8] 刘世斌, 周娴娴, 池永庆, 等. 纳米二氧化锰的制备及其形貌调控[J]. 太原理工大学学报, 2011, 42(4): 369-374. [9] Matsumoto H, Sakaebe H, Tatsumi K, et al. Fast cycling of Li/LiCoO2cell with low-viscosity ionic liquids based on bis (fluorosulfonyl) imide [FSI]-[J]. Journal of Power Sources, 2006, 160(2): 1308-1313. [10] Diaw M, Chagnes A, Carre B, et al. Mixed ionic liquid as electrolyte for lithium batteries[J]. Journal of Power Sources, 2005, 146(1): 682-684. [11] Han H B, Nie J, Liu K, et al. Ionic liquids and plastic crystals based on tertiary sulfonium and bis (fluorosulfonyl) imide[J]. Electrochimica Acta, 2010, 55(3): 1221-1226. [12] Appetecchi G B, Montanino M, Carewska M, et al. Chemical-physical properties of bis (perfluoroalkylsulfonyl) imide-based ionic liquids[J]. Electrochimica Acta, 2011, 56(3): 1300-1307. [13] Kanakubo M, Nanjo H, Nishida T, et al. Density, viscosity, and electrical conductivity of N-methoxymethyl-N-methylpyrrolidinium bis (trifluoromethanesulfonyl) amide[J]. Fluid Phase Equilibria, 2011, 302(1): 10-13. [14] Tani Y, Nohira T, Enomoto T, et al. Solubility and diffusion coefficient of oxygen in 1-ethyl-1-methylpyrrolidinium fluorohydrogenate room temperature ionic liquid at 298~373 K [J]. Electrochimica Acta, 2011, 56(11): 3852-3856. [15] Aki S N V K, Mellein B R, Saurer E M, et al. High-pressure phase behavior of carbon dioxide with imidazolium-based ionic liquids[J]. The Journal of Physical Chemistry B, 2004, 108(52): 20355-20365. [16] Laoire C O, Mukerjee S, Abraham K M, et al. Elucidating the mechanism of oxygen reduction for lithium-air battery applications[J]. The Journal of Physical Chemistry C, 2009, 113(46): 20127-20134. [17] De Giorgio F, Soavi F, Mastragostino M. Effect of lithium ions on oxygen reduction in ionic liquid-based electrolytes[J]. Electrochemistry Communications, 2011, 13(10): 1090-1093. [18] Huang X J, Rogers E I, Hardacre C, et al. The reduction of oxygen in various room temperature ionic liquids in the temperature range 293~318 K: Exploring the applicability of the Stokes-Einstein relationship in room temperature ionic liquids[J]. The Journal of Physical Chemistry B, 2009, 113(26): 8953-8959. [19] Bard A J, Faulkner L R. Electrochemical Methods: Fundamentals and Applications[M]. New York: Wiley, 1980. [20] Islam M M, Ferdousi B N, Okajima T, et al. A catalytic activity of a mercury electrode towards dioxygen reduction in room-temperature ionic liquids[J]. Electrochemistry communications, 2005, 7(7): 789-795. [21] Allen C J, Mukerjee S, Plichta E J, et al. Oxygen electrode rechargeability in an ionic liquid for the Li-air battery[J]. The Journal of Physical Chemistry Letters, 2011, 2(19): 2420-2424. [22] Nicholson R S. Theory and application of cyclic voltammetry for measurement of electrode reaction kinetics[J]. Analytical Chemistry, 1965, 37(11): 1351-1355. [23] Nicholson R S, Shain I. Theory of stationary electrode polarography:Single scan and cyclic methods applied to reversible, irreversible, and kinetic systems[J]. Analytical Chemistry, 1964, 36(4): 706-723. [24] Harrison J A, Khan Z A. The oxidation of hydrazine on platinum in acid solution[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1970, 28(1): 131-138. [25] Jamnongwong M, Loubiere K, Dietrich N, et al. Experimental study of oxygen diffusion coefficients in clean water containing salt, glucose or surfactant: consequences on the liquid-side mass transfer coefficients[J]. Chemical Engineering Journal, 2010, 165(3): 758-768. (编辑:张红霞) Pyrrolidinium-basedIonicLiquidsasElectrolytesandDischargePerformanceforLithiumAirCell SUNYanbo,LIYu,HUANGYanfang,DUANDonghong,HAOXiaogang,LIUShibin (InstituteofCleanTechniqueforChemicalEngineering,TaiyuanUniversityofTechnology,Taiyuan030024,China) The ionic liquids were characterized by cyclic voltammetry and cell discharge/charge test and other measurements in order to study the saturated oxygen solubility, electrolyte conductivity and oxygen electro chemical properties with varying Li-salt concentration for N-butyl-N-methyl pyrrolidinium bis (trifluoromethanesulfonyl) imide (PYR14TFSI), N-methoxyethyl-N-methyl pyrrolidinium bis (trifluoromethanesulfonyl) imide (PYR1(201)TFSI) and N-propyl-N-methyl pyrrolidinium bis (trifluoromethanesulfonyl) imide (PYR13TFSI). The results show that the electrolyte conductivity and oxygen diffusion coefficient in RTILs electrolytes were inversely proportional to Li-salt concentration. The saturated oxygen solubility dectreased and then increased with the increase of Li-salt concentration in RTILs. The activity of oxygen reduction was best in PYR1(201)TFSI and worst in PYR14TFSI in the presence of 0.6 mol/kg LiTFSI. The discharge capacity for lithium air cell with PYR14TFSI, PYR1(201)TFSI and PYR13TFSI in the presence of 0.6 mol/kg LiTFSI was 1 068, 1 084,1 249 mAh/g, respectively. Lithium air cell with 0.6 mol/kg LiTFSI-PYR13TFSI had the highest discharge plateau and obviously higher than the lithium air cell with organic electrolyte (VEC∶VDMC∶VEMC=1∶1∶1). ionic liquid;electrolyte conductivity;oxygen solubility;oxygen diffusion coefficient;lithium air cell 2013-04-18 国家自然科学基金资助项目(20676088);教育部博士点基金项目(20091402110009) 孙彦波(1988-),男,河南漯河人,硕士,主要从事锂空气电池研究,(Tel)18734852852 刘世斌,男,博士,教授,博导,(Tel)0351-6111062 1007-9432(2014)01-0085-07 TQ152 :A3 结论
